发酵豆粕替代鱼粉对大口黑鲈生长、生化指标及肠道健康的影响
■胡俊茹 蓝 青 张春燕 宋 鹏 陈晓瑛 黄玲玲*
(1.广东省农业科学院动物科学研究所,农业农村部华南动物营养与饲料重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广东广州 510640;2.丰益(上海)生物技术研发中心有限公司,上海 200137)
鱼粉作为水产饲料中不可或缺的优质蛋白源,可为水生动物提供生长所需的蛋白质和氨基酸,然而随着全球性的酷渔滥捕,当前全球鱼粉开采量已趋于饱和,鱼粉的全球性缺乏已成为制约水产增养殖业可持续发展的重要影响因素[1-2]。大口黑鲈(Micropterussalmoides)又名加州鲈,肉质鲜美、无肌间刺、生长快、易起捕、适温广,正成为“第五大家鱼”的潜力品种,市场前景广阔。现有大口黑鲈饲料中鱼粉用量高达35%~50%,对鱼粉依赖性强,大大增加了饲料成本,在鱼粉供需矛盾突出的现有形势下,寻找鱼粉替代物降低鱼粉依赖和养殖成本对大口黑鲈养殖业健康可持续发展具有重要的意义。
豆(饼)粕作为优质的植物蛋白源,具有资源丰富、价格合理等优点,在水产饲料中广为使用。豆粕与其他植物源性蛋白质原料相比,具有营养价值高的特点,如含有较高的赖氨酸和蛋白质含量,且氨基酸组成均衡。但豆粕也含有多种抗营养因子和致敏因子,基础饲料豆粕过高,不仅会引起水产动物肠道损伤,而且会导致肝脏组织病变、生理异常及生长速度下降[3-5]。针对这些问题通过物理或化学方法去除豆粕中的抗营养因子,提高其营养价值和利用率具有重要的生产促进意义。发酵是去除豆粕中抗营养因子的一种经济有效的手段,随着发酵技术的日渐成熟,我国发酵豆粕消费量已从2016 年的50 万吨左右,以年均复合增长率约为20%的速度增长,大型饲料企业对发酵豆粕的接受程度越来越高[6]。然而不同厂家使用的发酵菌种、发酵模式、发酵工艺条件、干燥工艺等的差异直接影响发酵豆粕的质量和稳定性,导致产品营养成分差异很大、品质参差不齐[7],研究显示,使用的发酵豆粕不同,大口黑鲈中鱼粉的替代量存在差异,发酵豆粕占实际配方的10%到20%不等[8-12]。为此,从精准营养的角度来讲,开展不同厂家、不同工艺发酵豆粕替代鱼粉对水产动物生长及生理健康的研究,将对发酵豆粕的精准应用,低鱼粉配合饲料的研制与应用提供重要支撑,实验拟从生长性能、肠道结构及微生物多样性等方面综合评价发酵豆粕替代鱼粉的效果,为发酵豆粕在大口黑鲈饲料中的合理应用提供理论依据。
1 材料与方法
1.1 实验饲料
以鱼粉、玉米蛋白粉、鸡肉粉、血粉作为蛋白质源,鱼油、豆油、磷脂油作为脂肪源,分别用发酵豆粕替代基础饲料中0、10%、20%、30%、40%、50%的鱼粉配制6 种等氮(49.87%)等能(18.31 MJ/kg)的实验饲料,分别记为G0、G10、G20、G30、G40、G50 组。原料粉碎过筛(60 目)后,根据实验配方表,将各组原料依次混匀后置于V型搅拌机充分搅拌20 min;加入鱼油、豆油、磷脂油和30%的水,搅拌均匀后用双螺杆挤条机(F-75型,华南理工大学研制)制粒成直径为1.5 mm的硬颗粒沉性饲料[制粒温度为(43±2)℃],置于烘箱内54 ℃烘干,回潮12 h 后装袋密封,于-20 ℃保存备用。发酵豆粕采用乳酸菌厌氧发酵,30 ℃左右固体发酵72 h,55 ℃低温干燥。鱼粉和发酵豆粕常规营养成分见表1,鱼粉和发酵豆粕氨基酸组成分别为:赖氨酸5.31%、2.22%;蛋氨酸2.00%、0.78%;苏氨酸3.08%、1.91%;丙氨酸4.11%、2.22%;精氨酸3.96%、3.39%;天门冬氨酸6.44%、5.41%;谷氨酸9.12%、8.69%;组氨酸2.23%、1.22%;异亮氨酸2.94%、2.35%;亮氨酸5.33%、4.05%。饲料配方组成见表2,饲料营养水平见表3。

表1 鱼粉和发酵豆粕营养水平(风干重,%)
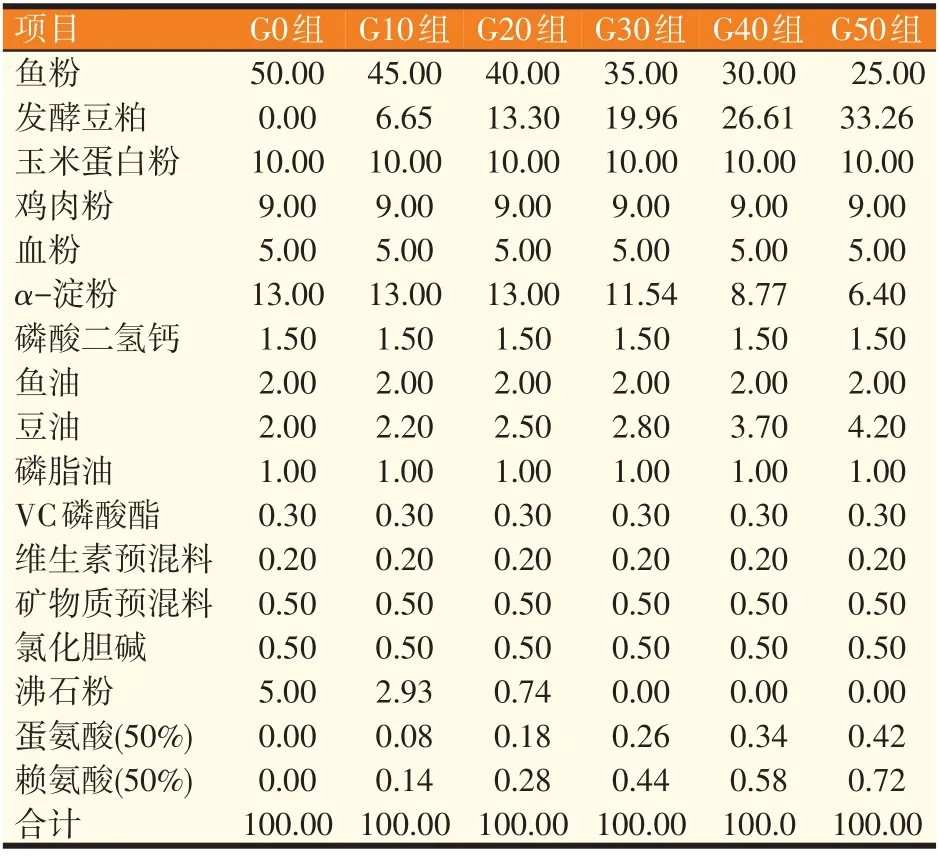
表2 实验饲料组成(风干重,%)

表3 饲料营养水平实测值(%)
1.2 实验鱼与饲养管理
大口黑鲈幼鱼购于佛山市三水白金水产种苗有限公司,暂养期间,投喂大口黑鲈商品配合饲料。暂养结束后,挑选大小均匀的大口黑鲈幼鱼540尾[初始重(7.75±0.05)g],随机分到18个循环水养殖缸内,每缸水体350 L,水体流速0.40 m3/h,实验共6 个处理组,每组3个重复,每个重复30尾鱼。养殖过程中每天饱食投喂2 次(09:00 和16:00),记录水温、气温、pH、摄食量及死亡情况等。养殖期间水温25.5~31.5 ℃,pH 7.7~7.9,氨氮<0.1 mg/L,亚硝酸盐<0.002 mg/L,溶氧6.00~7.88 mg/L。养殖实验周期为58 d,于广东省农业科学院动物科学研究所室内循环水养殖系统内进行。
1.3 样品采集和分析
养殖实验结束后,鱼体饥饿24 h,统计每缸大口黑鲈尾数,并进行称重。每缸随机取3 尾鱼-20 ℃保存,用于全鱼营养成分分析;另取12尾鱼,经40 mg/L MS-222 麻醉后,静脉取血,4 000 r/min 离心10 min(4 ℃),取上层血清于-80 ℃保存,用于血清生化指标测定。取血后测量体长、体重,并取其中6 尾鱼进行解剖,测定肠重、肝脏重及腹脂重;3尾鱼取前肠,置于Bouin’s液中固定用于组织切片制作;3尾鱼于无菌环境下取后肠,置于无酶管,液氮冷冻保存用于肠道微生物多样性分析。
实验饲料、全鱼营养成分的测定方法如下:粗脂肪含量测定采用索氏抽提法(GB/T 6433—2006);灰分含量测定采用550 ℃灼烧法(GB/T 6438—2007);水分含量测定采用105 ℃烘干法(GB/T 6435—2014);粗蛋白含量采用半自动凯氏定氮仪测定(GB/T 6432—2018);氨基酸组成及含量采用Agilent 1260高效液相色谱仪测定。
血清总蛋白(Total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLOB)血糖(Glucose,GLU)、三酰甘油(Triglycerides,TG)、高密度脂蛋白胆固醇(High density lipoprotein Cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low density lipoprotein Cholesterol,LDL-C)、胆固醇(Cholesterol,CHO)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)生化指标采用全自动生化分析仪(日立7600,日本)及生化试剂盒进行检测分析。
肠道组织切片制作方法参考钟国防等[13],组织样本经脱水、透明、包埋、切片、染色、封片等处理后,置于显微镜下观察前肠组织结构。
委托广州基迪奥生物科技有限公司提取后肠道的微生物基因组DNA,针对细菌16S rDNA 基因V3、V4 区片段设计引物:341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT,目的片段大小466 bp,参考郝爽等[14]方法,通过16S rRNA 序列分析生物群落。
1.4 计算公式及统计分析方法
增重率(WGR,%)=100×(实验期末均重-实验期初均重)/实验期初均重
存活率(SR,%)=100×实验期末鱼尾数/实验期初鱼尾数
饲料系数(FCR)=摄入饲料质量/(末总重+死亡重-初始总重)
摄食率(FI,g/尾)=摄入饲料质量/[(初始鱼尾数+终末鱼尾数)/2]
肥满度(CF,g/cm3)=100×全鱼体重(g)/[鱼体长(cm)]3
肝体比(HSI,%)=100×肝脏重(g)/鱼体重(g)
腹脂率(IPF,%)=100×腹腔脂肪重(g)/全鱼体重(g)
肠体比(ISI,%)=100×肠重(g)/体重(g)
式中,摄入饲料质量以风干重计算。
实验数据用“平均值±标准误差(n=3)”表示。采用SPSS 17.0软件进行统计分析。首先对数据进行正态分布与方差齐性检验,若满足正态分布和方差齐性则采用单因素方差分析(one-way ANOVA),差异显著再用Duncan’s 检验方法进行多重比较;若不满足方差齐性则采用Dunnett’st3检验法进行多重比较,P<0.05 表示差异显著。微生物Alpha 多样性采用t检验法,P<0.05表示差异显著。
2 结果与分析
2.1 发酵豆粕替代鱼粉对大口黑鲈生长性能的影响
由表4 可知,除G10 组末均重与G0 组比较差异不显著外,其余替代组末均重、增重率、特定生长率都高于G0 组,且差异显著(P<0.05);G10~G40 组饲料系数与G0 组比较差异不显著(P>0.05),但G50 组显著高于G0 组(P<0.05);各组存活率无显著差异(P>0.05);随着发酵豆粕添加量的增加,摄食率增加,G50 组显著高于其他组(P<0.05)。

表4 发酵豆粕替代鱼粉对大口黑鲈生长性能的影响(n=3)
2.2 发酵豆粕替代鱼粉对大口黑鲈形体指标的影响
由表5 可知,各组间肥满度差异不显著(P>0.05);随着替代水平的增加,肝体比下降,腹脂率升高,G40~G50 组肝体比显著低于G0 组(P<0.05),G50组腹脂率和肠体比显著高于G0组(P<0.05)。

表5 发酵豆粕替代鱼粉对大口黑鲈形体指标的影响(n=18)
2.3 发酵豆粕替代鱼粉对大口黑鲈体成分的影响
由表6可知,发酵豆粕替代鱼粉鱼体粗蛋白含量降低,粗脂肪含量升高,替代水平超过20%时差异达到显著水平(P<0.05)。发酵豆粕替代鱼粉降低了鱼体灰分含量,但组间差异不显著(P>0.05)。

表6 发酵豆粕替代鱼粉对大口黑鲈体成分的影响(n=3)(%)
2.4 发酵豆粕替代鱼粉对大口黑鲈血清生化指标的影响
由表7 可知,当替代水平为20%以及超过20%时,白蛋白、总蛋白显著高于G0 组(P<0.05),替代水平超过30%时高密度脂蛋白胆固醇显著升高(P<0.05)。胆固醇、三酰甘油、低密度脂蛋白胆固醇、谷草转氨酶较G0组降低,当替代水平超过40%时,显著低于G0组(P<0.05)。

表7 发酵豆粕替代鱼粉对大口黑鲈血清生化指标的影响(n=3)
2.5 发酵豆粕替代鱼粉对大口黑鲈前肠组织结构发育的影响
由表8 可知,与G0 组相比,发酵豆粕替代40%的鱼粉显著提高了大口黑鲈前肠的绒毛高度和黏膜层厚度(P<0.05),但对绒毛宽度、肌层厚度和单位面积杯状细胞数无显著影响(P>0.05)。

表8 发酵豆粕替代鱼粉对大口黑鲈肠道组织发育的影响(n=3)
2.6 发酵豆粕替代鱼粉对大口黑鲈后肠微生物多样性的影响
Chao1和ACE指数反映群落丰富度,数值越大,表明群落的丰富度越高。香农—威纳指数和辛普森指数反映群落的多样性,数值越大,表明群落的多样性越高。比较大口黑鲈后肠道微生物多样性指数,由表9可知,辛普森指数、Chao1和香农—威纳指数G50组显著高于G0组,ACE和辛普森指数差异不显著(P>0.05)。

表9 发酵豆粕替代鱼粉对大口黑鲈肠道微生物Alpha多样性的影响(n=3)
如图1所示,在门分类水平上,G50组各样品的细菌群落组成较G0组丰富,2个处理组的肠道优势菌群较为一致,核心菌群相对丰度最高的是梭杆菌门(Fusobacteria),其次是变形菌门(Proteobacteria)和软壁菌门(Tenericutes),在G0组和G50组分别占肠道菌群比例的62.58%和49.09%、33.64%和10.18%、3.38%和33.02%,三种菌群在各样本中变化较大。

图1 G0和G50组肠道菌群在门水平上的群落组成
比较G0组和G50组肠道细菌在门水平和属水平的差异,发现G50组大口黑鲈肠道中的软壁菌门和放线菌门(Actinobacteria)相对丰度显著上升(P<0.05)(见图2a)。在属水平,支原体(mycoplasma)、柠檬酸菌(Citrobacter)、不动杆菌属(Acinetobacter)和乳杆菌(Lactobacillus)的丰度显著升高(见图2b)。与G0组比较,G50 组肠道菌群KEGG pathway(level 2)丰度组成,发现糖代谢(Carbohydrate metabolism)、辅助因子和维生素的代谢(metabolism of cofactors and vitamins)、氨基酸代谢(Metabolism of other amino acids)、能量代谢(energy metabolism)、脂代谢(Lipid metabolism)通路显著差异(见图3),可见发酵豆粕对肠道细菌的代谢功能有显著影响。由图4 可见,G50 组大口黑鲈肠道微生物与增重率、末均重相关的属有拟杆菌(Bacteroides)、巨单胞菌属(Megamonas)、弯曲杆菌(Campylobacter)、粪杆菌属(Faecalibacterium)等。

图2 大口黑鲈肠道微生物在门水平(a)和属水平(b)上差异菌群分析

图3 与G0组比较,G50组肠道菌群KEGG pathway 丰度组成

图4 G50组肠道微生物与生长指标的相关性
3 讨论
3.1 发酵豆粕替代鱼粉对大口黑鲈生长性能的影响
本实验结果显示,当基础饲料中鱼粉用量为50%,发酵豆粕替代水平从10%增加到50%,大口黑鲈的生长性能随着替代量的增加而提高,50%组(占饲料配方的33.26%)增重率和特定生长率最高。已有不少研究表明,发酵或酶解豆粕能够部分替代大口黑鲈饲料中的鱼粉。田鑫鑫等[9]研究发现枯草芽孢杆菌有氧发酵豆粕可替代20%~30%鱼粉(基础鱼粉用量50%),发酵豆粕占实际配方的15%~20%,He 等[12]在鱼粉用量为35%的基础饲料中得到发酵豆粕可替代35%的鱼粉,饲料中用量为15.68%。而王新霞[10]和赵鹏飞[11]认为大口黑鲈饲料中可添加10%或13.5%的发酵豆粕对大口黑鲈生长无显著影响。张改改等[8]研究发现酶解豆粕与发酵豆粕均可以替代30.91%鱼粉,而陈晓瑛等[15]认为菌酶协同发酵豆粕替代比例宜低于20%。本实验所得替代量明显高于其他研究,饲料组成、氨基酸组成以及实验环境、鱼体大小等影响替代量的高低,发酵或酶解工艺不同导致的酸溶蛋白、有机酸、小肽、氨基酸等物质种类和含量的存在一定的差异[16-17],Shinen等[18]研究发现豆粕深度发酵72 h提高了黄狮鱼(Seriolaquinqueradiata)的生长性能、蛋白质消化率和生化指标,而发酵48 h对生长性能无影响。Choid等[19]使用两种不同发酵工艺生产的豆粕替代鱼粉,虹鳟(Oncorhynchus mykiss)的生长性能也存在差异。Yamamoto 等[20]以两种不同发酵工艺(一种为初始加水300 g/kg,发酵为7 h;另一种为初始加水450 g/kg发酵为10 h)生产的豆粕替代鱼粉投喂虹鳟,第一种发酵豆粕显著提高了远端肠道形态异常,而第二种则无显著影响。本实验发酵豆粕酸溶蛋白高达20%,高于陈晓瑛等[15]报道菌酶协同发酵豆粕中酸溶蛋白的含量。酸溶蛋白含量作为评价发酵饲料蛋白品质指标,一方面可以揭示抗营养因子活性被消除的程度,另一方面又可在一定程度上反映肽含量的高低[21],饲料中酸溶蛋白比例较高可明显提高畜禽对蛋白质的消化吸收[22]。
研究发现,发酵豆粕替代鱼粉后可以提高动物的摄食量,主要是因为豆粕经乳酸菌发酵后产生的乳酸、甜味肽、鲜味肽及谷氨酸、丙氨酸等游离氨基酸均能提高饲料的诱食性;此外,豆粕中的部分碳水化合物在发酵过程中被微生物进行了一定程度的降解,使得发酵豆粕结构变得疏松,从而提高了适口性[23-25]。本实验发现当替代水平达到50%时,饲料系数显著高于对照组,这与Choid 等[19]在大口黑鲈,Eschenia 等[26]在黄金鲈(Percaflavescens),Lim 等[27]在罗非鱼(Oreochromisniloticus)以及Barnes等[28]在虹鳟中得到的研究结果一致,研究显示虽然随着发酵豆粕替代比例增加摄食提高,但超过一定比例营养物质的消化率和保留率降低[9,19],这可能导致了饲料系数升高。
形体指标和体组成可用来反映动物生长发育和健康状况。研究发现酶解豆粕、发酵豆粕、菌酶协同发酵豆粕、发酵豆渣替代鱼粉会导致大口黑鲈肝体比显著降低[8,10,15,29],本实验中肝体比随着发酵豆粕替代水平的增加而降低,这与上述研究结果一致,分析认为发酵豆粕中的大豆异黄酮、膳食纤维、大豆多糖等具有减少肝脏脂肪沉积的作用[11]。本实验中随着发酵豆粕替代水平的增加,大口黑鲈腹脂率、体脂肪含量升高,这与陈乃松等[29]报道的随着酶解豆粕配比增加大口黑鲈体脂含量、脂肪消化率、脂肪沉积率升高的研究结果一致。然而也有研究表明发酵/酶解豆粕替代鱼粉降低了大口黑鲈[8,10,15]、凡纳滨对虾(Litopenaeusvannamei)[30]、梭鱼(Lizahaematocheila)[31]、巨型石斑鱼(Epinephelus lanceolatus)[32]、鲳参鱼(Trachinotusblochii)[33]的体脂肪含量,研究认为脂肪表观消化率显著降低可能是导致体脂下降的原因之一[32-33]。本实验采用等氮、等能配方设计,随着发酵豆粕替代水平的升高,配方中豆油用量增加,这或许导致了实验鱼体脂肪的沉积。徐茜等[34]研究发现发酵豆粕替代适宜比例的鱼粉显著提高了鲫鱼(Carassiusauratus)的肠体比,本研究结果与其具有一致性。
3.2 发酵豆粕替代鱼粉对大口黑鲈血清生化指标的影响
血清生化指标可反映鱼体自身的营养及健康状况[35]。本实验中血清总蛋白含量显著升高,这与适量发酵豆渣/豆粕替代鱼粉提高大口黑鲈血清总蛋白含量的研究结果一致[29,36],血清总蛋白含量反映了动物蛋白质的代谢状况[37],何明[38]推测豆粕发酵过程中产生的部分小肽可能影响大口黑鲈蛋白质的合成和氮的沉积。但也有研究表明血清总蛋白含量不受发酵豆粕比例的影响[39],这可能与发酵豆粕来源、饲料组成和鱼的种类有关。血清中总胆固醇和三酰甘油的含量反映了动物脂类代谢状况。Nguyenh 等[33]和He等[40]研究发现一定比例发酵豆粕替代鱼粉可以显著降低大口黑鲈血清总胆固醇含量,菌酶协同豆粕替代鱼粉显著降低大口黑鲈三酰甘油含量[15]。本实验亦发现发酵豆粕降低大口黑鲈血清胆固醇和三酰甘油含量。研究表明大豆蛋白中蛋白酶水解的肽,大豆中的异黄酮具有降低胆固醇和三酰甘油的作用[41-42]。低密度脂蛋白胆固醇是将由肝脏合成的胆固醇转运到机体组织中,而高密度脂蛋白胆固醇的作用是将机体组织中的胆固醇运回至肝脏产生代谢物排出,本实验发酵豆粕替代量增加降低了低密度脂蛋白胆固醇的含量,提高高密度脂蛋白胆固醇的含量,说明发酵豆粕提高了肝脏脂代谢能力,减少肝脏脂类沉积。
3.3 发酵豆粕替代鱼粉对大口黑鲈肠道组织结构的影响
肠道是鱼类吸收营养物质的主要场所,对于鱼类生长具有重要意义。肠道组织形态学指标主要包括:肠道绒毛高度、宽度、黏膜厚度、肌层厚度和杯状细胞数量等,均可以反映鱼类肠道健康状况和消化吸收功能。本研究结果发现,发酵豆粕具有促进肠绒毛高度、肌层厚度的作用,在40%替代组差异最显著。赵鹏飞[11]研究发现发酵豆渣可以提高大口黑鲈肠道绒毛高度和杯状细胞数,而钟国防等[36]的研究显示发酵豆粕替代30%鱼粉显著提高了肠绒毛高度和宽度,但显著降低了肌层厚度,He等[40]发现发酵豆粕替代60%鱼粉肠绒毛宽度显著下降,但对肠绒毛高度、肌层厚度无显著影响。肠道组织结构的差异与发酵豆粕替代水平及发酵工艺有很大关系[40]。
3.4 发酵豆粕替代鱼粉对大口黑鲈肠道微生物多样性的影响
水产动物肠道中存在大量的微生物,它们在长期的历史进化过程中形成了一个动态的复杂的微环境,在这个微环境中,肠道微生物是否维持稳态,直接影响着鱼体的消化吸收,在氨基酸、酶、短链脂肪酸、微生物和矿物质等的形成上具有重要的营养作用[43-44]。本研究发现发酵豆粕替代鱼粉后,大口黑鲈肠道微生物多样性升高,这与He等[12]报道的发酵豆粕替代30%鱼粉大口黑鲈肠道微生物菌群多样性升高的结果具有一致性。上述结果表明,发酵豆粕中含有的大量有益微生物(如乳酸菌),这些有益微生物具有类似抗生素的作用,适量的替代量在一定程度上能增加肠道微生物的多样性。本研究结果表明大口黑鲈肠道微生物主要由梭杆菌门、变形菌门和软壁菌门组成,摄食发酵豆粕的大口黑鲈肠道内梭杆菌门和变形菌门丰度降低,软壁菌门丰度升高,这与He等[12]发现的适量发酵豆粕替代鱼粉大口黑鲈肠道微生物主要组成及变化趋势一致,研究显示软壁菌门对鱼体生长和抑制致病细菌有积极作用[45]。而Shao 等[46]在凡纳滨对虾上的研究则表明,发酵豆粕替代鱼粉不会对肠道微生物产生显著性的影响,导致研究结果不同的原因可能与豆粕发酵过程中抗营养因子钝化程度、养殖环境、饵料摄入、生长发育阶段、物种等因素有关。
支原体、柠檬酸菌、不动杆菌普遍被认为是有害菌或潜在有害菌,而乳酸菌可以通过产生酸性物质降低肠道pH,从而抑制致病菌增殖。发酵豆粕替代50%的鱼粉大口黑鲈肠道乳酸菌、支原体、柠檬酸菌、不动杆菌这些菌落丰度也随之显著升高。支原体的繁殖需要葡萄糖和果糖,葡萄糖和果糖是豆粕发酵的产物,这也许能够解释发酵豆粕组支原体丰度升高的原因[12,47]。G50 组肠道菌群KEGG pathway 丰度组成显著影响糖代谢、辅助因子和维生素的代谢、氨基酸代谢、能量代谢、脂代谢通路等,本研究显示发酵豆粕对大口黑鲈体脂、血脂、总蛋白代谢影响显著,说明发酵豆粕通过影响肠道菌群的构成进而影响脂类、蛋白质代谢。研究表明乳酸菌在一定程度上影响脂蛋脂酶的活性,增加了腹脂的累积,从而使脂肪肝的累积减少[48],同时乳酸菌也具有分解氨基酸的作用[49]。目前在水产动物中有关菌群丰度、主要功能与新陈代谢类功能有关的研究仍然较少,联合转录组学、代谢组学等技术手段有助于开展深入的机制探讨。本实验中G50组肠道微生物与生长指标的相关性显示,拟杆菌、巨单胞菌属、弯曲杆菌、粪杆菌属等与生长性能显著相关。粪杆菌属可以分泌抗炎物质(水杨酸)和抗炎分子,协助抵御外来入侵病菌,同时可以减轻肠道炎症保护肠道健康[50-51],拟杆菌属能够提高肉鸡对营养物质的消化吸收,肉鸡表现出较好的生长性能[52]。本实验结果说明发酵豆粕调节肠道粪杆菌属和拟杆菌属相对丰度,提高营养物质的吸收利用,从而提高大口黑鲈的生长性能。
4 结论
本实验条件下发酵豆粕替代基础饲料中10%~50%的鱼粉提高了大口黑鲈的生长性能,替代水平为50%时(发酵豆粕在基础饲料中添加量为33.26%)生长最佳,替代水平增加会降低大口黑鲈肝体比、增加腹脂率和肠体比,提高肠道微生物的多样性。

