皂苷类化合物降血糖作用及其机制研究进展
王 月,苏 蓉,刘振华,董 琦
1青海大学医学院,西宁810016;2中国科学院西北高原生物研究所,西宁810008
糖尿病(diabetes mellitus,DM)是一种以血糖升高为特征的代谢性疾病,常伴随一系列累及多个组织器官的并发症,最常见的如肾病、视网膜病变、神经病变、性功能障碍和心肌病等,可导致糖尿病患者遭受心脏病发作、中风、失明、肾功能衰竭及截肢等危害,总体生活质量下降[1,2]。根据国际糖尿病联盟发布的最新版《全球糖尿病地图(IDF Diabetes Atlas)》显示,全球糖尿病(20~79岁)粗患病率为9.3%,约4.63亿成人患有糖尿病,正发展成为继癌症、心脑血管疾病之后危害人类健康的第三大杀手[3]。
越来越多的研究证实,糖尿病的发病机制与各种信号通路有关,如胰岛素信号通路[4]、碳水化合物代谢通路[5]、内质网应激相关通路[6]、涉及胰岛素分泌[7]和PPAR调节[8]的通路以及染色质修饰通路[9],这些信号通路已成为治疗糖尿病新药物靶点的主要来源,例如,胰岛素增敏药物双胍(二甲双胍)和噻唑烷二酮类(罗格列酮和吡格列酮)多年来通过作用于以上通路用于糖尿病的治疗,但是这些抗糖尿病药物服用后陆续发现了临床副作用[10]。近年来中药及其活性成分与合成化合物相比结构多样性更大、副作用小,在治疗糖尿病这一慢性疾病方面彰显出巨大的优势和潜力,可成为生物活性剂的主要来源,并在新药研究先导化合物的发现中发挥关键作用。研究较多的天然产物包括生物碱、酚类、萜类、黄酮类、皂苷类、多糖等均具有显著的抗糖尿病作用,其中,大量实验证实多数抗糖尿病药用植物的降血糖活性归因于皂苷的存在[11-13]。
皂苷由非糖的三萜或甾体皂苷元与糖基部分结合而成,因具有抗炎[14]、抗病毒[15]、抗肿瘤[16]、降血糖[17]及调节脂质稳态[18]等多种生物活性而受到广泛关注,其中,降血糖作用通过多个靶点和信号通路进行调节,主要涉及胰岛素信号通路、基于碳水化合物的代谢途径、内质网应激调节通路、PPAR调节通路、游离脂肪酸促进胰岛素分泌以及多通路联合调节。本文主要以皂苷降血糖活性涉及的信号通路为线索,对皂苷类化合物的降血糖作用进行综述,明确体内与糖尿病治疗相关的作用机理和有效机制,探索合理高效的靶点与通路用于预防糖尿病对全球健康的威胁,加深对皂苷类化合物生物活性的认识,以期为防治糖尿病发挥借鉴作用。
1 皂苷类化合物的降血糖活性及其作用机制
1.1 胰岛素信号通路
1.1.1 葡萄糖转运通路(INS-INSR-IRS-PI3K-AKT-GLUT4)
胰岛素(insulin,INS)与其受体(insulin receptor,INSR)结合,引发INSR构象的变化并激活固有的酪氨酸激酶活性,促使胰岛素受体底物(insulin receptor substrate,IRS)在内的多个底物磷酸化,进而通过激活下游信号分子作用于相应通路发挥降糖作用[19](见图1)。
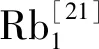
1.1.2 糖原合成通路(INS-INSR-IRS-PI3K-AKT-GSK3β)
激活的AKT促使糖原合成中的关键酶丝氨酸/苏氨酸激酶(glycogen synthase kinase 3β,GSK3β)磷酸化,显著抑制GSK3β的活性,GSK3β对糖原合成酶(general synthesizer,GS)发挥负调控作用,GSK3β被抑制后作用于GS使其活性升高,促进糖原合成用于降低血糖水平发挥降糖疗效[25](见图1)。

1.1.3 抑制蛋白酪氨酸磷酸酶1B(PTP1B)
蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)最初从人胎盘蛋白提取物中分离,定位于内质网的细胞质表面,可使INS和IRS的酪氨酸激酶位点去磷酸化,发挥负调控作用阻碍胰岛素的正常调节,已成为治疗T2DM的药物靶标[30]。研究发现PTP1B基因敲除小鼠的肌肉和肝脏可表现出更高的胰岛素敏感性,因此可通过PTP1B基因敲除或采用PTP1B抑制剂提高机体胰岛素的表达[31](见图1)。

图1 胰岛素信号通路作用机制Fig.1 Mechanism of insulin signaling pathway
齐墩果酸及其衍生物是典型的PTP1B抑制剂,Liu等[32]合成了24种糖取代型齐墩果酸衍生物,在体外评价了其对PTP1B抑制和胰岛素致敏反应的影响,结果显示齐墩果酸及其衍生物对PTP1B表现出中度至良好的抑制活性,可用于糖尿病的治疗。除齐墩果酸外,Zhou等[33]研究了黄芪甲苷对胰岛素抵抗细胞和非酒精性脂肪性肝病模型的影响,药物团模型匹配和分子对接的初步结果表明黄芪甲苷和PTP1B可以通过氢键很好地结合,酶动力学实验表明黄芪甲苷是PTP1B的有效和特异性抑制剂,为黄芪甲苷改善胰岛素抵抗提供了新的方向。Klomann等[34]拟确定苦瓜的生物活性化合物和生物化学机制对T2DM的影响,利用db/db小鼠进行分组考察,结果显示皂苷部分使骨骼肌细胞质基质中PTP1B活性降低了25%,解释了苦瓜在胰岛素抵抗和T2DM中的抗糖尿病作用涉及的生化机制,为胰岛素敏感性增加提供了机制信息。
1.2 基于碳水化合物的代谢途径
1.2.1 AMPK调节作用
AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)是碳水化合物代谢通路调节的中枢,在维持全身能量平衡中起着关键作用,AMPK可通过以下途径调节碳水化合物代谢发挥降糖作用[35](见图2):

图2 基于碳水化合物的代谢途径作用机制Fig.2 Mechanism of metabolic pathway based on carbohydrate

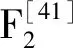
(3)激活AMPK后可借助葡萄糖转运蛋白1(glucose transporter type 1,GLUT1)和葡萄糖转运蛋白4(GLUT4)将葡萄糖运输至细胞内使葡萄糖的摄取和应用增多。Yu等[45]以链脲佐菌素与高脂肪饮食诱导的T2DM大鼠研究穿龙薯蓣(DiscoreanipponicaMakino)皂苷对T2DM的影响和可能的机制,以生化参数、靶蛋白和基因为参考,实验发现穿龙薯蓣皂苷上调了AMPK和GLUT4的蛋白表达,在未来有望开发为治疗糖尿病的新型强效药物。Bai等[46]试图探索苦瓜总皂苷如何影响棕榈酸处理的HepG2细胞和葡萄糖处理的秀丽隐杆线虫的葡萄糖和脂质代谢,数据表明可通过上调GLUT4表达促进葡萄糖摄取,证实苦瓜总皂苷在HepG2细胞系和秀丽隐杆线虫中表现出调节能量代谢的能力。Kim等[47]探索绞股蓝分离得到的绞股蓝皂苷L和绞股蓝皂苷Li对L6骨骼肌细胞AMPK激活的影响,结果表明两种绞股蓝皂苷显著增加了L6骨骼肌细胞的GLUT4基因表达和葡萄糖摄取活性,提供了与绞股蓝皂苷L和绞股蓝皂苷Li活性相关的新信息,并强调了它们作为调节代谢紊乱潜在治疗剂的潜在用途。
(4)沉默调节蛋白1(sirtuin1,Sirt1)对葡萄糖稳态具有促进作用,可以提高机体对胰岛素抵抗的代谢适应,同时可以增强肝脏对胰岛素的敏感性[48]。有研究表明AMPK/Sirt1通路的紊乱可导致抗氧化活性降低,加速氧化应激的失衡使胰腺β细胞在高糖环境中发生凋亡,因此可通过改善AMPK/Sirt1通路发挥降糖疗效[49]。Gong等[50]评估了黄芪甲苷在糖尿病小鼠和胰岛素抵抗HepG2细胞中的降血糖作用和可能机制,用高通量16S rRNA基因测序分析胰岛素信号通路特定成员的分子机制,揭示了黄芪甲苷作为抗糖尿病化合物通过调节AMPK/Sirt1发挥降血糖作用,可为黄芪甲苷作为一种新的潜在的T2DM治疗药物奠定基础。Lou等[51]使用Sirt1酶活性检测试剂盒初步评估从五叶草(LotuscorniculatusLinn.)纯化的33种皂苷的Sirt1激动剂活性,结果表现出令人满意的Sirt1激动剂活性。Tang等[52]旨在重点研究人参皂苷Rd的AMPK/Sirt1相互作用,发现人参皂苷Rd促进了AMPK的激活和Sirt1的表达,以AMPK/Sirt1相互依赖的方式逆转了高葡萄糖诱导的NOX2激活、氧化应激、线粒体功能障碍和内皮细胞凋亡。
1.2.2 抑制α-淀粉酶和α-葡萄糖苷酶活性
食物中富含的碳水化合物经口腔或胃肠道中一系列α-淀粉酶消化水解转化为低聚糖,随后α-葡萄糖苷酶作用于非还原末端α-1,4-糖苷键使低聚糖水解成葡萄糖等能被小肠上皮细胞直接吸收的单糖,借助小肠中的钠依赖性葡萄糖协同转运蛋白1(sodium-glucose cotransporter 1,SGLT1)和葡萄糖转运蛋白2(glucose transport protein 2,GLUT2)将单糖转移至小肠上皮细胞[53](见图2)。因此降糖类化合物可通过抑制α-淀粉酶和α-葡萄糖苷酶活性使葡萄糖从碳水化合物中释放减弱,延迟葡萄糖吸收用于抑制餐后血糖。
Huang等[54]评价头花蓼(PolygonumcapitatumBuch.Ham.ex D.Don)分离株的α-淀粉酶抑制活性,研究发现头花蓼分离得到的两种三萜皂苷类,包括2α,3β,6β,24-tetrahydroxy-olean-13-en-28-oic acid 28-O-α-L-rhamnopyranosyl-(1→3)-O-α-D-glucopyranosyl-(1→4)-O-β-D-glucopyranosyl ester和2α,3β,24-trihydroxy-olean-13-en-28-oic acid 28-O-α-L-rhamnopyranosyl-(1→4)-O-β-D-glucopyranosyl-(1→4)-O-β-D-glucopyranosyl ester对α-淀粉酶的活性分别为(51.9±2.8)%和(38.1±2.2)%,结合亲和力分别为-9.4 kcal/mol和-7.8 kcal/mol,与分子对接分析一致,可以通过阻断α-淀粉酶活性显示出充当降血糖剂的效力。Dong等[55]建立了基于固相微萃取和超高效液相色谱/质谱法的α-葡萄糖苷酶抑制化合物的体外快速筛选方法,用该方法评估了从藜麦麸皮中提取的黄酮类和皂苷类化合物的α-葡萄糖苷酶结合活性,实验结果表明这些化合物对α-葡萄糖苷酶具与阿卡波糖相当的强抑制作用,提出藜麦麸皮是α-葡萄糖苷酶抑制剂的潜在天然来源。Luo等[56]旨在从黄精中提取皂苷并研究其降血糖作用,在评估降血糖能力的实验中发现黄精皂苷最初可以抑制α-淀粉酶和α-葡萄糖苷酶的活性,后通过HepG2细胞观察皂苷对胰岛素抵抗的影响,证实黄精可能在调节糖尿病方面发挥重要作用,可以发展成为一种有前途的糖尿病预防和治疗的天然材料。
1.3 内质网应激调节通路
内质网应激(endoplasmic reticulum stress,ERS)与糖尿病的发生高度相关,导致ERS的刺激因素包括营养缺乏、病毒感染、热休克、ROS和炎性细胞因子等,这种干扰导致内质网中未折叠或错折叠的蛋白大量积累而引发一种细胞胁迫响应机制称为未折叠蛋白反应(The unfolded protein response,UPR)[57]。UPR有三条重要的信号通路,包括蛋白激酶样内质网激酶(proteinkinaseR—likeERkinase,PERK)、肌醇需求酶1(inositol requiring enzyme1,IRE1)和激活转录因子6(activating transcription factor 6,ATF6)[58]。研究发现抑制ERS相关的炎症通路和氧化应激反应可以防止胰岛β细胞受损,保障胰岛素的正常表达进而预防和治疗糖尿病。
1.3.1 内质网应激和炎症相关途径
ERS时引发UPR后进一步激活炎症信号,由炎症信号诱导的细胞凋亡会导致大量的胰岛β细胞缺失,抑制胰岛素的正常表达导致糖尿病的发生。UPR的IRE1信号启动后与肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor-associated factor 2,TRAF2)联结作用于凋亡信号调节激酶1(apoptosis signal-rgulating kinase 1,ASK1),ASK1与c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNKs)相互作用后JNKs可引起白细胞介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)和激酶蛋白1(activator protein 1,AP-1)等多种炎症因子表达,进一步诱导更严重的炎症反应促使胰岛β细胞凋亡,同时JNKs可导致胰岛素受体底物(IRS-1/2)Ser307磷酸化,抑制胰岛素的正常表达[59,60]。另一种途径IRE1、PERK和ATF6可激活核转录因子(nuclear factor kappa-B,NF-κB),NF-κB转移到细胞核内参与炎症基因的转录调控,可激活炎症小体(nucleotide- binding oligomerization domain,leucine- rich repeat and pyrin domain- containing 3,NLRP3)、促凋亡基因(cysteinyl aspartate specific proteinase-1,Caspase-1)和白细胞介素-1β等诱发炎症导致胰岛β细胞受损,产生胰岛素抵抗[61](见图3)。因此具有降糖作用的化合物可通过抑制ERS与炎症相关通路,保障胰岛β细胞活性及胰岛素受体底物正常信号转导,维持胰岛素降糖疗效。
Zhong等[62]研究表明酸枣仁皂苷A通过下调PERK、IRE1和促凋亡基因Caspase-12的表达抑制由ERS介导的细胞凋亡用于预防2型糖尿病肾病。Roh等[63]表明人参皂苷Mc1通过降低JNK磷酸化水平治疗棕榈酸酯诱导的脂毒性后的人肝母细胞瘤细胞的内质网应激、细胞死亡和胰岛素信号受损。Deng等[64]采用蛋白质印迹法发现黄芪甲苷可以通过JNK途径使糖尿病酮症酸中毒幼鼠血糖水平降低并增加血清胰岛素分泌。Song等[65]证实人参皂苷化合物K通过抑制NLRP3炎症小体的活化和NF-κB信号通路在高脂饮食/链脲佐菌素诱导的糖尿病小鼠中对糖尿病肾病具有保护作用。Prasad等[66]表明薯蓣皂苷可降低链脲佐菌素诱导的糖尿病大鼠主动脉中的促炎细胞因子TNF-α、IL-1、IL-6和IL-4的表达,抑制ERS引起的主动脉炎症。Zhu等[67]表明人参皂苷Rg5通过抑制NLRP3炎症小体的活化减少炎症反应以减轻糖尿病小鼠的肾损伤,可作为预防或控制糖尿病肾损伤的潜在化合物。
1.3.2 氧化应激相关的Keap1-Nrf2信号通路
氧化应激是一种由体内活性氧簇ROS生成增加的生化过程与机体抗氧化防御系统之间的失衡所介导的代谢功能障碍,发生氧化应激时导致内质网氧化还原状态失衡触发ERS,同时ERS会产生大量活性氧加剧氧化应激,对胰腺β细胞产生细胞毒作用,降低胰岛素表达[68]。
PERK的底物核因子红系相关因子2(nuclear factor erythroid2-related factor 2,Nrf2)是氧化还原状态的主要调节因子,在细胞防御氧化应激时可抵消体内积累的ROS[69]。Kelch样ECH相关蛋白1(recombinant Kelch like ECH associated protein 1,Keap1)是Nrf2的负调控因子,在生理条件下Keap1与存在于细胞质的Nrf2结合并抑制其活性[70]。当细胞暴露在ERS状态时,PERK使Nrf2磷酸化促进Keap1的解离,游离的Nrf2迁移至细胞核内与编码抗氧化酶靶基因启动子中的抗氧化反应元件(antioxidant response element,ARE)结合促进抗氧化基因的转录,抗氧化酶主要包括NADPHB苯醌氧化还原酶(NAD(P)H quinone dehydrogenase 1,NQO1)、血红素加氧酶-1(heme oxygenase 1,HO-1)和谷胱甘肽S-转移酶(glutathione s-transferase,GST)(见图3)。因此防治糖尿病可通过激活Keap1-Nrf2信号通路利用抗氧化酶抑制ROS的过度产生,减轻内源性氧化应激对胰腺β细胞的损伤。

图3 内质网应激调节通路作用机制Fig.3 Mechanism of endoplasmic reticulum stress regulatory pathway
Gao等[71]研究发现人参皂苷Rg1通过调节Keap1/Nrf2/HO-1途径保护小鼠免受链脲佐菌素诱导的I型糖尿病,可作为预防I型糖尿病发生和发展的潜在药物。Zhang等[72]证实三七皂苷通过上调Nrf2介导的HO-1表达保护db/db小鼠免受糖尿病肾病的损伤。Gao等[73]研究绞股蓝总皂苷对糖尿病大鼠的降糖作用,发现绞股蓝总皂苷促进Nrf2进一步移位到细胞核内,激活Nrf2在链脲佐菌素诱导的糖尿病大鼠肝细胞核中的表达。Su等[74]发现黄芪甲苷通过增加Nrf2的表达和降低Keap1蛋白水平促进了抗氧化应激能力,改善了糖尿病大鼠的足细胞损伤。Liu等[75]探讨人参皂苷Rh4明显改善高脂饮食/链脲佐菌素诱导的T2DM小鼠血糖水平的作用机制,结果表明人参皂苷Rh4增加了Nrf2的表达和Nrf2核转位,上调了HO-1和NQO1的表达,保护胰腺β细胞免受损伤进而使胰岛素分泌增加。
1.4 PPAR调节通路
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)可作为糖脂平衡的重要调节因子以及治疗糖尿病等代谢性疾病的重要靶点。PPARs可分为三类:PPARα、PPARδ和PPARγ,PPARα多存在于肝脏、心脏和肾脏,作用于脂肪酸和脂类代谢过程;PPARγ多在脂肪、肌肉和巨噬细胞中表达,参与脂肪生成和脂类储存及增加胰岛素敏感性和糖代谢;PPARδ表达广泛,调控脂肪氧化和能量消耗[76]。
据报道,激活的PPARγ与维甲酸X受体(retinoid X receptor,RXR)结合,再与靶基因启动子上游的PPAR特异性反应元件(project pokemon rom editor 2,PPRE)联接,调控与T2DM关联的下游靶基因的转录激活,使糖脂代谢相关基因表达增多[77]。PPARγ激动剂可促进脂肪细胞分化及调节胰岛素作用细胞因子脂联素的表达增强胰岛素敏感性,同时PPARγ激活后可增强糖代谢过程GLUT-1和GLUT-4的表达,促进肝脏和骨骼肌对葡萄糖的摄取[78](见图4)。因此对糖尿病的治疗大多通过对PPARγ受体的激活或抑制其磷酸化实现血糖水平降低,同时有研究表明与糖尿病相关的心血管疾病可通过激活PPARα实现[79]。
在3T3-L1细胞中,研究人员采用实时聚合酶链式反应发现人参皂苷Rg5+Rk1混合物可以减少脂质积累并上调PPARγ的表达[80]。Sharif等[81]研究黄芪皂苷混合物的抗糖尿病作用,结果显示可通过激活PPARγ信号转导发挥降糖疗效。Montanari等[82]测定了紫花苜蓿属植物中一系列皂苷和皂苷元的PPARγ结合亲和力和反式激活活性,发现三萜皂苷元是一种潜在的PPARγ部分激动剂。Liu等[83]表明三七皂苷阻止了高糖诱导的内皮细胞中PPARγ的下调,通过PPARγ介导的途径对高糖诱导的内皮细胞损伤具有预防作用,可为糖尿病血管并发症的治疗提供潜在的选择。Gao等[84]研究发现人参皂苷Re通过直接激活PPARγ途径及增加其反应基因脂联素的表达发挥降低胰岛素抵抗的作用。El Dine等[85]检测到分离得到的节节鱼腥草皂苷(1-4部分)对PPARγ的激活倍数不超过1.5倍,1和3部分对PPARα的激活程度分别为2.25倍和1.86倍,表明分离的皂苷抗糖尿病作用可能不仅仅是激活PPARγ,与糖尿病密切相关的心血管疾病可能通过激活PPARα达成。
1.5 游离脂肪酸促进胰岛素分泌
通常葡萄糖水平升高会引起糖酵解和呼吸作用增强导致ATP/ADP的比值升高,增高的比值可上调钙离子水平刺激胰岛素的分泌[35]。游离脂肪酸(free fatty acid,FFA)是机体的重要信号分子,研究发现孤立的G蛋白偶联受体(G protein-coupled receptor,GPCR)通常包括GPR40和GPR120可充当游离FFA受体,通过作用于相应通路升高细胞内钙离子水平使胰岛素的分泌增加[86]。
GPR40主要在胰腺β细胞和胰岛表达,其与游离FFA结合后通过G-蛋白信号级联刺激细胞内钙聚集[86]。GPR120主要存在于肠道和脂肪细胞中,与游离FFA结合后刺激胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的分泌,GLP-1与其受体GLP-1R结合后激活腺苷环化酶(adenylate cyclase,AC)促使环磷腺苷(cyclic adenosine monophosphate,cAMP)水平上升,进一步激活cAMP依赖的蛋白激酶A(protein kinase A system,PKA)和cAMP调节的鸟嘌呤核苷酸交换因子2(Epac2)[87,88]。PKA导致L型电压依赖性钙通道(voltage dependent calcium channel,VDCC)的开放和ATP敏感性钾通道(ATP-sensitive potassium channel,KATP)的关闭,从而产生动作电位引起钙内流[89]。Epac2通过激活RAS相关蛋白1(RAS-associated protein 1,RAP1)后作用于磷酸酯酶C(phospholipase C,PLC),PLC将膜上的脂酰肌醇4,5-二磷酸(phosphatidylinositol (4,5) bisphosphate,PIP2)分解形成两个信使1,4,5-三磷酸肌醇(inositol 1,4,5-trisphosphate,IP3)和二酰甘油(diacyl glycerol,DAG),IP3和DAG后分别通过3-磷酸肌醇受体(inositol 1,4,5-triphate receptor,IP3R)和雷诺丁受体(ryanodine,RYR)增加钙离子水平刺激胰岛素的分泌[90](见图5)。

图5 游离脂肪酸促进胰岛素分泌作用机制Fig.5 Mechanism of free fatty acids promoting insulin secretion
Cui等[91]探索千濑津皂苷IVa对糖尿病大鼠胰腺β细胞的促胰岛素作用,结果显示千濑津皂苷IVa通过GPR40介导的钙离子水平刺激胰岛素的分泌,具有被开发成T2DM治疗剂的新潜力。Liu等[92]研究发现人参总皂苷显著增加了GLP-1的分泌,大剂量人参总皂苷处理可提高葡萄糖负荷诱导的门静脉GLP-1水平,并伴随着肠道GLP-1含量的增加进而改善胰岛素抵抗。Lundqvist等[93]研究绞股蓝属中草药提取物达玛烷型三萜皂苷诱导胰岛素分泌的机制,结果表明对大鼠胰岛素分泌的刺激是通过胰岛β细胞中与葡萄糖偶联刺激分泌中的PKA、KATP和VDCC步骤所介导。Kim等[94]对人参皂苷Rg3的GLP-1释放能力进行筛选,通过药理学方法和RNA干扰技术抑制细胞信号级联反应发现人参皂苷Rg3对NCI- H716细胞GLP-1的分泌作用最强,10 μmol/L的人参皂苷Rg3可显著增加胰岛素的产生用于降低小鼠的血糖。
1.6 多通路联合调节
机体降糖的各个通路可从不同途径有效地调节血糖水平,同时各通路之间可联合调节,协同合作地通过各种机制从不同方面更有效地发挥降糖疗效,实现血糖平衡。
Xu等[95]探讨膳食人参皂苷T19对胰岛素抵抗的HepG2细胞和链脲佐菌素诱导的糖尿病小鼠糖脂代谢的调节作用,结果表明AMPK和PI3K通路共同参与调节糖脂代谢。Lu等[96]研究黄精总皂苷对糖尿病大鼠的血糖调节机制,全基因组表达谱显示黄精总皂苷上调胰岛素信号通路中GLUT4的表达,下调G6Pase的表达,在肝脏中AMPK表达增加,同时促进了脂肪组织PPARγ的表达。Yu等[97]发现人参皂苷Rg1通过激活AKT/GSK3β/Nrf2途径保护H9C2细胞免受高葡萄糖/棕榈酸酯诱导的损伤。Barky等[98]旨在研究海参皂苷的抗糖尿病活性,实验结果显示海参皂苷可显著降低α-淀粉酶、脂联素、IL-6和TNF-α的含量。Yuan等[99]研究表明,知母皂苷B-II可通过IRS-1/PI3K/Akt和NF-κB途径改善HepG2细胞中棕榈酸酯诱导的胰岛素抵抗和炎症反应。Luo等[100]发现皂苷及其次级代谢物对代谢综合征包括胰岛素抵抗、肥胖、空腹血糖水平升高等症状有预防作用,有效靶标涉及PPAR和AMPK等信号通路。Lin等[101]发现黄芪甲苷通过调节Sirt1和Akt/GSK3β/Nrf2信号通路改善链脲佐菌素诱导的胰腺β细胞凋亡和功能障碍。
2 总结与展望
本文就皂苷类化合物对糖尿病治疗的关键信号通路进行总结,这些信号通路已成为治疗糖尿病相关新药靶点的主要来源,为皂苷在降血糖方面提供了进一步的证据,使皂苷具有开发为抗糖尿病药物先导化合物及新型抗糖尿病新药的潜力,以期为糖尿病的治疗提供理论依据和多样化的可能性,在一定程度上促进了中草药活性成分开发的研究进展。
糖尿病的发病机制纷繁复杂且充满挑战,开发安全有效的抗糖尿病药物目前仍存在些许问题:(1)尽管目前已摸索出相关作用通路,但疾病机制的复杂性表明,基于单一靶点的糖尿病治疗策略仍存在明显的缺陷,越来越多的研究证实,糖尿病的发病机制与多种信号通路联合作用有关,但相关通路联合作用的影响因素尚不明确,仍需不断细化与摸索;(2)人们普遍认为遗传和环境因素都与糖尿病的发病和发展有关,然而该病的特殊病因和确切的致病机制尚不完全清楚,皂苷治疗后相应的体内代谢过程、量效关系、毒理学等方面需要在未来研究中进一步定义;(3)目前对其疗效的研究大多还停留在动物实验阶段,多为观察现象和机制推测水平,临床研究明显不足,某些机制仍是一种可能性的推测,在一定程度上限制了实验结果的准确性和重复性。今后随着现代化学和生物学等技术的不断发展,将皂苷降血糖机理的临床研究与现代科学方法和调控手段相结合,进一步开展深入的物质基础、药理作用机制及毒理学评价等研究,皂苷类化合物抗糖尿病的研究开发必将显示出更加广阔的应用前景。

