骨碎补-续断药对对成骨/破骨代谢的双向调控作用及其对Hif1ɑ基因的影响
陈玄 陈娟 谢丽华 李生强 黄景文 叶云金 陈赛楠 黄小彬 葛继荣*
1.福建省中医药科学院骨质疏松证候基因组学重点研究室,福建 福州350003
2.福建省中西医结合防治骨质疏松重点实验室,福建省中医药科学院及福建中医药大学附属康复医院,福建 福州 350003
近年来中医药治疗骨质疏松症(osteoporosis,OP)的临床效果已得到广泛认同和肯定。骨碎补、续断是中医治疗OP的常用药物之一,其中骨碎补位于OP治疗最高频次用药前3名,续断则位居OP药物组方的高频次用药前十[1]。在治疗OP的中药复方中,骨碎补、续断常常配伍使用,包括经典名方续骨活血汤和众多临床经验方,如骨保合剂[2]、补肾强督方[3]、补肾通络汤[4]等。笔者在前期研究中也发现,以骨碎补、续断为君药的课题组经验方续苓健骨方具有改善绝经后骨质疏松(postmenopausal osteoporosis,PMOP)患者和去卵巢(ovariectomy,OVX)大鼠的骨密度、骨生物力学指标、骨组织微结构、血液钙磷代谢的作用[5-7]。因此,骨碎补-续断配伍治疗OP具有广泛的实践基础和良好的应用前景。
目前,骨碎补和续断的粗提物已被分别开发成中药二类新药——强骨胶囊[8]和续断壮骨胶囊[9],可直接用于治疗OP,但有关骨碎补-续断药对的疗效和机制的研究仍寥寥无几。有必要了解骨碎补-续断药对用于治疗OP的效果如何?其疗效的发挥是通过调控成骨代谢还是破骨代谢,或二者兼而有之?本研究拟通过细胞实验分别观察骨碎补-续断药对对成骨代谢和破骨代谢的调控作用,并初步探讨其作用靶点和机制,为骨碎补-续断配伍用于治疗OP提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物:3月龄SPF级雄性SD大鼠40只,购自杭州医学院。实验动物许可证号:SCXK(浙)2019-0002。大鼠在20 ℃~25 ℃,湿度65%~70%,光照12 h/12 h的环境中饲养,给予标准鼠饲料和自由饮水。
1.1.2实验细胞:小鼠颅顶前成骨细胞亚克隆14(MC3T3-E1 subclone14)细胞株,购自中国科学院细胞库(货号GNM15);小鼠单核巨噬细胞白血病细胞(RAW264.7),购自美国ATCC细胞库(货号TIB-71)。
1.1.3实验药物:骨碎补(黄冈金贵中药产业发展有限公司,批号D9100102)、续断(厦门燕来福制药有限公司,批号180517),购自鹭燕医药股份有限公司。
1.1.4试剂:DMEM高糖减血清培养基(源培生物,Cat.#L180KJ );胎牛血清(BI公司,Cat.#04-001-1B);β-甘油磷酸钠、地塞米松、抗坏血酸磷酸盐、RANKL(Cat.#R0525)、茜素红染料(Alizarin red)等试剂购自美国Sigma公司;CCK-8 试剂盒(Abmole公司,Cat. # M4839);TRAP/ALP染色试剂盒(日本和光纯药公司,Cat.#294-67001);反转录试剂盒(Takara公司,Cat.#639505);荧光定量PCR试剂盒(Takara公司,Cat.# DRR041 A);引物由Takara 公司合成;Western-blot主要试剂购自碧云天公司;HIF1ɑ抗体(Abcam公司,Cat.#ab179483)。
1.1.5仪器:超微量核酸测定仪Nano2000 (Thermo Fisher公司);荧光定量PCR仪7500 FAST(美国ABI公司);CO2培养箱(Thermo Fisher公司);倒置相差显微镜DM40000 B(Leica公司);全波长酶标仪(ThermoFisher Scientific);多色荧光/化学发光成像系统(美国FluorchemM公司)。
1.2 实验方法
1.2.1实验分组及骨碎补-续断含药血清的制备:40只大鼠随机分成空白含药血清组(空白组)、骨碎补-续断低剂量含药血清组(低剂量组)、中剂量含药血清组(中剂量组)、高剂量含药血清组(高剂量组),每组10只。骨碎补-续断按1∶1比例配伍制成水煎剂,根据动物与人体的每千克体质量剂量折算系数折算,骨碎补-续断的人体用药量为0.6 g/(kg·d),低剂量组大鼠用药量则为6.25×0.6=3.75 g/(kg·d),中剂量组为3.75×3=11.25 g/(kg·d),高剂量组为3.75×6=22.5 g/(kg·d)。各组分别灌胃给药,每天2次,连续7 d,空白组给予等量生理盐水。末次给药后1 h,腹腔注射戊巴比妥钠30 mg/kg麻醉,腹主动脉采血10~15 mL。分离血清,同组动物血清合并,56 ℃水浴30 min灭活,过滤除菌,-20 ℃储存备用。
1.2.2细胞培养:MC3T3-E1和RAW264.7细胞分别以基础培养基(DMEM高糖培养基+10%胎牛血清)培养,隔2 d换液。取对数生长期细胞,根据分组,分别添加10%的含药血清进行干预。
1.2.3CCK-8细胞增殖实验:细胞以2×103cells /100 μL的密度接种于96孔培养板,每板设空白孔,每组设3个复孔。按分组加入血清,分别培养0、24、48、72、96、120 h后,每孔加入10 μL的CCK8,37 ℃孵育3 h,检测450 nm波长处OD值。
1.2.4ALP/TRAP染色:MC3T3-E1细胞用成骨诱导剂(50 μg/mL抗坏血酸磷酸盐,10 mmol /Lβ甘油磷酸钠,10 nmol/L地塞米松)诱导,隔天半量换液。诱导7 d后,弃去培养基,PBS清洗,0.5 mL固定液冰上固定10 min。RAW264.7细胞用50 ng/mL的RANKL诱导破骨分化,3 d换液1次,诱导5 d后,同法固定。PBS清洗3次,加入250 μL的ALP或TRAP染色液,37 ℃避光孵育40 min,dH2O清洗3次,光镜下观察拍照。
1.2.5茜素红染色:成骨诱导分化14 d,弃成骨诱导分化完全培养基,PBS清洗2次;每孔加2 mL的4%多聚甲醛溶液,固定30 min;弃多聚甲醛溶液,PBS清洗2次;每孔加入1 mL茜素红染液染5~10 min;弃茜素红染液,PBS清洗2次,光镜下观察拍照。
1.2.6系统药理学的方法分析药物可能作用靶点:通过中药系统药理学数据库和分享平台(TCMSP、BATMAN-TCM、TCMID等数据库),筛选出骨碎补-续断药对的生物利用度≥30%,类药性≥0.18的有效化学成分。从PubChem、HIT、BindDB等数据库获取经过验证的上述有效化学成分的靶点;并利用反向分子对接技术,利用DRAR-CPI数据库和systemsDock在线分子对接工具预测化学成分的潜在作用靶点。从TTD数据库和DisGeNET数据库获取疾病靶点数据。应用Cytoscape软件将上述成分-靶点数据构建成成分-靶点网络,进行优化和渲染。根据自由度等参数提取其核心成分和靶点网络。
1.2.7实时荧光定量PCR(qRT-PCR):TriZol法提取RNA,采用反转录试剂盒进行反转录获得cDNA。配制如下荧光定量PCR反应体系:SYBR Premix Ex TaqTM GC 12.5 μL,引物各0. 5 μL,dH2O 9.5 μL,cDNA 2 μL。经95 ℃预变性10 s后;95 ℃ 5 s→60 ℃ 31 s,反应40个循环。引物序列见表 1,采用2-ΔΔCT法计算缺氧诱导因子(Hypoxia-inducible factor 1-alpha,Hif1ɑ)的mRNA表达水平。
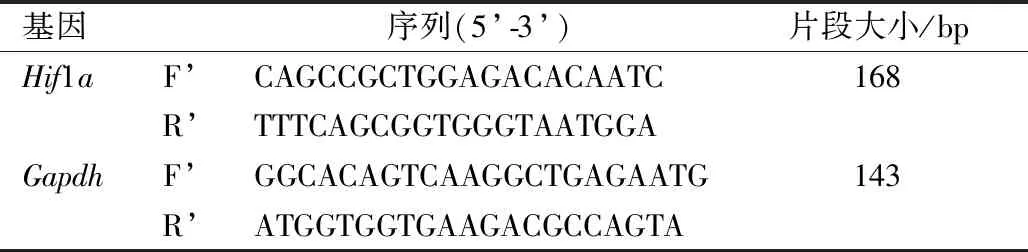
表1 荧光定量PCR引物序列Table 1 Primer pairs used in real-time PCR
1.2.8免疫蛋白印迹法(Western-blot):收集细胞,提取总蛋白。经SDS-PAGE电泳将不同分子量的蛋白分离后,湿转法转移到NC膜上,脱脂奶粉封闭,孵育一抗,二抗,而后ECL显色。采用化学发光凝胶成像系统观察并拍照后,Image-Pro Plus 图像分析软件分析目标条带的灰度,并计算细胞中的HIF1ɑ和内参蛋白浓度。
1.3 统计学处理
采用SPSS 17.0软件进行数据分析,计量资料用均数±标准差表示,多组间比较采用重复测量的方差分析,统计具有差异时再以Bonferroni 法进行组间多重比较;两组间比较采用两样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 骨碎补-续断对MC3T3-E1细胞增殖和成骨分化的影响
观察不同浓度的骨碎补-续断含药血清处理细胞1、2、3、4、5 d的细胞增殖倍数,发现与空白组相比,低剂量组的细胞增殖速度没有明显差别;而中、高剂量组细胞从第3天开始,细胞增殖速度快于空白组(P<0.05),且随着培养天数的增加,增殖速度进一步加快;中剂量组与高剂量组相比,二者没有明显差异(图1A)。进一步观察中剂量和高剂量的骨碎补-续断含药血清对细胞成骨潜能和钙化能力的影响,中、高剂量组细胞的ALP染色和茜素红染色程度均明显高于空白组,中剂量组和高剂量组之间未见明显差别(图1B和1C)。
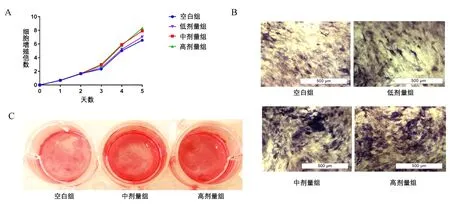
图1 含药血清对MC3T3-E1细胞的增殖(A)、ALP染色(B,40×)和茜素红染色(C)的影响Fig.1 Effects of drug-containing serum on MC3T3-E1 cells proliferation(A), ALP staining (B,40×), and Alizarin red staining(C)
2.2 骨碎补-续断对RAW264.7细胞增殖和破骨分化的影响
观察不同浓度的骨碎补-续断含药血清处理细胞1、2、3、4、5 d的细胞增殖倍数,发现与空白组相比,低剂量组的细胞增殖速度略有降低,但差异无统计学意义;而中、高剂量组细胞从第3天开始,细胞增殖速度明显降低(P<0.01),且随着培养天数的增加,细胞增殖被进一步抑制;中剂量组与高剂量组相比,二者没有明显差异(图2A)。观察RAW264.7分化为破骨细胞的能力,发现中、高剂量组细胞的TRAP染色水平明显低于空白组,中剂量组和高剂量组之间没有明显差别(图2B)。
图2 含药血清对RAW264.7细胞的增殖(A)和TRAP染色(B)的影响(200×)Fig.2 Effects of drug-containing serum on RAW264.7 cells proliferation(A)and TRAP staining(B)(200×)
2.3 HIF1ɑ可能是骨碎补-续断的作用靶点之一
采用系统药理学和分子对接技术,分析骨碎补-续断药对治疗OP的已验证或预测的分子靶点及相应的药物活性成分,并通过自由度(≥5)筛选出核心作用靶点网络。结果显示,骨碎补和续断分别有14和8个核心活性成分,其中甾醇(beta-sitosterol)是骨碎补和续断共有的活性成分。活性成分的已验证或经预测的作用靶点共有包括HIF1ɑ在内的43个。其中有8个药物的活性成分可作用于HIF1ɑ(表2)。

表2 可能作用于Hif1ɑ基因的骨碎补-续断活性成分Table 2 Active ingredients of the herbs that may act on Hif1ɑ gene
2.4 骨碎补-续断对MC3T3-E1和RAW264.7细胞Hif1ɑ基因表达水平的影响
检测中剂量骨碎补-续断含药血清处理的MC3T3-1和RAW264.7细胞的Hif1ɑ表达水平,发现MC3T3-1细胞中的Hif1ɑ基因的mRNA和蛋白水平均明显升高(P<0.01);RAW264.7细胞的Hif1ɑ基因的mRNA 水平没有明显改变(P>0.05),但蛋白水平明显提高(P<0.01),见图3。

图3 含药血清对MC3T3-E1和RAW264.7细胞的Hif1ɑ基因的mRNA和蛋白水平的影响(**P<0.01)Fig.3 Effects of drug-containing serum on mRNA and protein expression levels of Hif1ɑ gene in MC3T3-E1 and RAW264.7 cells (**P<0.01)
3 讨论
虽然目前骨碎补-续断配伍广泛应用于中医药临床治疗OP,但是有关二者联合使用的具体效果和作用机制的研究仍然十分匮乏。在改善大鼠骨折方面,将骨碎补总黄酮与续断总皂苷1∶1配伍用药,发现骨碎补是产生疗效的主要原因,而与续断的配伍产生了协同效应,其疗效优于二者分别单独使用的效果[10]。骨碎补、续断、续断与骨碎补混合水煎液(1∶1)都具有增强MC3T3-E1成骨细胞的增殖作用,并且与续断联合使用具有降低骨碎补对细胞的毒性作用,但骨碎补、续断及其混合液的促成骨代谢作用研究未进一步观察[11]。
目前国内外尚无骨碎补-续断药对在调控成骨和破骨代谢方面作用的研究发表。本研究结果表明,中、高剂量的骨碎补-续断含药血清不仅可促进MC3T3-E1细胞的增殖,还提高其成骨分化和矿化能力,促进成骨代谢;还可明显抑制RAW264.7细胞的增殖和分化,抑制破骨代谢。
为了进一步探讨骨碎补-续断调控骨代谢的分子机制,本研究预测和验证了药物的可能作用靶点,其中包括HIF1ɑ。课题组前期对PMOP患者治疗前后的外周血细胞进行转录组学检测,发现与对照组相比,PMOP患者的HIF1ɑ的mRNA水平明显下降,而以骨碎补-续断为君药的续苓建骨方治疗后,HIF1ɑ的mRNA水平明显提高[7]。此外,使用含骨碎补、续断等药物的补肾通络汤[4]治疗PMOP大鼠后,也同样发现HIF1ɑ的表达水平明显增高。提示HIF1ɑ可能是骨碎补-续断药对的核心作用靶点之一。
HIF1ɑ是氧分压感传信号通路上的一个关键分子,许多研究也表明,HIF1ɑ作为转录因子,在骨代谢调控中具有重要作用[12-13]。在骨骼发育、骨代谢动态平衡、骨再生和病理状态等不同条件下,在成骨前体细胞或成骨细胞内增强HIF1ɑ的表达,可明显促进骨形成[14-15]。而在骨细胞内选择性敲除HIF1ɑ,小鼠的骨小梁体积和数量明显减少[16]。在软骨细胞内选择性敲除HIF1ɑ,小鼠的软骨内成骨能力受损,新生骨小梁的密度和厚度都降低[17]。此外,在骨细胞内选择性敲除Fra-2基因,HIF1ɑ水平明显提高时,除了成骨活性的增加,小鼠骨组织切片还观察到了许多功能、形态异常的巨型破骨细胞[18]。在成骨和骨细胞内敲除PHD2基因,一种调节HIF1ɑ蛋白的稳定性的基因,细胞核内聚集的HIF1ɑ数量明显增加,小鼠骨小梁数量和体积,成骨细胞数量及骨形成能力都明显提升。同时,破骨细胞的数量及破骨代谢标志物的水平也明显降低[15]。这些研究表明,HIF1ɑ既能调控骨形成,又能调控骨吸收。
骨碎补、续断均归肝、肾经。骨碎补能活血续伤,兼温补肾阳。续断则以补肾阳为主,兼活血化瘀。中医认为,“阳化气,阴成形”是机体能量代谢和物质转化的一个动态变化过程,通过补阳促进“阳化气”可以调节能量代谢[19]。另一方面,研究已证明,中药活血化瘀的功能与其促进血管新生,提高细胞耐缺氧能力有密切关系[20]。作为缺氧应答中最为关键的转录因子,HIF1ɑ在调控细胞能量代谢、血管生成等方面具有重要作用[21]。虽然目前在骨碎补或续断的机制研究中对于HIF1ɑ的探讨极少,但已发现HIF1ɑ是其他多种活血或补阳类中药中的重要作用靶标[22-23]。本研究初步证实了HIF1ɑ是骨碎补-续断发挥双向调控成骨/破骨代谢作用的重要机制之一,为骨碎补-续断药对应用于治疗OP提供了一定的实验和理论依据。但作用于HIF1ɑ的主要药物活性物质是什么?药物通过HIF1ɑ调控骨代谢的下游具体分子机制是什么?骨碎补-续断药对是否还有其他重要的分子靶点和机制?仍有待进一步的研究进行证实或阐明。

