蓝萼甲素对宫颈癌C33A细胞增殖和凋亡的影响及机制
张 花,潘 莹,何全中
(新乡医学院第三附属医院妇产科,河南 新乡 453003)
宫颈癌是在世界范围内仅次于乳腺癌和结直肠癌的第三大女性恶性肿瘤,其发病率高,每年约 56.9万例新发病例,且其发病呈年轻化趋势[1]。宫颈癌与持续人乳头瘤病毒(human papilloma virus,HPV)感染密切相关,其中HPV-16型感染者占50%,HPV-18型占10%[2];但并不是所有感染了HPV的患者都进展为宫颈癌[3]。目前,有关HPV阳性宫颈癌细胞的研究比较多,但是关于HPV阴性宫颈癌的预防和治疗目前国内外研究较少,因此,HPV阴性宫颈癌的防治逐渐被研究者关注。
近年来,随着中药提取工艺的提高,中药在抗宫颈癌方面取得了一定的成绩[4-5]。蓝萼甲素(Glaucocalyxin A,GLA)和蓝萼乙素(Glaucocalyxin B,GLB)是从药用植物蓝萼香茶菜中分离鉴定的2种二萜化合物[6]。有研究显示,GLB对肺腺癌AGZY细胞、HL-60白血病细胞等多种肿瘤细胞的生长具有抑制作用[6]。本课题组前期的细胞及动物实验证实,GLB对宫颈癌SiHa及HeLa细胞的生长均有明显抑制作用[7-9]。因GLA与GLB活性结构的相似性,故GLA在抗肿瘤方面也有一定的作用[10]。本课题组前期研究证实,GLA对宫颈癌HeLa及SiHa细胞均有明显抑制作用,其机制可能与上调p53和Bax的表达有关[11]。
肿瘤细胞凋亡是由多种因素参与的过程,B淋巴细胞瘤-2基因相关启动子(Bcl-xl/Bcl-2 associated death promoter,BAD)基因是Bcl-2家族成员之一,近年来BAD蛋白在细胞凋亡过程中的调控作用成为许多学者的研究热点。10号染色体缺失与张力蛋白同源磷酸酶(phosphatase and tensin ho-molog deleted from chromosome 10,PTEN)基因缺失或失活可激活下游3-磷酸肌醇激酶(phosphatidylinositol 3-hydroxykinase,PI3K),进而通过PI3K/蛋白激酶B(protein kinase B,Akt)/BAD通路,抑制细胞凋亡。本研究旨在通过观察GLA对HPV阴性宫颈癌C33A细胞中p-BAD和PTEN的影响,探讨GLA对宫颈癌C33A细胞增殖和凋亡的影响及其可能机制,以期为GLA在临床HPV阴性宫颈癌治疗中的应用提供依据。
1 材料与方法
1.1 细胞和主要试剂宫颈癌C33A细胞由新乡医学院病理学教研室提供,GLA由新乡医学院药理学教研室提供[6],胎牛血清(fetal bovine serum,FBS)、达尔伯克改良伊格尔培养基(Dulbeco′s modified Eagle′s medium,DMEM)购自美国Invitrogen公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司,磷酸盐缓冲液(phosphate buffered saline,PBS)购自北京中杉金桥公司,放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解缓冲液、苯甲基磺酰氟(phenylmethylsulfonyl fluorid,PMSF)、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白定量试剂盒、人膜联蛋白 V-异硫氰酸荧光素(annexin V-fluorescein isothiocyanate,Annexin V-FITC)细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,抗 PTEN单克隆抗体购自美国ProSci公司,抗p-BAD体购自美国SAB公司,3,3′-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠[Sodium3,3′-[1-(phenylamino)carbonyl-3,4-tetrazolium-bis(4-methoxy-6-nitro)benzenesulfonic acid,XTT]检测试剂盒购自美国Biotium公司。
1.2 实验方法
1.2.1 细胞培养和GLA溶液配制将宫颈癌C33A细胞接种于含体积分数10% FBS的DMEM中,置于 37 ℃、含体积分数5%CO2的培养箱中进行培养;然后,用胰蛋白酶消化,每2~3 d 传代 1次,待细胞密度达80%~90%,取对数生长期细胞用于后续实验。称取3.32 mg GLA,加入200 μL DMSO和PBS混合液(各100 μL),配制成 50 mmol·L-1储存液,使用时再用细胞培养液按1100 稀释成 500 μmol·L-1工作液,分别使用细胞培养液按 1100、150、125、112.5比例将工作液进一步稀释,获得终浓度5、10、20、40 μmol·L-1GLA。
1.2.2 XTT法检测细胞增殖能力取对数生长期C33A细胞,按每孔10 000个细胞接种于96孔板中,随机分为阴性对照组、5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组、40 μmol·L-1GLA组,阴性对照组细胞不加任何药物干预,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞分别加入终浓度为5、10、20、40 μmol·L-1GLA进行干预,每个浓度设定5个复孔;同时设置空白对照组(调零孔),该组不加细胞和药物;将各组细胞置于37 ℃、含体积分数5%CO2培养箱继续培养;分别于接种后4、24、48、72 h后每孔加入25 μL XTT 混合液(含25 μL XTT和5 mL PMS),继续培养4 h,轻微震荡一下孔板后,用酶标仪测定各孔在492 nm处吸光度值,计算细胞增殖抑制率,细胞增殖抑制率(%)=[1-(实验组吸光度值/空白对照组吸光度值)]×100%。
1.2.3 流式细胞术检测细胞凋亡情况取对数生长期C33A细胞,调整细胞密度为 1×105L-1,接种于培养瓶,随机分为阴性对照组、5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组,阴性对照组细胞不加任何药物干预,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞分别加入终浓度为5、10、20 μmol·L-1GLA进行干预;将各组细胞置于37 ℃、含体积分数5%CO2培养箱继续培养;培养48 h后,收集细胞,使用PBS重悬细胞并计数;取重悬的(5~10)×104细胞,1 000 r·min-1离心5 min,弃上清,依次进行Annexin V-FITC和碘化丙啶标记,用流式细胞仪检测细胞凋亡情况。实验重复3次,取均值。
1.2.4 Western blot法检测细胞中PTEN和磷酸化BAD(phosphorylated BAD,p-BAD)蛋白相对表达量取对数生长期C33A细胞,调整细胞密度为 1×105L-1,接种于培养瓶,随机分为阴性对照组、5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组,阴性对照组细胞不加任何药物干预,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞分别加入终浓度为5、10、20 μmol·L-1GLA进行干预,将各组细胞置于37 ℃、含体积分数5%CO2培养箱继续培养;培养48 h后,收集各组细胞,用预冷的 PBS 重悬,1 500 r·min-1离心5 min,重复1次,弃上清;再加入少量 PBS 重悬后,3 000 r·min-1离心 5 min,弃上清;然后,加入1 mL细胞裂解液(1 mL RIPA 细胞裂解液和5 μL PMSF),冰上静置 30 min;再应用超声细胞粉碎机将细胞置于冰上超声(超声时间 1 s,间隔 5 s,共 5 次),4 ℃下12 000 r·min-1离心15 min,取上清;按照每4 μL蛋白样品加入1 μL蛋白上样缓冲液的比例混合蛋白样品和蛋白上样缓冲液,100 ℃加热3 min;采用 BCA法测定蛋白样品浓度;配制十二烷基硫酸钠聚丙烯酰胺凝胶,将准备好的样品和彩色预染蛋白质分子质量标准分别加入各个上样孔中进行电泳,采用半干转膜仪进行转膜1.5 h;然后,用质量分数 50 g·L-1脱脂奶粉封闭 1 h;再分别加入兔抗人PTEN一抗(滴度11 000)、鼠抗人p-BAD一抗(滴度1500)、鼠抗人Tubulin一抗(滴度11 000)孵育,并滴加相应二抗辣根过氧化物酶标记山羊抗兔抗体(滴度15 000)和辣根过氧化物酶标记山羊抗鼠抗体(滴度15 000)孵育;使用BeyoECL Plus发光试剂盒在暗室压片曝光,应用Quantity-one软件分析目的条带灰度值,计算p-BAD和PTEN的相对表达量,目的蛋白相对表达量以目的蛋白的灰度值与内参蛋白的灰度值比值表示。实验重复3次,取均值。
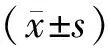
2 结果
2.1 5组细胞增殖能力比较结果见表1。培养24、48、72 h时,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞增殖抑制率显著高于阴性对照组,10 μmol·L-1GLA组、20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞增殖抑制率显著高于5 μmol·L-1GLA组,20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞增殖抑制率显著高于10 μmol·L-1GLA组,40 μmol·L-1GLA组细胞增殖抑制率显著高于20 μmol·L-1GLA组,差异有统计学意义(P<0.05)。不同浓度GLA组培养48、72 h时细胞增殖抑制率显著高于培养24 h时,培养72 h时细胞增殖抑制率显著高于培养48 h,差异有统计学意义(P<0.05)。

表1 5组细胞增殖抑制率比较
2.2 阴性对照组、5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞凋亡率比较结果见图1。阴性对照组、5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞凋亡率分别为(10.38±0.63)%、(13.59±0.39)%、(15.99±0.72)%、(21.52±0.52)%。4组间细胞凋亡率比较差异有统计学意义(F=197.892,P<0.05);5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞凋亡率显著高于阴性对照组,10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞凋亡率显著高于5 μmol·L-1GLA组,20 μmol·L-1GLA组细胞凋亡率显著高于10 μmol·L-1GLA组,差异有统计学意义(P<0.05)。

A:阴性对照组;B:5 μmol·L-1 GLA组;C:10 μmol·L-1 GLA组;D:20 μmol·L-1 GLA组。
2.3 阴性对照组、5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中PTEN和p-BAD 蛋白相对表达量比较结果见图2和表2。5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中p-BAD蛋白相对表达量显著低于阴性对照组,10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中p-BAD蛋白相对表达量显著低于5 μmol·L-1GLA组,20 μmol·L-1GLA组细胞中p-BAD蛋白相对表达量显著低于10 μmol·L-1GLA组,差异有统计学意义(P<0.05)。5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中PTEN蛋白相对表达量显著高于阴性对照组,10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中PTEN蛋白相对表达量显著高于5 μmol·L-1GLA组,20 μmol·L-1GLA组细胞中PTEN蛋白相对表达量显著高于10 μmol·L-1GLA组,差异有统计学意义(P<0.05)。
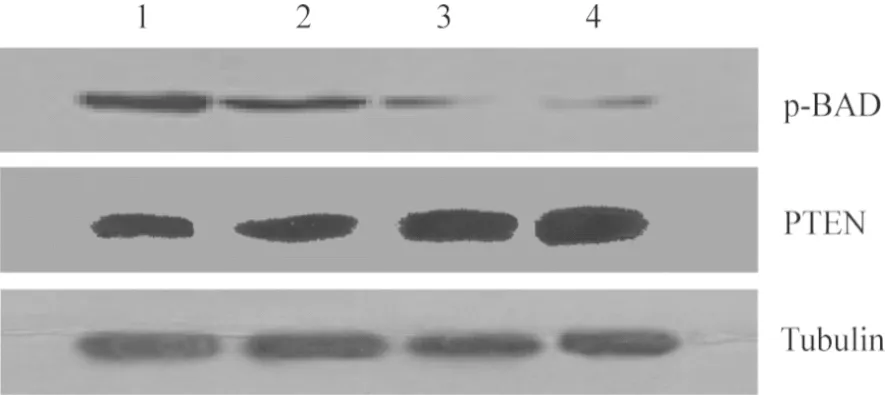
1:阴性对照组;2:5 μmol·L-1 GLA组;3:10 μmol·L-1 GLA组;4:20 μmol·L-1 GLA组。

表2 阴性对照组、5 μmol·L-1 GLA组、10 μmol·L-1 GLA组、20 μmol·L-1 GLA组细胞中p-BAD和PTEN蛋白相对表达量比较
3 讨论
宫颈癌的发病率高,占妇科恶性肿瘤的第2位,是大多数发展中国家女性癌症死亡的主要原因[1]。HPV持续感染与宫颈癌发生发展密切相关[2]。目前,临床上宫颈癌的治疗方法主要以手术、放射治疗、化学治疗为主。随着研究深入,已发现多种与宫颈癌发生相关的因素,如肿瘤微环境、免疫因素等,有关宫颈癌治疗的研究也更加多元化,包括基因干扰、免疫调节、中药治疗等。随着中药提取工艺的提高,中医药的研究逐渐趋向于采用分子生物学手段对其药理作用机制给予新的解释,传统中药在抗肿瘤方面的研究得到进一步细化。GLA和GLB是从蓝萼香茶菜中提取的2种二萜化合物,具有15-氧-16贝壳杉烯骨架,均有较好的抗肿瘤作用。有研究证实,GLB可通过细胞周期阻滞及直接诱导细胞死亡的方式增加胃癌细胞对化学治疗药物敏感性[12]。吴元肇等[13]研究证实,GLB可抑制乳腺癌细胞的增殖、迁移及侵袭。本课题组前期通过细胞及动物模型实验证实,GLB以剂量依赖的方式抑制宫颈癌HeLa和SiHa细胞株的增殖,增加HeLa和SiHa细胞凋亡,诱导HeLa和SiHa细胞自噬;其机制可能是通过调控磷脂酰肌醇-4,5-二磷酸3-激酶/Akt信号通路、JNK和p38丝裂原活化蛋白激酶信号通路等实现[7-9]。关于GLA在抗肿瘤方面的研究也证实,GLA对肺癌、乳腺癌、骨肉瘤、舌鳞状细胞癌等肿瘤细胞均有抑制作用[10-11,14-15]。但目前的研究多针对Caski细胞、HeLa细胞、SiHa等HPV 阳性宫颈癌细胞,有关 HPV 阴性宫颈癌细胞的研究相对较少。
本研究以HPV阴性宫颈癌C33A细胞为研究对象,采用细胞体外培养的方法观察GLA对C33A细胞增殖的影响,结果显示,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞增殖抑制率显著高于阴性对照组,10 μmol·L-1GLA组、20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞增殖抑制率高于5 μmol·L-1GLA组,20 μmol·L-1GLA组、40 μmol·L-1GLA组细胞增殖抑制率高于10 μmol·L-1GLA组,40 μmol·L-1GLA组细胞增殖抑制率高于20 μmol·L-1GLA组,说明不同浓度GLA对宫颈癌C33A细胞增殖有显著抑制作用,且呈浓度依赖性。本研究结果显示,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞凋亡率显著高于阴性对照组,10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞凋亡率显著高于5 μmol·L-1GLA组,20 μmol·L-1GLA组细胞凋亡率显著高于10 μmol·L-1GLA组,说明GLA可促C33A细胞凋亡,且呈剂量依赖性。本研究结果与GLA在肝癌SMMC-7721细胞[14]、骨肉瘤细胞[15]、宫颈癌 HeLa 细胞等[10]方面的研究结果一致。
BAD基因是Bcl-2家族成员之一,生理状态下BAD蛋白存在磷酸化和非磷酸化2种状态。BAD蛋白存在Bcl-2家族成员BH3同源结构域,在凋亡刺激信号作用下非磷酸化的BAD蛋白可与Bcl-2、Bcl-xl形成异源二聚体,特异性替换Bcl-2/Bax、Bcl-xl/Bax的Bax,进而促进细胞凋亡[16]。当生长因子作用于细胞时,BAD在Akt等信号通路的作用下使多个丝氨酸残基磷酸化,p-BAD与14-3-3蛋白结合成复合物并稳定存在于细胞质中,从而发挥抗凋亡效应[17]。近年来,BAD蛋白在凋亡过程中的调控作用成为许多学者的研究热点。有研究结果显示,过表达p-BAD蛋白的星形胶质瘤患者的生存率明显下降[18]。BANSAL等[19]研究报道,通过RNA干扰技术抑制卵巢癌细胞CDK1的表达,使p-BAD水平降低,可提高卵巢癌细胞对铂类化学治疗药物的敏感性,且增加细胞凋亡。有研究报道,在多种肿瘤细胞中BAD蛋白的磷酸化状态受Akt信号通路的调控,PTEN基因缺失或失活可激活下游PI3K,进而通过PI3K/Akt/BAD通路抑制细胞凋亡[20-21]。LI等[22]研究报道,苦参碱可通过诱导乳腺癌细胞中PTEN表达上调,通过Akt途径使BAD蛋白脱磷酸化,导致BAD蛋白积聚,从而诱导细胞凋亡。本研究结果显示,5 μmol·L-1GLA组、10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中p-BAD蛋白相对表达量低于阴性对照组,PTEN蛋白相对表达量高于阴性对照组;10 μmol·L-1GLA组、20 μmol·L-1GLA组细胞中p-BAD蛋白相对表达量低于5 μmol·L-1GLA组,PTEN蛋白相对表达量高于5 μmol·L-1GLA组;20 μmol·L-1GLA组细胞中p-BAD蛋白相对表达量低于10 μmol·L-1GLA组,PTEN蛋白相对表达量高于10 μmol·L-1GLA组;说明GLA诱导宫颈癌C33A细胞凋亡的机制可能是通过上调PTEN蛋白的表达,激活PI3K/Akt等信号转导,使BAD蛋白脱磷酸化,降低p-BAD蛋白表达,从而诱导细胞凋亡。
综上所述,GLA可抑制HPV阴性宫颈癌细胞C33A的增殖,促进HPV阴性宫颈癌细胞C33A的凋亡,且呈剂量依赖性,其机制可能是通过上调PTEN蛋白的表达,激活PI3K/Akt等信号转导,使BAD蛋白脱磷酸化,导致BAD蛋白积聚,从而诱导细胞凋亡。本研究为中药GLA治疗HPV阴性宫颈癌提供了强有力的依据,但其确切机制还需进一步验证;另外,与其他药物或生物疗法的配伍应用的疗效、在宫颈癌动物模型上的应用等还需要进一步探讨。

