日本结缕草ZjTCP20基因生物信息学及表达模式分析
杨卓雄, 董 笛, 韩烈保,晁跃辉
(北京林业大学, 北京 100083)
TCP转录因子是高等植物所特有的转录因子小家族,由三个特征成员玉米的TEOSINTE BRANCHRED 1(TB1)、金鱼草(Antirrhinummajus)的CYCLOIDEA(CYC)以及水稻(Oryzasativa)的PROLIFERATING CELL FACTORS(PCFs)命名[1]。TCP结构域包含一个非典型的碱性-螺旋-环-螺旋(bHLH)结构域,涉及DNA结合、蛋白质-蛋白质相互作用和蛋白质核定位[2]。基于氨基酸序列的差异,特别是在TCP结构域的基本区域,TCP转录因子家族可进一步分为Ⅰ类和Ⅱ类两个亚家族,Class Ⅰ类的TCP也称作TCP-P类,以水稻中的PCF1与PCF2为代表,Class Ⅱ类的TCP也称作TCP-C类,以金鱼草中的CYC和玉米中的TB1为代表[3]。与Class Ⅰ的成员相比,Ⅱ类成员在TCP结构域多有四个氨基酸残基,例如谷氨酸-半胱氨酸-谷氨酸(ECE)延伸,一些Ⅱ类蛋白质包含一个由极性氨基酸组成的保守R结构域,通过形成亲水螺旋介导蛋白质相互作用[2,4]。Ⅱ类成员可以根据TCP结构域中的序列差异进一步细分为CIN和CYC两个分支,CIN子代以CINCINNATA(CIN)为代表,而CYC子代以CYC/TB1为代表[5-6]。
TCP转录因子在植物发育过程中起着至关重要的作用。研究表明Class Ⅱ类中的CIN和CYC两个分支主要参与植物发育,但Class Ⅰ类的基因的作用则与之相反,在调控叶片发育过程中最为明显,Ⅱ类基因抑制细胞增殖,而Ⅰ类则是正向调控[7]。此外,在Ⅰ类TCP转录因子成员中,拟南芥(Arabidopsisthaliana)的TCP14和TCP15分别参与了叶片和花发育过程中细胞增殖的激活和抑制[8]。TCP1通过与DWF4启动子相互作用,调控DWF4的转录,进一步调控植物的生长发育[9]。拟南芥AtTCP23过表达株系显示出晚花表型和叶片形态改变,表明AtTCP23参与了对开花时间和发育的调控[10]。在Ⅱ类TCP转录因子成员中,CIN基因参与了侧向器官的发育及调控细胞分裂素和生长素信号转导,CYC/TB1基因与植物开花有关[11]。根据系统发育分析,将CYC/TB1基因进一步分为三类(CYC1,CYC2和CYC3)[12]。CYC1基因在控制腋芽分化和分枝中起着重要作用,CYC2基因在控制花的正向和背面对称性中起着重要作用,而CYC3在花原基和侧枝中均有表达,但对花分枝的控制不大[4,12-13]。
TCP20是Ⅰ类TCP转录因子中的成员,属于古老植物特有的基因家族,可调控植物芽、花和胚的发育[14]。在拟南芥中,AtTCP20可以促进生长素的合成,对茉莉酸的代谢起负调控作用[15-16]。有研究显示,AtTCP20可介导拟南芥根部的硝酸盐吸收的系统信号通路,tcp20突变体在根生长方面有缺陷,但在根的硝酸盐吸收反应中没有缺陷[17]。
日本结缕草(Zoysiajaponica)是禾本科(Gramineae)结缕草属(Zoysia)多年生草本,主要用于运动场地草坪。属于暖季型草坪草喜温暖湿润气候,喜光,且有一定的耐阴性,抗旱、抗盐碱、耐瘠薄、耐践踏[18-19]。TCP基因家族广泛存在与高等植物中,但关于TCP20基因的研究鲜有报道,因此本研究通过对日本结缕草ZjTCP20基因的克隆及生物信息学分析来为TCP转录因子提供科学依据,也有助于后续研究日本结缕草的生长发育奠定基础。
1 材料与方法
1.1 试验材料及试剂
试验采用的日本结缕草种由北京林业大学草坪分子实验室提供,放置人工气候箱内培养,昼夜相对时长为14/10 h,温度为26℃,湿度为60%。克隆载体pMD19-T、T4 DNA连接酶、反转录Prime Script RT试剂盒、限制性核酸酶NcoⅠ和EcoRⅠ、酵母转化试剂盒和荧光定量试剂TB Green Premix Ex Taq Ⅱ购买于TaKaRa公司。RNA提取试剂盒Plant RNA Kit、PCR纯化试剂盒Cycle-Pure Kit、细胞质粒提取试剂盒Plasmid mini KitⅠ等购买于OMEGA公司。大肠杆菌DH5α感受态细胞购买于博雅宏兴,酵母菌株Y2HGold、酵母阳性对照质粒pGBT9、阴性对照BD空载、农杆菌EHA105、植物表达载体3302-3flag等,均来自北京林业大学草坪分子实验室。脱落酸等植物激素购自SIGMA公司。其它应用的试剂均为国内分析纯。
1.2 试验方法
1.2.1引物设计 引物设计应用软件Primer Premier 5[19]。基于已知的日本结缕草参考基因组序列及本实验室测定的转录组信息设计特异性引物ZjTCP20-F和ZjTCP20-R扩增ZjTCP20基因以所获得的ZjTCP20全长序列[20]。并且以BD载体的序列为基础,设计BD载体连接引物BD-TCP20-F和BD-TCP20-R。设计引物3302Y-TCP20-F及3302Y-TCP20-R用于35S-ZjTCP20-YFP的载体构建。日本结缕草Actin基因作为内参,内参引物分别为ZjActin-F以及ZjActin-R,ZjTCP20-qPCR-F和ZjTCP20-qPCR-R以ZjTCP20基因序列为基础,作为荧光定量检测的特异性引物(表1)。

表1 本试验所用引物序列Table 1 Primer sequences used in the experiment
1.2.2基因克隆 日本结缕草经1个月生长成熟后,剪取叶片将其研磨,按照试剂盒说明提取总RNA并进行反转录得到cDNA。利用ZjTCP20-F和ZjTCP20-R对cDNA进行扩增,反应程序为95℃/ 10 min;95℃/15 s,58℃/30 s(—0.1℃/cycle),72℃/90 s,30个循环;72℃/5 min,12℃保温。凝胶电泳检测后,将其与T载相连,转入大肠杆菌DH5α,挑取在Amp抗性LB培养基上大肠杆菌单菌落,进行检测,选择符合长度要求的菌落送至生物公司测序,选择测序正确的菌落进行保菌和质粒提取。
1.2.3生物信息学分析 使用ExPASy网站(http://expasy.org/)对蛋白质长度、等电点、分子量、疏水性等性质进行分析[21]。利用Phyre 2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)工具预测蛋白质三级结构[22]。根据SignalP 4.1网站(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽[23]。通过NCBI数据库(https://www.ncbi.nlm.nih.gov/homologene)查找TCP20同源蛋白[24]。利用MEME网站(http://meme-suite.org/tools/meme)以及TBtools、MEGA 5.0 软件进行保守结构域以及系统发育进化树分析[25-26]。
1.2.435S-ZjTCP20-YFP载体构建及亚细胞定位 利用特异性引物3302Y-TCP20-F和3302Y-TCP20-R扩增模板pMD-ZjTCP20,并且使用限制性内切酶EcoR Ⅰ酶切35S-YFP载体,利用无缝链接酶连接PCR产物和35S-YFP载体,转化大肠杆菌。对构建成功的载体,将其质粒转化农杆菌感受态EHA105,注射本生烟草叶片,然后将烟草置于黑暗环境下培养48 h,共聚焦显微镜下观察YFP信号在细胞中的分布情况[27]。
1.2.5BD-ZjTCP20载体的构建及Y2HGold酵母的转化 利用引物BD-TCP20-F和BD-TCP20-R,扩增pMD-ZjTCP20模板,并用限制性内切酶Nco Ⅰ酶切载体BD,纯化后,将切好的载体与PCR产物连接,构建BD-TCP20载体,转入大肠杆菌感受态DH5α中。使用BD载体的通用引物3’ BD和T7对单菌落进行验证,选择长度接近的单菌落送至生物公司测序。大量提取测序准确的载体质粒,并将其阳性对照pGBT9质粒和阴性对照BD空载按照酵母转化试剂盒要求一起转到大肠杆菌Y2H菌株中。
1.2.6转录自激活试验 将转化的BD-ZjTCP20的Y2HGold酵母菌株涂于SD/-Trp平板上,比较BD和BD-ZjTCP20在培养基上菌落呈现的状态。然后将转化BD-TCP20载体成功的Y2HGold酵母涂于SD/-Trp、SD/-Trp/X-a-Gal、SD/-Trp/X-a-Gal/AbA培养基上,在30℃下孵育。观察Y2HGold酵母菌株的生长状态和菌株颜色进行记录及统计。
1.2.7实时荧光定量PCR 采集植物幼嫩叶片,成熟叶片和衰老叶片以及成熟的茎和根。对成熟叶片分别喷施10 μmol·L-1浓度的赤霉素及0.5 mmol·L-1浓度的水杨酸,取6个时间点0,1,3,6,12和24 h的叶片样品。将上述所有样品立即液氮速冻,并研磨提取总RNA,反转录得到cDNA。内参引物为ZjActin-F和ZjActin-R,设计特殊引物ZjTCP20-qPCR-F和ZjTCP20-qPCR-R按照试剂盒要求进行实时荧光定量。
1.2.8数据分析 利用SPSS进行显著性分析(P<0.05),利用Microsoft Excel 2010绘图。
2 结果与分析
2.1 日本结缕草ZjTCP20基因的克隆
利用设计好的引物ZjTCP20-F和ZjTCP20-R对cDNA进行扩增,扩增出一条长624 bp的单一条带,编码208个氨基酸(图1)。将其与T载相连,转入大肠杆菌DH5α,挑取在大肠杆菌单菌落,选择符合长度要求的质粒命名为pMD-ZjTCP20。

图1 日本结缕草ZjTCP20基因的克隆Fig.1 Cloning of ZjTCP20 gene from Zoysia japonica注:A,ZjTCP20基因的PCR鉴定;B,ZjTCP20基因的cDNA序列及蛋白质序列Note: A, PCR identification of ZjTCP20 gene;B,The cDNA sequence and protein sequence of the ZjTCP20 gene
2.2 日本结缕草ZjTCP20蛋白质结构分析
ZjTCP20分子式为C909H1397N277O287S7,由208个氨基酸组成,分子量为21.02 kD,理论等电点为5.55。在蛋白二级结构组件中,随机线圈占比高达69%,α螺旋占比为46%,β链的含量占比最少,为1%(图2A)。蛋白质三级结构结果预测ZjTCP20蛋白由螺旋和环构成(图2B)。利用SignalP 4.1 网站预测ZjTCP20蛋白质,结果显示无信号肽(图2C)。ZjTCP20蛋白质的疏水性图谱如图2D所示,数值大于0表示疏水性,小于0则表示亲水性。总平均亲水性为-0.250,则ZjTCP20可能为亲水蛋白。

图2 日本结缕草ZjTCP20蛋白结构预测Fig.2 Prediction structure of ZjTCP20 protein from Zoysia japonica注:A,ZjTCP20 蛋白的二级结构预测;B,ZjTCP20 蛋白的三级结构预测;C,ZjTCP20信号肽预测;D,ZjTCP20蛋白疏水性图谱Note:A,Prediction secondary structure of ZjTCP20 protein;B,Prediction tertiary structure of ZjTCP20 protein;C,Prediction signal peptide of ZjTCP20 protein;D,Prediction hydrophobicity map of ZjTCP20 protein
2.3 日本结缕草蛋白进化树及保守结构域分析
MEGA 5.0 及TBtools对TCP20 同源蛋白进行比对并绘制系统发育进化树,结果显示日本结缕草中的TCP20蛋白与玉米中ZmTCP20最相似(图3)。蛋白的保守结构域分析显示TCP20蛋白内有三段最为保守的结构域,ZjTCP20 蛋白与BrTCP20 蛋白等其他TCP20蛋白相比缺少了一段蛋白结构域(图4)。

图3 日本结缕草ZjTCP20蛋白的遗传进化树分析Fig.3 Phylogenetic analysis of ZjTCP20 protein from Zoysia japonica注:RcTCP20表示QXP08756.1 月季(Rosa chinensis)TCP20-like,PhTCP20表示QZI95745.1 二球悬铃木(Platanusx hispanica)TCP20-like,JcTCP20表示XP_012085729.1 麻风树(Jatropha curcas)TCP20-like,CmTCP20表示QBK47072.1 杭白菊(Chrysanthemum x morifolium)TCP20-like,DcTCP20表示PKU81455.1 铁皮石斛(Dendrobium catenatum)TCP20-like,ZmTCP20表示NP_001142396.1 玉米(Zea mays)TCP20-like,AtTCP20表示OAP02465.1 拟南芥(Arabidopsis thaliana)TCP20-like,BrTCP20表示ATG83546.1 芜菁(Brassica rapa subsp. Rapa)TCP20-likeNote:RcTCP20 stands for Rosa chinensis TCP20-like,PhTCP20 stands for QZI95745.1 Platanusx hispanica TCP20-like,JcTCP20 stands for XP_012085729.1 Jatropha curcas TCP20-like,CmTCP20 stands for QBK47072.1 Chrysanthemum x morifolium TCP20-like,DcTCP20 stands for PKU81455.1 Dendrobium catenatum TCP20-like,ZmTCP20 stands for NP_001142396.1 Zea mays TCP20-like,AtTCP20 stands for OAP02465.1 Arabidopsis thaliana TCP20-like,BrTCP20 stands for ATG83546.1 Brassica rapa subsp. Rapa TCP20-like
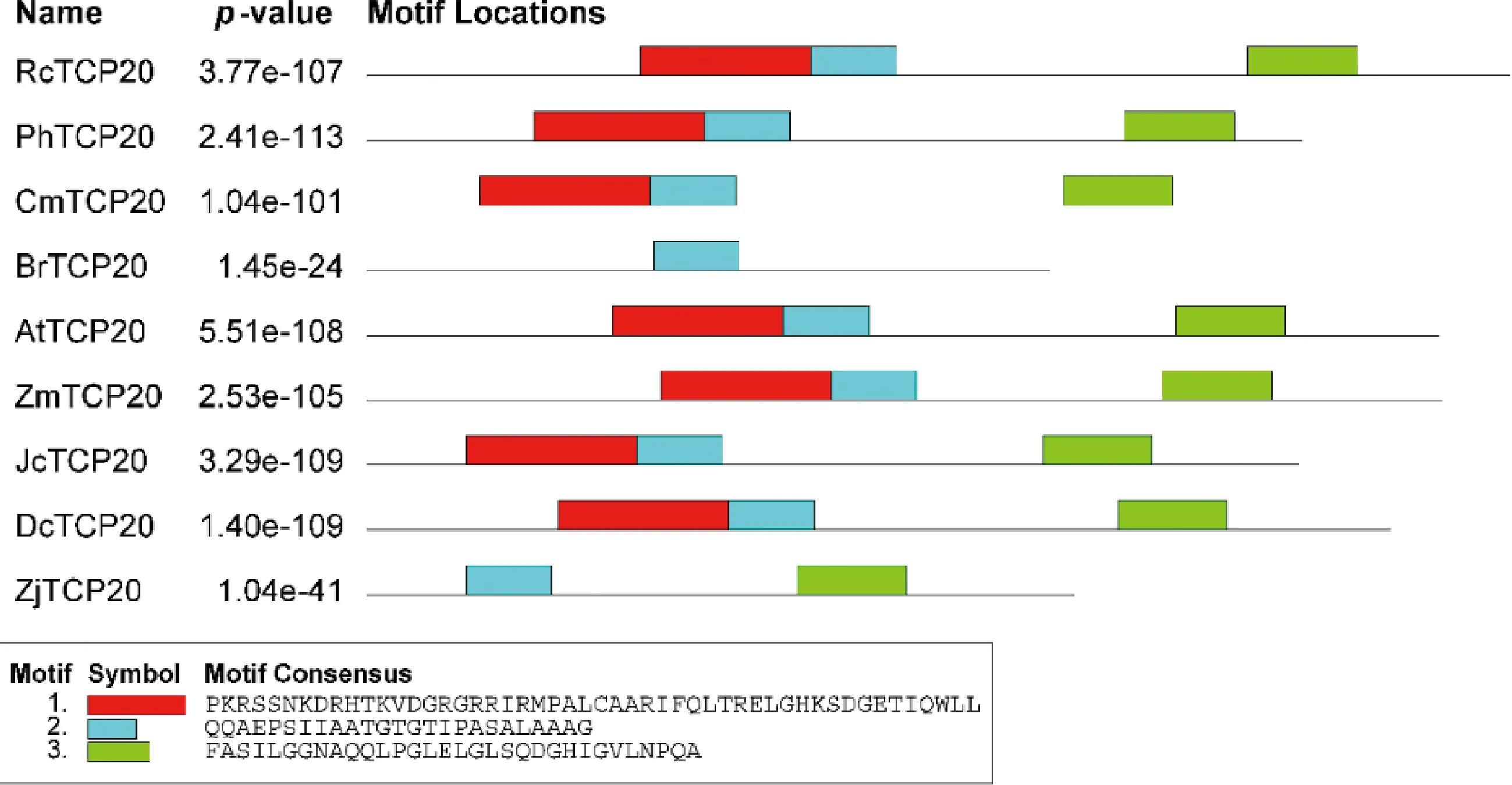
图4 TCP20蛋白的保守结构域分析Fig.4 The conserved motifs analysis of TCP20 proteins
2.4 日本结缕草ZjTCP20亚细胞定位分析
为研究ZjTCP20在细胞中的定位情况,将构建完整的 35S-ZjTCP20-YFP载体转化EHA105农杆菌,注射本生烟草叶片,结果显示ZjTCP20 蛋白定位在叶绿体、细胞质和细胞核上(图5)。

图5 日本结缕草ZjTCP20 亚细胞定位情况Fig.5 Subcellular localization of ZjTCP20 from Zoysia japonica注:A,融合场;B,叶绿体自发荧光;C,激发光Note:A,Merged;B,Chloroplast autofluorescence;C,Ultraviolet field
2.5 酵母自激活检测
转入BD-TCP20载体、阳性对照pGBT9载体和阴性对照BD空载的Y2HGold酵母在SD/-Trp的培养基内生长正常,且BD-TCP20和阳性对照在SD/-Trp/X-a-Gal培养基和SD/-Trp/X-a-Gal/AbA培养基内可以正常生长,形成蓝色菌斑(图6A,6B),BD空载不能形成蓝色菌斑(图6C),证实ZjTCP20具备自激活活性。
2.6 日本结缕草ZjTCP20基因表达模式分析
通过RT-PCR试验研究日本结缕草ZjTCP20基因在不同组织器官、叶片不同发育时期及不同激素处理的表达模式。结果表明,该基因在叶片中大量表达,且与根和茎的表达量有显著差异(图7A)。在叶片不同发育时期下,ZjTCP20基因在幼嫩叶片中大量表达,随植物生长基因表达量不断下降(图7B)。经脱落酸(ABA)处理后,ZjTCP20基因的表达没有显著差异(图7C),这表明ZjTCP20基因很可能不受ABA激素的诱导。经水杨酸(SA)处理后,ZjTCP20表达量在喷施6 h后显著下降,但总体没有显著差异(图7D)。经茉莉酸甲酯(MeJA)处理后,ZjTCP20表达量在3 h没有显著差异,但在6 h迅速升高,总体没有显著差异(图7E)。
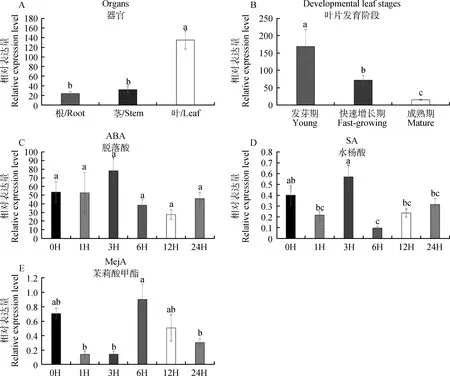
图7 日本结缕草中的ZjTCP20的表达模式Fig.7 Expression patterns of ZjTCP20 in Zoysia japonica
3 讨论
转录因子参与特定生理或生化过程的调控,在调控植物非生物逆境胁迫方面发挥重要作用[28]。TCP是植物所特有的一类转录因子,在诸多植物中被鉴定出来,参与调控植物的生长发育、衰老及逆境应答等多个生物学过程[29-30]。根据氨基酸序列的差异,TCP转录因子可被分为Class Ⅰ和Class Ⅱ两个亚家族,TCP20属于Ⅰ类TCP转录因子中的成员[31]。本研究对日本结缕草ZjTCP20基因进行克隆、生物信息学分析、自激活检测及表达分析来探究ZjTCP20基因的特性。从日本结缕草中克隆得到ZjTCP20完整编码区有624 bp,编码208个氨基酸。蛋白分子量为21.02 kD,具有疏水性,但不具信号肽。构建系统发育进化树有利于研究生物的进化关系,对TCP20同源蛋白进行比对,绘制系统发育进化树显示日本结缕草中的TCP20蛋白与玉米中ZmTCP20亲缘关系最近[32]。亚细胞定位显示ZjTCP20定位在叶绿体、细胞质和细胞核内。酵母双杂交系统主要应用于快速验证蛋白之间的相互作用,将构建好的载体BD-TCP20 转入酵母菌Y2HGold,其在SD/-Trp培养基上可以正常生长,且在SD/-Trp/X-a-Gal和SD/-Trp/X-a-Gal/AbA培养基上正常生长并形成蓝色菌斑,其阳性对照pGBT9也可以形成蓝色菌斑,而阴性对照BD空载不能形成蓝色菌斑,证明ZjTCP20 可自激活,说明ZjTCP20不能用于酵母双杂交系统。TCP转录因子的N末端拥有非典型螺旋-环-螺旋(bHLH)结构域,但TCP转录因子与bHLH转录因子没有同源性,并结合不同于bHLH转录因子识别的DNA结构域[14]。根据蛋白质二、三级结构预测,ZjTCP20属于非典型的bHLH蛋白。
研究显示I类和II类TCP的分子机制可能在拮抗关系中发挥作用[7]。TCP20可能与它相互作用的蛋白TCP4,充当靶基因转录的激活子或抑制子。TCP20等的I类TCP抑制茉莉酸生物合成基因LOX2(脂氧合酶2,LIPOXYGENASE2),II类TCP4则可以激活其表达。随着TCP4丰度的增加,LOX2的表达量以及茉莉酸产量在叶片发育后期增加。在叶片发育的早期,茉莉酸通过抑制细胞增殖影响细胞增殖向细胞膨胀转变,而在叶片发育的晚期,茉莉酸诱导叶片衰老(图8)[16]。表达模式结果显示,该基因在叶片中大量表达,与根系和茎的表达量存在显著差异,且相对于成熟和衰老叶片,ZjTCP20基因在幼嫩叶片中大量表达,并与成熟和衰老叶片的基因表达量存在显著差异。激素处理后,该基因不受脱落酸(ABA)诱导,在水杨酸(SA)和茉莉酸甲酯(MeJA)的诱导下ZjTCP20基因表达总体没有显著差异。ZjTCP20响应茉莉酸调控的相关研究有待后续试验进行探究。后续研究中可通过研究表达模式及激素含量测定,探究ZjTCP20基因应答茉莉酸的机制,为ZjTCP20基因的功能提供更多参考依据。
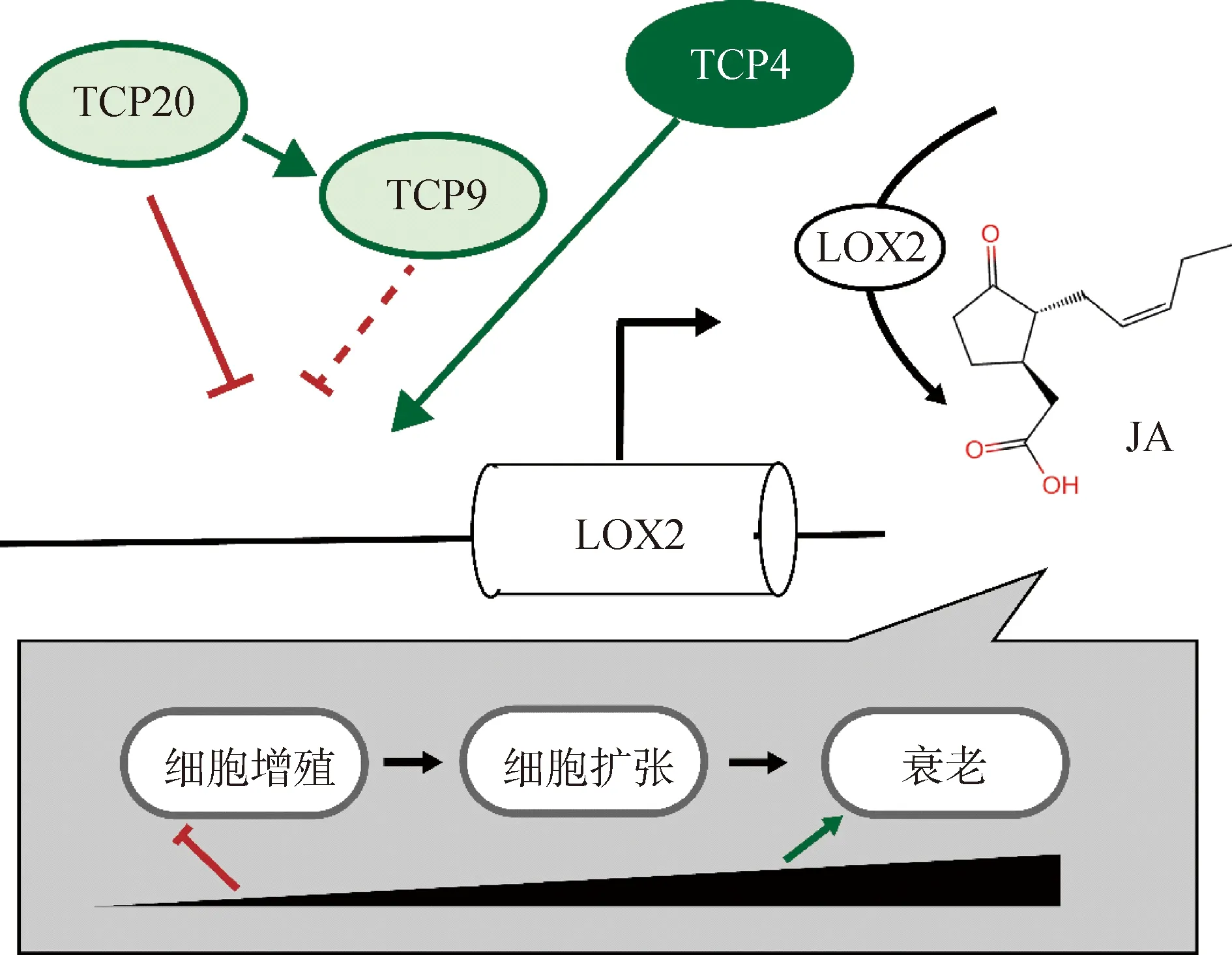
图8 I类及II类TCP转录因子拮抗调控叶片发育模型Fig.8 Leaf development model for antagonistic regulation by Class I and Class II of TCP transcription factors注:I类TCP,TCP20,TCP9;II类TCP,TCP4Note:Class I TCP,TCP20,TCP9;Class II TCP,TCP4
4 结论
本试验将ZjTCP20基因从日本结缕草中成功克隆出,共624 bp,编码208个氨基酸残基。ZjTCP20蛋白预测结果表明该蛋白不具有信号肽,具有疏水性,通过蛋白质二级、三级结构预测,发现其属于非典型的bHLH蛋白。系统发育进化树显示ZjTCP20蛋白与玉米ZmTCP20亲缘关系最近。亚细胞定位结果显示其定位在叶绿体、细胞质和细胞核内。酵母双杂交试验发现,载体BD-TCP20 在SD/-Trp培养基上可正常生长,在SD/-Trp/X-a-Gal和SD/-Trp/X-a-Gal/AbA培养基上生长且形成蓝色菌斑,ZjTCP20可自激活。ZjTCP20表达模式分析显示,该基因在叶片中大量表达,且在幼嫩叶片中大量表达,随植物叶片发育该基因的表达量逐渐减少,但三种激素ABA,SA和MeJA不能诱导该基因显著性表达。

