高良姜素对青光眼大鼠视网膜神经节细胞的保护作用△
王海峰 向晓欢 杨周赟 李奕萍
以进行性视网膜神经节细胞(RGC)变性为特征的青光眼影响全球超过6000万人,并已成为不可逆性失明的主要原因[1]。目前,青光眼的治疗旨在降低眼压以延缓RGC的进行性死亡[2-3]。最近几项研究揭示了炎症反应会导致视网膜损伤,并证明了Toll样受体4/NOD样受体3(TLR4/NLRP3)炎症小体的激活参与了视网膜损伤的发展[4-7]。在眼部疾病的研究中,高良姜素能减轻糖尿病视网膜病变,其作用机制涉及了降低小胶质细胞激活、细胞外信号调节蛋白激酶1/2磷酸化、核因子-κB和早期生长反应蛋白的转录激活[8]。然而,高良姜素对青光眼视网膜损伤的保护作用的报道尚少,值得深入研究。
1 材料与方法
1.1 动物SPF级健康SD 大鼠52只(48只月龄为3个月,雌雄各半,体重200~250 g;4只4 d龄,雌雄各半,体重30~42 g),由重庆第三军医大学实验动物中心提供[合格证号:SCXK(渝)2017-0005]。本研究已获得四川中医药高等专科学校中医学院动物伦理委员会审核同意。
1.2 主要试剂与仪器动物麻醉呼吸机系统(美国MIDMARK公司)、Hamilton注射器(瑞士Hamilton公司)、TonoLab回弹式眼压计(芬兰Icare公司)、Olympus FluoView1000共聚焦显微镜(日本Olympus公司)、异氟醚(深圳市瑞沃德生命科技有限公司)、聚苯乙烯微珠(美国Invitrogen公司)、膜联蛋白异硫氰酸荧光素(FITC-V)/碘化丙啶(PI)凋亡检测试剂盒(美国Sigma-Aldrich公司)、高良姜素(上海陶托生物科技有限公司)。
1.3 动物模型建立及分组将48只SD大鼠随机分为对照组、对照+高良姜素组、高眼压组和高眼压+高良姜素组,每组12只(12眼)。各组处理方法如下:造模后第0 天和第14 天采用动物麻醉呼吸机系统吸入异氟醚麻醉大鼠,高眼压组和高眼压+高良姜素组大鼠在手术显微镜下将直径为10 μm、最终浓度为7.2×106个·mL-1的聚苯乙烯微珠注入大鼠右眼前房,诱导单侧眼压升高。对照组和对照+高良姜素组大鼠的眼睛相同部位注射等量的无菌生理盐水。注射的具体操作如下:首先用30号针头轻轻刺入角膜,然后使用Hamilton注射器通过预先形成的针孔将10 μL微珠溶液注入前房。注射后立即用棉签防止微珠流出眼睛。术后,在注射眼局部涂抹抗生素软膏以防止感染。造模后第15 天,对照+高良姜素组和高眼压+高良姜组大鼠接受高良姜素滴眼液治疗,每天1次,持续14 d。对照组和高眼压组大鼠则接受相同剂量二甲基亚砜(DMSO)溶剂滴眼。高良姜素滴眼液配制方法:将高良姜素溶解于DMSO中以获得25 g·L-1储备液,然后将该储备液进一步溶解在DMSO溶液中制备2 g·L-1眼用溶液。为了让高良姜素有效进入眼睛,将药物留在大鼠眼睛上5 min以上,并在1周内使用新鲜配制的高良姜素滴眼液。
1.4 眼压测量眼压的测量方法参照文献[9],通过吸入异氟醚麻醉SD大鼠,并在动物反射消失后使用TonoLab回弹式眼压计测量眼压。微珠注射前3 d测基线眼压,于造模后第3天、第7天、第14天、第18天、第22天、第26天、第28天监测大鼠眼压变化,眼压计通过内部软件自动生成并显示5次测量后的平均值,从每眼中获得5个眼压值,剔除最高值和最低值,并计算平均值以确定眼压。
1.5 HE染色和免疫荧光化学染色造模后第28天,每组取6只SD大鼠,将动物深度麻醉,取出眼球分离视网膜组织,固定脱水后包埋于石蜡块中。常规切片脱蜡后,各组取一部分视网膜切片,采用HE染色检测各组大鼠视网膜组织病理学变化。使用Image-Pro Plus 6.0测量视网膜厚度。
取另一部分视网膜组织脱蜡后,用10 mmol·L-1柠檬酸钠缓冲液(pH 6.0) 进行抗原修复。随后将其置于含1 g·L-1Triton X-100的PBS中室温封闭1 h。切片在4 ℃下与大鼠一抗Brn3a多克隆抗体稀释液(150)、兔抗TLR4多克隆抗体稀释液(150)、大鼠一抗GFAP多克隆抗体稀释液(1100)、兔抗NLRP3多克隆抗体稀释液(150)孵育过夜。将切片洗涤数次,与Alexa Fluor®488抗小鼠IgG (H + L)或Alexa Fluor®594抗山羊IgG (H + L)二抗稀释液(1200)在室温下于黑暗环境中放置1 h。PBS洗3次后,细胞核用DAPI染色。使用Olympus FluoView1000共聚焦显微镜获取图像。
1.6 细胞培养与分组根据文献[10]方法进行RGC分离。具体操作如下:取4 d龄的SD大鼠视网膜,并在4.5×103U·L-1木瓜蛋白酶溶液中水解。然后将细胞悬液依次与涂有兔抗巨噬细胞抗体和小鼠抗Thy1.1(CD90.1)抗体的培养皿一起孵育。收集RGC并将其接种到涂有小鼠层粘连蛋白和多聚赖氨酸的培养皿中。然后将RGC与200 μmol·L-1氯化钴(CoCl2)一起孵育48 h诱导缺氧和细胞凋亡[11];随后加入0 μmol·L-1、1 μmol·L-1、10 μmol·L-1、20 μmol·L-1、50 μmol·L-1或100 μmol·L-1高良姜素处理,优选最佳浓度另处理RGC细胞不同时间(24 h、48 h、72 h)。确定最佳高良姜素给药处理时间后,将细胞实验分为3组:空白组、光气组和光气+高良姜素组。光气组和光气+高良姜素组RGC与200 μmol·L-1CoCl2一起孵育48 h,然后光气+高良姜素组RGC中加入20 μmol·L-1高良姜素孵育48 h,收集各组细胞,采用流式细胞术和Western blot检测RGC的凋亡率及相关蛋白的相对表达情况,并采用ELISA法检测各组RGC中IL-18和IL-1β表达水平。
1.7 CCK-8检测RGC的增殖情况按1.6中方法处理的RGC接种到96孔板培养12 h,然后每孔加入10 μL CCK-8溶液,并将RGC在37 ℃下孵育4 h,然后用Synergy H1酶标仪在450 nm处测定各组细胞的光密度。
1.8 Western blot检测各组大鼠视网膜组织及RGC中相关蛋白的表达情况对照组、对照+高良姜素组、高眼压组和高眼压+高良姜素组中各取4只大鼠新鲜的视网膜组织,并收集各组大鼠RGC,分别在含磷酸酶抑制剂的RIPA缓冲液中裂解,并收集视网膜组织及RGC的总蛋白。使用BCA测定法测定其蛋白质浓度。将含蛋白质上清液(20 μg)的10 g·L-1凝胶于SDS-聚丙烯酰胺凝胶电泳进行分析,并通过湿法转膜将印迹转移到聚偏二氟乙烯膜(PVDF)上。然后将膜置于含50 g·L-1脱脂牛奶的TBST缓冲液中室温封闭1 h。随后将膜洗涤15 min,于4 ℃下与一抗稀释液孵育过夜。洗膜数次,将其与辣根过氧化物酶(HRP 12500)偶联的山羊抗小鼠二抗(抗兔或抗小鼠)于室温下孵育1 h。洗膜数次,采用ECL化学发光试剂盒于暗处曝光并显影,借助UVP成像系统捕获图像。各种一抗稀释比例如下:TLR4(11000)、GFAP(11000)、NLRP3(11000)、GAPDH(11000)。
1.9 流式细胞术分析采用FITC/PI凋亡检测试剂盒评估RGC细胞凋亡情况。将上述处理的细胞接种在24孔板中并培养48 h,待细胞融合度达80%时,胰蛋白酶消化离心收集细胞。然后将细胞用FITC-V和PI染色15 min,最后使用FACS细胞仪进行分析,以确定凋亡细胞百分比。
1.10 数据处理所有统计分析均使用Graph Prism 8.0软件进行,数据用均值±标准差表示,两组之间的比较采用Student’st检验,多组间比较采用单因素方差分析和Tukey检验。检验水准:α=0.05。
2 结果
2.1 高良姜素对大鼠眼压的影响造模后第3~28天,与对照组比较,高眼压组大鼠眼压均显著升高(均为P<0.001)。造模后第0~28天,对照组与对照+高良姜素组大鼠的眼压差异均无统计学意义(均为P>0.05)。造模后第3~28天,对照组与高眼压+高良姜素组大鼠眼压差异均有统计学意义(均为P<0.05)。造模后第18~28天,与高眼压组比较,高眼压+高良姜素组大鼠眼压均持续显著降低(均为P<0.05)(图1)。

图1 各组大鼠造模后第0~28天眼压变化情况 注:与对照组比较,***P<0.001;与高眼压组比较,#P<0.05,##P<0.01,###P<0.001。1 kPa=7.5 mmHg。
2.2 高良姜素对大鼠视网膜组织和RGC的保护作用HE染色结果显示,对照组大鼠视网膜组织无水肿、空泡。对照+高良姜素组大鼠的视网膜结构与对照组大鼠相似。与对照组比较,高眼压组大鼠右眼视网膜组织出现明显损伤,伴有视网膜水肿、空泡变性和核染色质浓缩。与高眼压组比较,高眼压+高良姜素组大鼠视网膜组织无空泡、水肿不明显,视网膜损伤显著减轻(图2)。
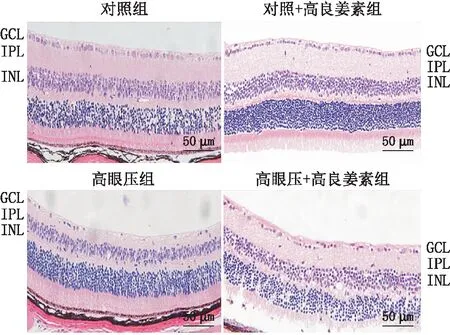
图2 各组大鼠视网膜HE染色 注:GCL为神经节细胞层,IPL为内丛状层,INL为内核层。
此外,对照组大鼠视网膜厚度[(113.55±17.27)μm]与对照+高良姜素组[(124.36±20.69)μm]相比差异无统计学意义(P>0.05)。与对照组比较,高眼压组大鼠视网膜厚度[(74.54±18.77)μm]显著减少(P<0.01)。与高眼压组比较,高眼压+高良姜素组大鼠视网膜厚度[(94.24±19.97)μm]显著增加(P<0.05)。与对照组比较,高眼压+高良姜素组大鼠视网膜厚度差异无统计学意义(P>0.05)。
免疫荧光化学染色结果显示,对照组大鼠RGC生存率[(97.39±8.11)%]与对照+高良姜素组[(94.07±10.22)%]相比差异无统计学意义(P>0.05)。与对照组比较,高眼压组大鼠RGC生存率[(46.89±8.71)%]显著减少(P<0.01)。与高眼压组比较,高眼压+高良姜素组大鼠RGC生存率[(78.53±10.26)%]显著增加(P<0.01)。与对照组比较,高眼压+高良姜素组大鼠RGC生存率差异无统计学意义(P>0.05)(图3)。
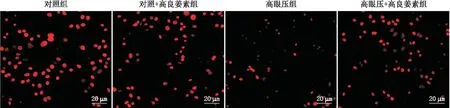
图3 各组大鼠视网膜组织免疫荧光化学染色 注:红色为RGC的细胞核。
2.3 高良姜素对TLR4/NLRP3炎症小体的影响对照组和对照组+高良姜素组大鼠的GFAP主要位于神经纤维层(NFL)。高眼压组中,呈现出星形胶质细胞增加并扩展到视网膜的其他层。高眼压+高良姜素组大鼠在高良姜素干预后可抑制这种扩展(图4)。Western blot检测结果显示,与对照组比较,高眼压组大鼠视网膜组织中TLR4、NLRP3蛋白表达均显著上调(均为P<0.001),高眼压+高良姜素组大鼠视网膜组织中TLR4、NLRP3蛋白表达均显著降低(均为P<0.001),对照+高良姜素组大鼠视网膜组织中TLR4、NLRP3蛋白表达差异均无统计学意义(均为P>0.05)。与高眼压组比较,高眼压+高良姜素组大鼠视网膜组织中TLR4、NLRP3蛋白表达均显著降低(均为P<0.01)(图5)。这与免疫荧光化学染色结果一致。

图4 各组大鼠视网膜组织中TLR4、NLRP3蛋白的表达情况 注:免疫荧光化学染色标记GFAP(红色)、NLRP3(红色)和TLR4(绿色),ONL为外核层。

图5 Western blot检测各组大鼠视网膜组织中GFAP、NLRP3和TLR4蛋白的表达 注:与对照组比较,***P<0.001;与高眼压组比较,##P<0.01,###P<0.001。
2.4 高良姜素对缺氧诱导的RGC细胞凋亡的影响本研究以20 μmol·L-1作为后续研究的最佳有效浓度,选择24 h作为最佳高良姜素给药时间。流式细胞术检测结果显示,光气组RGC凋亡率(28.33±3.56)%较空白组(5.24±1.17)%显著增加(P<0.001),而光气+高良姜素组RGC凋亡率(13.98±1.96)%较空白组显著增加(P<0.001);与光气组比较,光气+高良姜素组RGC凋亡率明显降低(P<0.001)。表明高良姜素处理显著减少了RGC凋亡的数量。
2.5 高良姜素对缺氧诱导的RGC的TLR4/NLRP3炎症小体的影响Western blot检测结果显示,与空白组RGC中IL-18、IL-1β[(25.13±1.35)ng·L-1、(27.55±1.77)ng·L-1]相比,光气组RGC中IL-18[(91.26±2.44)ng·L-1]和IL-1β[(67.54±2.87)ng·L-1]表达均显著增加(均为P<0.001)。与光气组比较,光气+高良姜素组RGC中IL-18[(43.57±1.62)ng·L-1]和IL-1β[(38.14±1.19)ng·L-1]表达均显著减少(均为P<0.001)。光气+高良姜素组与空白组RGC中IL-18、IL-1β表达差异均无统计学意义(均为P>0.05)。此外,光气组RGC中TLR4(3.23±0.43)、NLRP3(2.67±0.83)蛋白表达较空白组(0.96±0.07、1.05±0.09)均显著增加(均为P<0.001)。且光气+高良姜素组RGC中TLR4(1.27±0.12)、NLRP3(1.39±0.17)蛋白表达较光气组均显著减少(均为P<0.01),与空白组RGC中TLR4、NLRP3蛋白表达相比差异均无统计学意义(均为P>0.05)。
3 讨论
本研究选择局部给药作为高良姜素给药方式,结果显示,高良姜素不仅可以降低眼压,还可以保护RGC免受损伤。此外,这种治疗可以通过抑制TLR4/NLRP3炎症小体的激活抑制GFAP的活化,从而保护RGC免受损伤。这与Tanna等[12]研究报道的局部给药是降低眼压的最佳方法,并且其副作用极小的结果相似。
视神经炎症在青光眼中起着关键作用,特别是涉及炎症的关键驱动因素NLRP3炎症小体;视网膜高眼压损伤通过髓样分化因子88、TNF受体相关因子和核因子-κB诱导TLR4信号激活,这进一步导致NRLP3炎症小体的激活,并分泌IL-1β和IL-18,进而引发神经毒性炎症,导致轴突退化和RGC的死亡[13]。最近研究证实,TLR4/NF-κB通路抑制能有效降低急性青光眼中的NLRP1/NLRP3炎症小体激活和IL-1β、IL-18的分泌,从而减轻RGC死亡[14]。本研究结果表明,高良姜素对视网膜高眼压损伤的保护作用可能是通过抑制TLR4/NLRP3炎症小体激活介导的,为视网膜高眼压损伤的炎症反应提供了新的治疗策略,与上述文献报道的结论相似。
NLRP3诱导的神经炎症参与眼部疾病的发病机制。多项研究证实,NLRP3炎症小体导致RGC丢失[15-16]。有研究表明,与TLR4基因野生型小鼠比较,接受视神经横断的TLR4缺陷小鼠的RGC存活率更高[17],表明TLR4与RGC损伤存在密切联系。为进一步探索高良姜素潜在的神经保护机制,采用CoCl2在体外诱导缺氧并模拟青光眼微环境[18],结果发现,高良姜素逆转了CoCl2诱导RGC中TLR4、NLRP3蛋白表达增加和IL-18、IL-1β炎症因子分泌。这提示高良姜素可能通过抑制TLR4/NLRP3炎症小体激活减轻RGC损伤。本研究中RGC的凋亡数量在100 μmol·L-1高良姜素作用时显著减少,表明高良姜素在高浓度下具有毒性。这可能是由于当药物浓度过高时,介质渗透压升高,可能对RGC造成损害。
综上,高良姜素局部给药至眼睛可降低青光眼模型大鼠眼压并防止RGC死亡,其保护机制可能与抑制TLR4/NLRP3炎症小体激活有关。本研究结果可能为青光眼的治疗提供一种新的有效策略。

