基于高通量测序卷柏内生真菌多样性研究
张丽张武王长宝
(1.佳木斯大学理学院,黑龙江 佳木斯 154007;2.玉林师范学院生物与制药学院,广西 玉林 537000)
卷柏[1]为卷柏科卷柏属具有观赏价值与药用价值的蕨类植物,卷柏植物喜阳,在向阳的山坡岩石上或者岩石缝细中尤为常见,与宿主植物形成互惠共生体,存在于健康植物体的各类组织和器官内而不引起明显感染症状的真菌,几乎所有被研究的植物体内都含有内生真菌,具有分布广、种类多等特点。卷柏在民间也有长生不死草[2]、九死还魂草、万年青[3]等别称。卷柏有其特殊的生长习性,缺水干枯时看起来整个叶片会蜷缩起来,和一般的干草没有太大的区别,但是只要再次遇到水就能马上恢复状态,正是因为卷柏具有这些区别于其它植物的特性及顽强的生命力,成为观赏植物中最受人们喜爱的植物之一。在《本草纲目》中卷柏具有活血止血、消肿止痛等作用被列入药用植物中也有相应记载,同时卷柏在抗炎、抗肿瘤、抗氧化等方面的药理作用已被证实具有良好的临床效果[4,5]。内生真菌之间形成了一个正相关的关系网络,显示了卷柏内生真菌的多样性以及内生真菌的群落结构,也为后续的内生真菌的进一步开发提供了理论基础。在卷柏生长环境特殊且资源有限的背景下,科学开发和有效利用卷柏内生真菌资源将是当下卷柏资源研究的重点方向。卷柏内生真菌多样性不仅提供了大量用于可开发的微生物资源,且其代谢物也可用于筛选抗旱菌株,表明其具有巨大潜力和应用前景。这种长期宿主与内生真菌共生的情况不仅影响宿主植物的抗逆性,还会影响宿主植物的次生代谢产物,甚至会使内生真菌的次生代谢产物与宿主植物的次生代谢产物相似或者相同。
1 材料与方法
1.1 内生真菌作用
内生真菌在宿主植物的茎叶中生存并完成生命周期。这种真菌很少在未被认可的宿主植物中形成的细菌或真菌。容易感染植物组织的真菌存在于细胞和细胞之间,其与植物共存或不共存,生活在不会引起任何疾病迹象的健康植物中。内生真菌种类丰富,可能有超过100万种。内部真菌通常包括存在于各种植物组织中的内部细菌和真菌。目前,在植物中未发现内部真菌,内部真菌植物具有高度多样性。内部真菌物种的多样性已成为研究的焦点,尤其是促进内部真菌物种多样性的高序列技术。然而,除了内部真菌的多样性外,人们更多地关注内部真菌的生物学功能。从长远来看,在进化过程中,内部真菌与宿主形成共生关系,如促进植物生长、提高植物抗性和增强植物加工能力对于受污染的土壤和减轻盐应激。室内真菌已被证明能够产生技术性二次代谢物,包括酪蛋白、生物碱、芳香化合物和肽,以及各种抗原生物抗癌物质,广泛应用于农业、医学等领域。植物与植物之间许多形式的相互作用都具有重要的生态资源和经济资源。植物内生真菌[6,7]是指部分或者全部生活史中对植物不同组织或不同器官内外结构无明显毒害作用并在某种程度上有一定或密切或不密切的相互依存共生关系的一类微生物[7]群体,Perotti等于1926年在健康植物[6]组织的根部首次发现,为今后进一步研究植物内生真菌与植物组织器官的协同关系开辟了一条新的路径。
1.2 高通量测序技术
本研究基于Illumina MeSeq平台的高通量测序[8,9]技术(该技术也被称作二代测序技术)研究卷柏内生真菌的种类。为了实施人力资源项目并继续发展筛查技术,筛查技术提高了研究水平。与此同时,生物学中对性别和思维的理解正在提高到一个新的水平,而且在医学领域越来越广泛。如今,高分辨率分析平台已广泛用于产前检查、单个遗传病的检查或诊断、核治疗、药物测试。长期序列分析不仅是一种重要的化学工具,也是实现精确医学视觉的技术因素之一。长期监测技术和数据分析的进步提高了监测的准确性和可靠性,并降低了监测和数据分析成本。在生物病原体检测领域,序列分析技术将是一项必要的技术,并将发挥更重要的作用。高通量测序技术对要求测序量大的植物很友好,可以同时测量大量的DNA分子,其优势是读长较短,此高通量测序的标志性特征是通过读取大量的DNA片段来拼接完成的序列信息,在大量高速测序的同时与传统方法相比不仅保持了高度的准确性还极大地降低了测序的成本,效率提高了约150倍。高通量测序技术与传统培养技术、一代测序技术(Sanger Sequencing)相比具有更加丰富的定量功能,从而能更加全面、广泛地剖析卷柏内生真菌多样性。
1.3 内生真菌总DNA提取
采用少量DNA提取试剂盒对高通量测序样本进行卷柏内生真菌总DNA提取[10],具体步骤如下。
植物组织样本经无菌处理后,去除表面水分,使用无菌刀片取约250mg样本,切碎后与750μL裂解液同时放入管中,70Hz,研磨1min;拿出裂解管后在放入离心机,14000g离心1min;小心取出裂解管,吸取400μL上清液与其套在一个收集管里,8000g进行离心1min,丢弃过滤柱,向上一步的收集管中加入1200μL的DNA裂解液并充分混匀;将2号柱套在一个新的收集管中;从新试管中吸取重新组成的800μL混合液加到另一个管中,10000g进行离心1min,倒掉管中废液;从试管中留下部分进行质量检测,其余都放入-20℃的培养箱中进行培养。
1.4 DNA质量检测和PCR扩增
提取好的DNA样本,进行琼脂糖凝胶电泳检测。操作如下:配制1.5%琼脂糖凝胶;每个样本均取2μL的DNA溶液分别与2X Loading buffer混匀;将上一步的DNA-Loading buffer混合液上样到配制好的1.5%琼脂糖凝胶的胶孔内,140V,15min,进行电泳检测。为了后期试验的顺利进行并得到完整准确的数据,QIIME2软件的DADA2插件可以对数据进行进一步处理,并生成Feature表和代表序列是得到高质量的测序数据的关键。电泳条带清晰出现即为试验成功,PCR扩增技术,研究内生真菌基因ITS1区,引物信息为ITS1F-CTTGGTCATTTAGAGGAAGTAA和ITS2R-GCTGCGTTCTTCATCGATGCPCR产物的[9]纯化和混样,用琼脂糖凝胶电泳检测PCR扩增之后的产物,然后将PCR产物进行回收通过利用纯化的试剂盒,利用后使其能够将回收的DNA序列精确的等比例混合后进行上机测序。
1.5 材料采集及处理
1.5.1 样本准备(sample fragmentation)
样本材料于2020年6月采摘于黑龙江省佳木斯市四丰山,3株植株分为地上部分、地下部分3组对照组,选择健康长势比较好的卷柏植物进行采摘,采摘过程需要将植物的根部一并带出,并且在这个过程中要保证植物的完整性,进行处理前需要用清水冲洗干净,分别放置于不同的密封袋中,做好标记,以3种同种植物的不同植株作为对比,从而保证试验结论不是偶然性,而更具有普遍意义。采集回来的试验材料立即带入实验室进行消毒处理,先去除表面泥土自来水下冲洗干净,消毒步骤:无菌水漂洗1次,0.1%氯化汞30s,无菌水漂洗2次;0.1%次氯酸钠2min,无菌水漂洗2次;70%乙醇消毒2min,无菌滤纸吸干叶表面水分,以保证试验材料的消毒更加彻底。消毒试剂的选择以及消毒时间长短均是获得内生菌株种类多少的关键,如消毒时间不足会导致植物表生微生物混入,而消毒时间过久,又会导致部分可分离培养的内生菌株丢失。
1.5.2 文库构建(library preparation)
1.5.2.1 DNA片段化方法
化简得:所以(ax1+am+b)(ax2+am+b)=-1,a2x1x2+a(am+b)(x1+x2)+(am+b)2=-1,将x1x2,x1+x2代入得:所以直线即直线l经过定点
超声处理、化学处理或片段化酶处理使DNA片段化,目的是使DNA片段长度符合测序平台的读取要求。
1.5.2.2 末端修复方法
使用DNA聚合酶、Klenow酶等,延伸补平5’突出末端,切割3’突出末端,使用T4 PNK酶等,磷酸化5’突出末端。
1.5.2.3 A尾添加方法
使用Klenow酶等,对DNA片段3’末端添加A尾,目的是为后续接头连接做准备。
1.5.2.4 接头连接方法
使用DNA连接酶,进行TA克隆连接。因为连接接头的DNA片段,可与Flowcell结合,进行上机测序。
1.5.2.5 文库扩增意义
PCR循环与建库效率呈负相关。
1.5.2.6 纯化
有效去除其它杂质。
1.5.2.7 分选
有效用于测序文库构建。
1.5.3 数据分析(data analysis)
使用Trimmomatic v0.33软件,对测序得到的Raw Reads进行过滤;使用cutadapt 1.9.1软件进行引物序列的识别与去除,得到不包含引物序列的Clean Reads数据分析是高通量测序技术最重要的一个环节,在进行高通量测序完成后会得到大量的数据,然而这些数据的分析成为高通量测序技术的一个主流,测序数据分析的好论文才有价值,反之则为一堆废弃的数字;使用QIIME 2软件,对样品Alpha多样性指数进行评估;软件FUNGuild(Fungi Functional Guild)是可用于解析真菌OTUs的工具,基于该软件对样品进行生态功能分析;使用Usearch 软件对Reads在97.0%的相似度水平下进行聚类,获得OTUs。
2 结果与分析
2.1 测序数据与生物信息学分析
测序的原始数据因为存在某些干扰的相对无关数据,为保证测序信息结果的高质量,用QIIME2/trim_galore、flash2、mothur软件进行样本原始数据的质量把控从而去除adapter序列和引物等低质量非扩增区域的数据,使得到更加准确可靠的有效数据结果。在相似水平达到95%的OUT代表序列中进行操作分类单元,进而采用Metastats分析、ANOVA方差分析、Wilcoxon分析、Kruskal-Wallis分析、Indicator分析等分析优势物种物种多样性,采用多样性指数统计、多样性指数差异分析、Shannon-Wiener曲线、稀释曲线、Rank-Aundance曲线、物种积累曲线反应Alpha多样性,采用功能预测、功能组成柱状图、Wilcoxon分析、ANOVA分析、Kruskal-Wallis分析-Heatmap图进行整体功能预测分析。综上生物信息学统计分析,得到卷柏内生真菌群落结构组成。
2.2 内生真菌α多样性分析
α多样性可以反映内生真菌的丰度以及多样性情况,常用的度量指标有丰度指数和多样性指数[11],丰度指数包括chao1指数,多样性指数包括ACE指数、Shannon指数、Simpson指数,用于表示卷柏内生真菌丰富度的一个是Chao1指数,另一个是ACE指数,Simpson指数和Shannon指数用于表示卷柏内生真菌多样性,结果如图1所示,群落Chao1指数分析结果显示,地上部分>地下部分。群落ACE指数、Simpson指数、Shannon指数分析结果和上述结果相似,地上部分>地下部分。Simpson指数中群落多样性越低相反数值越大,两者呈现负相关;Chao1指数、Shannon指数和ACE指数则与均匀度、群落丰富度和多样性呈正相关,如图1所示可看出各样本文具的覆盖率均大于99.99%,覆盖率较高说明能够代表卷柏样本中内生真菌的真实信息。
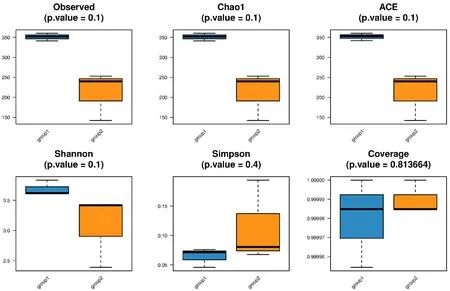
图1 卷柏内生真菌α多样性
2.3 内生真菌β多样性分析
在操作分类单元中(operational taxonomic units,OTU)对β多样性进行分析评估的方法常采用主成分分析法[11],比较不同组织,即卷柏地上部分与卷柏地下部分内生真菌群落结构组成,用主坐标分析(analysis and plot,PCOA)显示地上部分(group1)和地下部分(group2)的样本均能更好的聚合,说明内生真菌群落组成相似性较高,并且根据图2可更加直观显示不同部位内生真菌群落结构的差异性与整体相似性,在OTU水平上,PC1的解释度为66.296%,PC2的解释度为16.768%,PC3的解释度为8.479%。
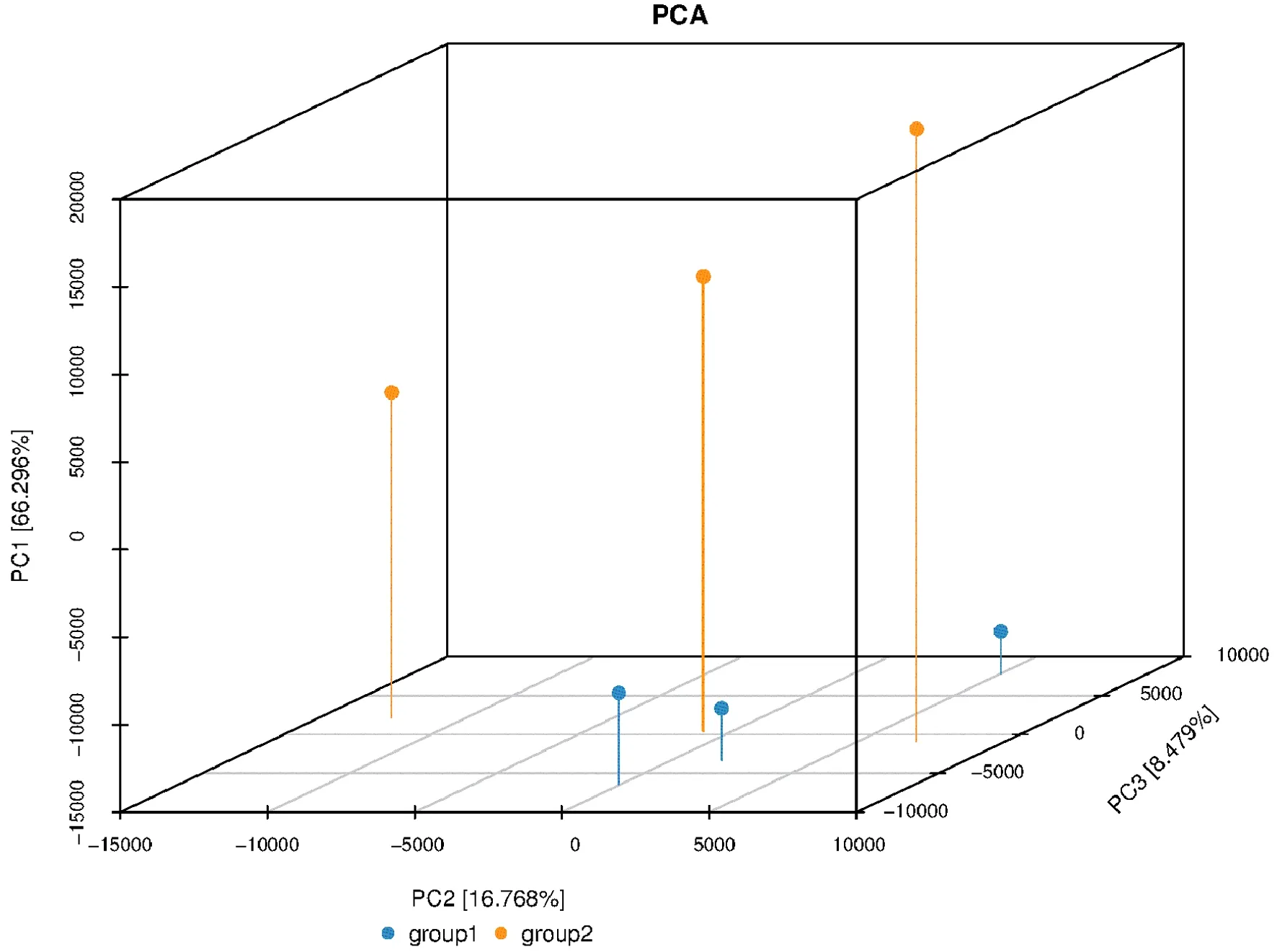
图2 卷柏内生真菌β多样性
2.4 不同部位内生真菌结构差异
在门水平上统计卷柏地上部分和地下部位内生真菌群落组成,地上部分和地下部分也存在相对独立性,卷柏地上部位(group1)的优势真菌占总群落的比例最大的是子囊菌门,卷柏地下部位(group2)的优势真菌占总群落最多的是担子菌门,对比地上部位和地下部位内生真菌多样性具有相对独立性,卷柏内生真菌对卷柏代谢产物的影响有待进一步探究。
3 结论与讨论
本研究首次采用高通量测序方法对卷柏内生真菌的多样性与群落结构展开分析,以97%的一致性进行OTUs聚类,尽管植物内生真菌与植物的健康影响有着密不可分的联系,但是不同种内生真菌对卷柏的确切影响还有待学者们进一步研究。本研究是利用高通量测序技术全面整体地分析了卷柏植物内生真菌的多样性,从chao1指数、Shannon指数、Simpson指数和ACE指数4个多样性指标变化可知,内生真菌与植物体的协同共生明显改变了卷柏植物内生真菌群落的多样性。
本论文从黑龙江省佳木斯市地区采集的卷柏中进行高通量测序,得到内生真菌在门的水平上分类。主要研究结论如下。
从门的分类学角度来看,卷柏内生真菌中主要分布于子囊菌门、担子菌门、罗兹菌门、球囊菌门、毛霉门、壶菌门、被孢霉门和一些目前没有被科学家分类和没有被识别记录的真菌;卷柏植物中的真菌主要存在于担子菌门和子囊菌门中。

