指向“变化观念”的元素化合物教学
张静,张文华




摘要: “变化观念”是高中化学学科核心素养的主要内容之一。从物质变化和能量转化两个维度分析苏教版三册教材中“变化观念”的层级进阶。以“硝酸”的教学为例,比较新旧教材的编写结构,构建指向“变化观念”的教学目标和内容,利用实验探究,合理地、阶段性地发展和培育学生的“变化观念”。
关键词: 新教材; 變化观念; 硝酸; 抛光液; 实验探究
文章编号: 1005-6629(2023)02-0049-06 中图分类号: G633.8 文献标识码: B
化学乃变化之学,通过化学变化创造物质是化学学科的核心及价值所在,故而“变化观念”成为高中化学学科核心素养的主要内容之一。2020年秋投入使用的苏教版高中化学教材(以下称“新教材”)在编排顺序、内容选择和呈现方式等方面做了较大的调整,如何整合新教材内容,合理培育“变化观念”是我们需要面对并要解决的问题之一。笔者以高中化学必修第二册专题7中的“硝酸”为例,探索指向“变化观念”的元素化合物教学,使元素化合物的学习成为发展学生“变化观念”的重要载体。
1 苏教版新教材关于“变化观念”内容的层级进阶
高中阶段“变化观念”的培育并非一蹴而就,而是循序渐进、螺旋上升的过程,具有认知的进阶性。“变化观念”贯穿于整个高中教材的各个主题中,主要分布于必修第一册、第二册和选择性必修《化学反应原理》之中。必修第一册从“物质及其变化”的维度培育“变化观念”:通过卤素、钠、镁、硫等元素及其化合物的相互转化,让学生体会可以借助不同的反应类型,通过改变反应条件,利用转化规律实现物质的改变与创造,从而更好地认识自然、保护自然。必修第二册专题6则从“变化观念”的另一个维度——“能量转化”,让学生知道化学能可与热能、电能等多种形式的能量相互转化,丰富学生对能量变化形式和途径的认识。至此,教材完成“变化观念”核心内容阶段性的介绍。在此基础上,高中化学选择性必修《化学反应原理》将进一步发展对化学反应的认识,从定量的角度深入地认识物质变化和能量转化规律,建构更加系统的“变化观念”。
总体来说,“变化观念”的进阶性表现以必修阶段元素及其化合物的性质和转化为基础,以选择性必修阶段的反应原理为提高,对化学反应的认识从宏观水平发展到微观水平,从定性分析发展到定量计算,从静态认识发展到动态拓展,从单一角度发展到多维度、多角度认识化学变化,形成比较系统的以物质变化和能量转化两个一级维度认识、调控化学反应的“变化观念”,从而凸显相应阶段的“变化观念”的内涵。
2 新旧教材中“硝酸”编排的比较及内容建构
新教材专题7“氮与社会可持续发展”是必修基础阶段和选修提高阶段的中间过渡部分,在发展和培育“变化观念”的进阶中有着特殊作用,所以相关的教学设计既要加强必修阶段对“变化观念”的认识,还要有意识地为选择性必修教学积累足够的事实性知识,以便更加深入地理解这些变化的本质。如何才能均衡两者之间的关系,笔者尝试作初步的分析。
2.1 新旧教材比较
与旧教材[1]相比,苏教版新教材[2]在编排上做了科学的调整和变化,对于“硝酸”这一节变化最大的是其体系结构上的调整。
旧教材“硝酸的性质”编排于化学必修1专题4“硫、氮和可持续发展”的第二单元——“生产生活中的含氮化合物”。新教材“硝酸”编排于必修第二册专题7“氮与社会可持续发展”的第二单元——“重要的含氮化工原料”。教材编排上的变化体现“硝酸”作为重要的基本化工原料在工农业生产、国防上的广泛应用,同时让学生认识到氮循环对生态系统调节的重要作用,树立社会可持续发展的意识。
“氮及其化合物”专题由原先的专题4调整至新教材专题5“微观结构与物质多样性”和专题6“化学反应与能量变化”之后,更有利于帮助学生多维度认识物质的性质及转化:可以从微观的角度解释化学变化,探寻物质变化的本质;同时还可以联系能量变化并利用“化学反应与能量变化”的理论知识为问题解决打开新思路。相比于旧教材单调的事实性知识的积累,新教材更注重利用理论知识指导元素化合物的学习,引导学生自我建构、培养自主学习的能力,有利于促进学生“变化观念”的进阶发展。
新教材专题7第二单元“重要的含氮化工原料”包含氨气和硝酸2种含氮化工原料。由氮气合成氨气,氨气的催化氧化又是工业上制备硝酸最关键的反应,所以“硝酸”一节内容一方面承接着由N2到NH3再到HNO3自然延伸的氮元素化合物的知识线,让学生认识利用化学方法和手段转化、使用氮元素化合物可造福人类、促进人类进步;另一方面HNO3是氮元素最高价态物质,其产物(氮氧化物)的无害化处理为下一单元提供了讨论主题,有利于学生用辩证的、发展的观点分析和解决问题。
学生在学习本节之前,已学习了浓硫酸的强氧化性、电离理论、离子反应、原子结构、元素周期表及氧化还原反应理论等内容,为“硝酸”的学习作了大量的铺垫;学生探究能力的提升也为本节课参与并设计实验提供了重要的保障。教材内容正是从实验入手,类比迁移硫酸,引导学生对硝酸的性质及变化作出解释和预测,探索含有同种元素不同价态物质之间的转化关系,多角度认识和巩固氧化还原反应的概念,突出核心概念的引领作用,使内容知识结构化,有效地促进素养的发展。
2.2 指向“变化观念”的“硝酸”教学内容的构建
根据上述新教材的调整,结合“学习进阶”的特点,指向“变化观念”的教学内容的构建思路如图1所示。
2.3 指向“变化观念”的“硝酸”教学目标分析
(1) 能够说出硝酸所具有的物理性质和化学性质。
(2) 能根据硝酸中N元素的化合价预测其氧化性,结合实验现象,能分析得出硝酸与铜、碳等反应的产物及硝酸分解的产物,并用化学方程式进行表征;能根据实验事实,说明硝酸的氧化性受到浓度、酸度、温度等多因素的影响。
(3) 能够自主设计验证硝酸钠氧化性的实验,从微观角度认识硝酸强氧化性的本质;知道可利用“原电池模型”证明钝化膜的存在,能从能量转化的角度理解铁在浓硝酸中钝化的过程,并能用氧化还原反应理论解释相关现象。
(4) 通过硝酸性质的学习,能与同学交流硝酸的应用,能够科学理性地评价硝酸,能從环保角度分析如何合理使用硝酸,初步建立“绿色化学”观念和可持续发展意识。
3 “硝酸”教学过程实录
3.1 创设情境,体会变化的价值
[创设情境]光亮、洁净的铜质零部件不仅美观而且性能优越。如何使铜制品拥有光鲜亮丽的表面?锈迹斑斑、凹凸不平的铜制品如何重新焕发光彩?这节课我们介绍一种化学抛光的方法。
[实验引入]把表面锈迹斑斑、凹凸不平的铜片放入试管内,加入抛光液,再用浸有氢氧化钠溶液的棉花团密封管口[3]。半分钟后取出铜片,两者形成鲜明对比[见图2(b)],用手机电子显微镜观察抛光前、后的铜片[见图2(a)(c)]。
[教师提问1]铜制品抛光液简介(见图3)。抛光液中的稀硫酸和硝酸各有什么作用?
铜制品加工过程中常常需要用抛光液浸泡,可以除去表面的氧化膜以及细微的凸起之处(有研究表明金属的凸起部分优先与溶液反应),形成平整、光亮的表面。抛光液的主要成分是稀硫酸、硝酸[4]。
抛光时必须严格控制浸泡的温度和时间。温度一般在室温到90℃之间[5];浸泡时间对抛光质量有重要影响。时间太短达不到抛光效果,时间过长,容易造成铜制品快速溶解而报废。
[学生回答]两者都是酸,均可与金属氧化物反应,去除氧化膜。稀硫酸不与铜反应,但资料中显示凸起的铜被反应掉,说明硝酸能与铜反应。
[教师追问]硝酸能与铜这样的不活泼金属反应,对比硫酸,请从氧化还原的角度分析硝酸可能具有的性质,并进行实验验证。
3.2 实验探究,认识HNO3变化规律
3.2.1 分组实验,探寻浓度因素
[分组实验](1)把装有Cu片的两支注射器分别插入装有浓HNO3和稀HNO3的输液瓶中。(2)用注射器分别从输液瓶中吸取2mL浓HNO3和稀HNO3。
[学生汇报展示]详见表1。
[教师提问2]抛光液为何不能长时间浸泡铜制品?
[学生回答]常温下浓、稀硝酸均与铜反应,若长时间浸泡,会损失铜。说明不管是稀硝酸还是浓硝酸,均为强氧化剂。且铜与浓硝酸反应更剧烈,所以浓硝酸氧化性比稀硝酸强;浓硝酸反应的产物是NO2,稀硝酸反应的产物是NO。
[教师概括]不同浓度的硝酸其还原产物不同,酸越稀,被还原的程度越大。
3.2.2 设计实验,归纳酸度条件
[学生展示]3Cu+8H++2NO-33Cu2++2NO↑+4H2O。
[教师追问]从定量关系看,参加反应的硝酸为8mol,仅2mol NO-3被3mol Cu还原为NO,这是什么原因?
[学生解释]8mol HNO3中只有2mol体现强氧化性,剩下6mol HNO3中N元素化合价未变化,体现酸性。
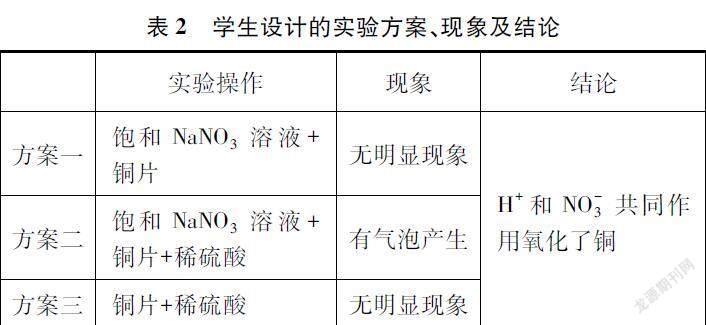
[教师概括]浓、稀硝酸的强氧化性均由NO-3中+5价的氮元素表现,NaNO3中的氮元素也是+5价,是否也具有强氧化性?请大家设计实验进行验证。
[交流讨论、汇报]如下表2。
[教师提问3]为什么抛光液中加入稀硫酸?
[学生回答]稀硫酸为NO-3提供酸性环境(H+),从而提高NO-3的利用率。
3.2.3 演示实验,利用原电池“看见”电子转移
[教师]不活泼金属铜能与硝酸反应,较活泼的铁与浓硝酸反应的情况如何?
[演示实验]把一段铁丝放入盛有浓硝酸的培养皿中,观察现象,重复几次。铁丝表面产生气泡、变黑,后无明显现象。
[教师提问4]如何用实验证明铁表面生成氧化膜?
[学生讨论、交流]可以将钝化后的铁与稀硫酸或者硫酸铜溶液反应。
[教师引导]还有其他方法吗?提示还可以从钝化的实质考虑。
[学生讨论]钝化的实质是发生氧化还原反应,氧化还原反应的实质是发生电子转移。
[教师追问]如何能“看到”电子的移动呢?
[学生回答](突然顿悟)使用原电池装置。
[教师鼓励]如何设计原电池?可能出现什么现象?
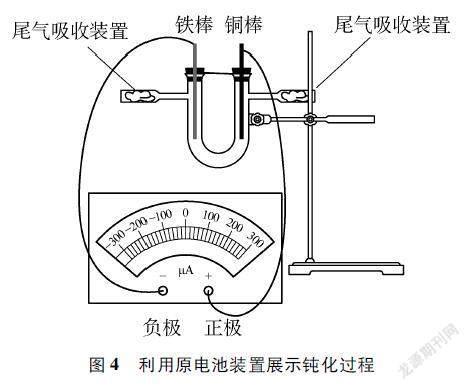
[学生交流后汇报]选择铁和铜作电极,浓硝酸作电解质溶液。铁钝化前和浓硝酸发生反应,所以开始铁失电子作负极,铜作正极;钝化膜形成后,内层的铁不与浓硝酸接触,此时铜和浓硝酸发生反应,所以铜作负极,铁作正极。
[演示实验]装置示意图见图4[6],为防硝酸挥发,用玻璃塞封住U形管管口;左边导线接铁棒,右边导线接铜棒,用鳄鱼夹连接在灵敏电流计上。发生偏转后,及时取出两电极,然后用滤纸擦掉铁棒表面的黑色物质,重复多次。
[学生描述]接通后指针向右(铜极)偏转,铁为负极,铜为正极;钝化后指针方向反转(向铁极偏转),铜为负极,铁为正极,因为钝化生成了氧化膜。
3.2.4 异常现象,揭示温度因素
[学生质疑]重复多次后,当指针向铁棒一极偏转,如果不把电极取出来,指针还能再转向右侧(铜极),这是什么原因?
[学生1]试管外壁热,我觉得可能是因为反应放热,温度高破坏钝化膜,使得内层铁继续和浓硝酸反应。
[学生2]我觉得也可能是经过多次反应后硝酸的浓度降低,破坏钝化膜,铁继续和硝酸反应,铁是负极,指针就转向铜。
[教师小结]同学们观察得非常仔细,能多角度地分析问题,大家对待科学的态度越来越严谨。在常(低)温下,浓硝酸能使铁钝化。除了铁,浓硝酸还能使金属铝钝化。所以工业上使用铁罐车或铝槽车来贮运浓硝酸。
[过渡]无论是浓度因素还是温度因素都影响钝化膜的生成。当浓硝酸与非金属如碳反应时,在加热条件下反应更剧烈,所以温度是影响硝酸强氧化性的因素之一。
[学生展示]C+4HNO3(浓)△4NO2↑+CO2↑+2H2O。
3.2.5 提取信息,体会化学思维
[教师提问5]抛光液使用时要严格控制温度,为什么温度不能过高?
[展示资料卡]百度百科——硝酸。
[学生]沸点为83℃,温度高硝酸挥发;另外硝酸不稳定,受热会发生分解。
[演示实验]用胶头滴管取一滴浓硝酸放于试管内,塞上浸有氢氧化钠溶液的棉花,用试管夹夹持在酒精灯上加热[7]。
[学生汇报并分析]有红棕色气体产生,说明生成NO2,N元素的化合价降低,O元素是-2价,可升高为0价,所以产物有O2,再根据元素守恒,产物有H2O。反应的化学方程式为:4HNO3△4NO2↑+O2↑+2H2O。
[教师]HNO3受热或见光能发生分解,在实验室硝酸必须保存在棕色试剂瓶中并置于阴凉处。市售浓HNO3常略带黄色,请大家解释原因?
[学生回答]浓硝酸略带黄色是因为分解产生的NO2溶于酸中,且浓度越大分解速率越快。
3.3 选择决策,感受变化应用
[教师提问5]根据所学硝酸的性质,谈谈这种混酸抛光液有何优缺点?并提出改善建议?
[学生1]优点:速度快、操作简便,用于形状不规则的铜制品。
缺点:产物有污染;HNO3分解而损耗;溶解过程损耗铜制品。
[学生2]可选择污染不大的物质代替硝酸,要有强氧化性,最好常温能和铜反应。我觉得可以用酸性高锰酸钾或者双氧水。
[教师评价]正如大家所讨论的,针对这种混酸抛光液的弊端,工业上研发了很多新型抛光剂,其成分就有同学们所提及的物质。学习化学大家都可以做出合理的决策了,真是前途无量!
[拓展视野]还有一种更加神奇、不可思议的电解抛光,金属材料通电就变得光亮。
[播放视频]电解抛光。
[教师概括]化学能可以转化为电能,电能也可以转化为化学能,利用电解可以获得普通化学方法难以企及的物质。这是利用化学反应创造新物质的重要方法。
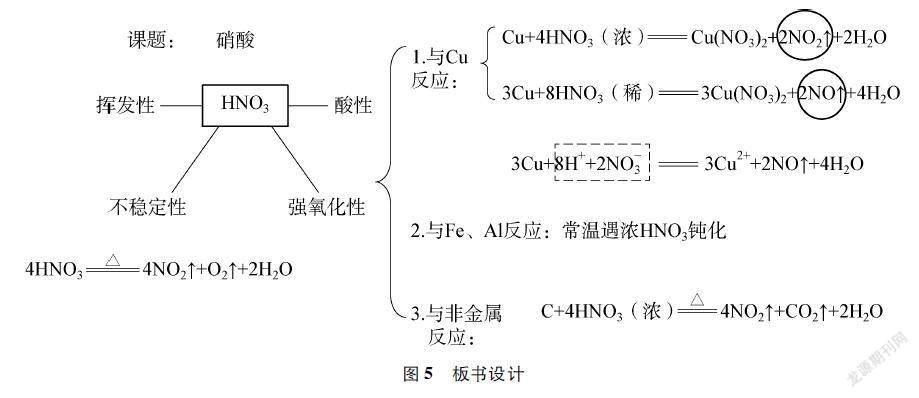
[教师]通过以上的分析,你对硝酸有哪些新的认识?
[师生归纳整理]形成板书(见图5)。
[教师总结]美好的化学创造美好的未来。所以我们要正确对待化学,合理使用化学物质,这样化学会让我们的生活更加美好!
4 教学效果与反思
本节课教学设计以“铜制品抛光液”为情境载体,创设真实问题情境,开展丰富的实验探究活动,促进学生全程积极参与,同时引导学生从物质变化和能量转化等多维度认识硝酸的变化;从浓度、温度、酸度等多角度全面而深入地认识硝酸的强氧化性,从而帮助学生构建阶段性的“变化观念”。整节课学生的学习热情很高,基本完成了预设目标。
纵观整节课,给学生留下印象最深的是利用“铁、铜、浓硝酸”组成的原电池证明钝化膜存在的实验。电流计指针出乎意料地一偏一转,让许多学生感到很神奇,在指针偏转中学习了硝酸的知识,明白了变化的乾坤。学生对此描述为“如同打开视频,直接看到动态画面一般清晰”。专题6学习的原电池知识,在这个实验中完美演绎,据此让学生深刻认识到了氧化还原反应与能量转化的关系,为学习《化学反应原理》中利用原电池原理验证物质氧化性强弱以及证明可逆反应等内容作了强有力的铺垫。因此,关联不同的知识模块,打通知识点之间的“隔膜”,可以丰富学生对“变化观念”的认识思路和维度。
本節课的不足之处是研究多停留在定性地认识化学变化上,后续的教学可尝试进行定量描述。如上述原电池实验中,可使用温度—电流传感器或pH—电流传感器,实现温度或pH变化与电流的曲线表征,用具体的数据和图形变化更有说服力地解决课堂实验的异常现象,同时也有助于培养学生数据处理和分析推理能力。
参考文献:
[1]王祖浩主编. 普通高中课程标准实验教科书·化学1[M]. 南京: 江苏凤凰教育出版社, 2014: 87~96, 100~101.
[2]王祖浩主编. 普通高中教科书·化学必修第二册[M]. 南京: 江苏凤凰教育出版社, 2020: 32~49.
[3]张静, 张文华. 促进知识素养化——以“硝酸的性质”为例[J]. 化学教育(中英文), 2021, 42(11): 27~33.
[4]腾讯视频. 北京杨岩: 2018全国优质课大赛说播课——硝酸的化学性质[EB/OL2019-04-11)[2022-7-12]. https://v.qq.com/x/page/j0859cxtt40.html.
[5]三酸抛光剂[EB/OL]. [2022-7-12]. http://www.kksshlhxbmcls3g.cpooo.com/news/5057966.html.
[6]诸佳丹, 丁伟. 原电池法探究金属铝在浓硝酸中的钝化行为[J]. 化学教学, 2017, (9): 59~62.
[7]房寿高. 硝酸受热分解实验的简易化改进[J]. 化学教学, 2015, (3): 51~53.

