褐藻胶多糖分子修饰酶的研究进展
李 丽,宁利敏,姚 忠,朱本伟*,徐 虹
(1.南京工业大学 食品与轻工学院,江苏 南京 210009;2.南京中医药大学 医学院·整合医学学院,江苏 南京 210023)
褐藻胶是一种由β-D-甘露糖醛酸(β-Dmannuronate,M)和α-L-古洛糖醛酸(α-Lguluronate,G)通过1→4 糖苷键连接的线性多聚体[1],根据其分子的长度、M/G 残基比率和分布以及乙酰化程度等,使其具有凝胶强度、水合能力、黏度和生物活性等特性,在食品、医药和化妆品等领域有着巨大的应用价值。褐藻胶的这些特性主要通过褐藻胶修饰酶对褐藻胶的合成和修饰过程进行控制,为了能够利用不同的褐藻胶修饰酶进行高效、安全和绿色地制备具有不同性质的褐藻胶分子,作者旨在介绍褐藻胶修饰酶合成和修饰褐藻胶的作用机理,总结目前几种褐藻胶修饰酶的来源、分类、结构、作用方式和研究进展,为将来更好地应用褐藻胶修饰酶和开发褐藻胶的商业价值提供参考。
1 简 介
褐藻胶根据残基的排列组合不同分成3 种片段:聚甘露糖醛酸(poly-mannuronate,poly-M)片段、聚古洛糖醛酸(poly-guluronate,poly-G)片段和甘露糖醛酸-古洛糖醛酸(poly-MG)杂合段。poly-M 和poly-G 的链式结构非常相似,单糖组分的区别仅仅是C5 上羟基位置的不同(见图1)[1]。
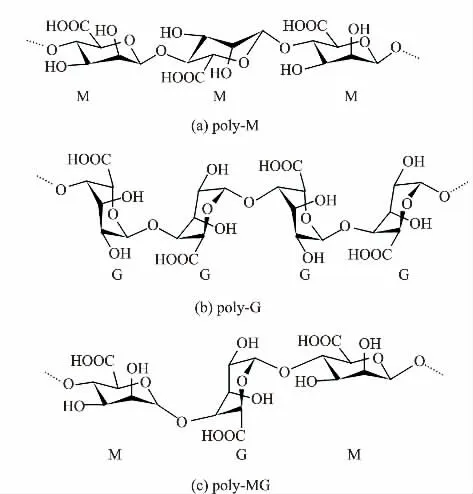
图1 不同结构褐藻胶的结构示意图Fig.1 Structural diagram of alginate with different structures
自然界中的褐藻胶主要是由褐藻、一些钙质红藻、假单胞菌属和固氮菌属的一些细菌产生的。目前的商业褐藻胶主要是从一些褐藻植物中提取,如泡叶藻(Ascophyllum)、公牛藻(Durvillaea)、昆 布(Ecklonia)、螺纹雷松藻(Lessonia trabeculata)、巨藻(Macrocystis)和马尾藻(Sargassum)等[2]。不同来源褐藻胶的组成和结构不同,例如螺纹雷松藻和极北海带(Laminaria hyperborea)中的褐藻胶古洛糖醛酸含量较高(M/G 残基比率<1),海洋巨藻(Durvillaea potatorum)中的褐藻胶古洛糖醛酸含量较低,而细菌中的褐藻胶还会发生乙酰化反应[3]。此外一些褐藻中的褐藻胶结构还受到季节、生长环境、年龄及不同部位的影响[4]。
褐藻胶开始由GDP-甘露糖醛酸合成,然后被甘露聚糖C5 差向异构酶、褐藻胶裂解酶、褐藻胶乙酰化酶和褐藻胶脱乙酰化酶在聚合物水平上进行修饰改性(如图2)。褐藻胶是以聚甘露糖的形式合成的(见图2 第一行分子);甘露糖醛酸残基(M)可以在O2 或O3 位置通过甘露糖乙酰化酶(A)乙酰化、甘露聚糖C5 差向异构酶(E)而异构化为古洛糖醛酸残基(G)或被褐藻胶裂解酶(L)降解产生不饱和的4-脱氧-L-赤式-6-4-烯吡喃糖醛酸酯残基(Δ);乙酰基可以通过褐藻胶脱乙酰酶(D)去除。
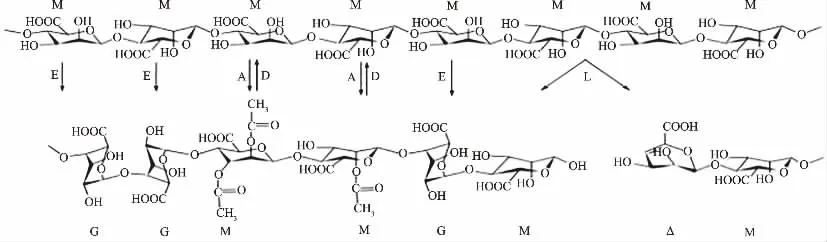
图2 褐藻胶修饰酶的作用示意图Fig.2 Schematic diagram of function of alginate-modifying enzymes
铜绿假单胞菌中合成褐藻胶所需的12 种蛋白质 由AlgD 操纵子编码(AlgD、Alg8、Alg44、AlgK、AlgE、AlgG、AlgX、AlgL、AlgI、AlgJ、AlgF、AlgA),而另一种蛋白质AlgC 则在其他地方进行编码[5]。褐藻胶合成复合体的模型如图3 所示。首先,细胞质蛋白质AlgA、AlgC 和AlgD 通过一系列反应将D-果糖-6-磷酸转化为GDP-甘露糖醛酸,这是合成褐藻胶的活化前体[6]。其次,GDP-甘露糖醛酸通过聚合成聚甘露糖醛酸链,部分Alg44[7]也参与了这个过程。Alg8 具有多个跨膜结构域和一个细胞质糖基转移酶结构域,而Alg44 具有单个跨膜结构域,能将细胞质c-di-GMP 结合的PilZ 结构域与一个C 端周质结构域分开[8-9]。然后,在聚合时新生的聚甘露糖醛酸链被由AlgG、AlgL、AlgK、AlgX 和AlgE 组成的周质支架在周围进行置换[9]。并且在周质中新生褐藻胶链的甘露糖醛酸残基可以通过AlgI、AlgJ 和AlgF 的作用选择性地在O2/O3 位置进行O-乙酰化[5]。周质支架中的AlgG 是一个差向异构酶,能够将β-D-甘露糖醛酸转化为α-L-古洛糖醛酸[10]。AlgL是一种双功能周质蛋白质,不仅具有裂解褐藻胶的功能[11],同时作为修复系统存在于周质中,以清除这些合成异常的褐藻胶分子[12],保证周质支架的功能完整性。AlgK 位于周质中,通过脂质部分附着在外膜上,是一个广泛参与蛋白质相互作用的结构域[13]。蛋白质AlgX 也在周质中与AlgK 和MucD 相互作用参与褐藻胶生物合成的翻译后调节。AlgE 在外膜中形成一个β 桶孔,合成的褐藻胶最后通过AlgE从细胞中分泌出来[6]。
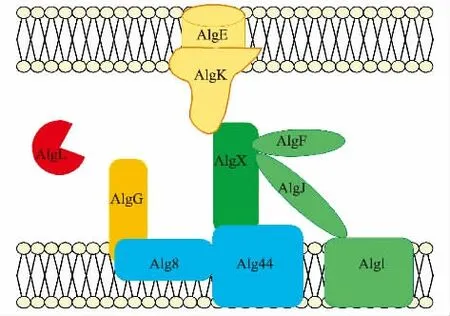
图3 铜绿假单胞菌褐藻胶合成复合体模型[14]Fig.3 Alginate synthesis complex model of Pseudomonas aeruginosa[14]
此外如果产生褐藻胶的复合体不能正常工作的话,周质中的聚阴离子褐藻胶会吸引阳离子,从而产生渗透胁迫导致细胞溶解。
一般来讲,经过修饰后的褐藻胶存在结构上的差异主要涉及以下几点:
1)褐藻胶分子中M 残基和G 残基之间的比例和分布模式发生变化 如图2 所示,先合成的部分甘露糖醛酸残基(M 残基)通过甘露聚糖C5 差向异构酶被异构化为古洛糖醛酸残基(G 残基),从而产生3 种褐藻胶多糖分子片段(poly-G、poly-M、poly-MG)。而poly-G 和poly-MG 的长度和数量影响着聚合物的几个重要的物理特性,比如溶液的黏度及凝胶的稳定性、渗透性和水解性[14]。通常G 残基含量比较少的聚合物不能形成阳离子凝胶,但是可以形成酸性凝胶。富含M 残基的褐藻胶表现出免疫刺激性,而poly-G 则不具有免疫刺激性,即褐藻胶中M 和G 的相对含量直接关系到免疫活性强弱,且分子结构中各个聚合体的连接方式和连接顺序对免疫活性也有直接的影响[15]。
2)不同生物体产生的褐藻胶多糖分子有不同程度的乙酰化修饰 细菌中产生的褐藻胶通常会在β-D-甘露糖醛酸的O2/O3 位置上选择性地发生乙酰化修饰[16],而在海藻中产生的褐藻胶没有这种变化。乙酰基能抑制聚合物与阳离子相互作用,因此褐藻胶的乙酰化可能会提高褐藻胶的黏度,降低其水溶性,从而增强褐藻胶形成凝胶的能力。去除O-乙酰残基则会导致多糖与二价阳离子结合能力增强,多糖溶解度提高。另外,乙酰化的褐藻胶还可能与透明质酸类似,具有保留水和营养物质的能力[17]。
3)即使来源相同的褐藻胶其聚合度也有不同[12]在生物体合成褐藻胶的过程中,可能由于物理或者褐藻胶裂解酶的作用使褐藻胶多糖降解为褐藻胶寡糖,从而改变聚合物的聚合度。聚合度也会影响褐藻胶的黏度和凝胶强度,可以通过SEC-Malls 等方法测定[18]。
褐藻胶结构的多样性影响了褐藻胶多糖的物理化学性质并使其在不同行业中有广泛的应用前景。
在食品行业中,褐藻胶可以作为食品添加剂起到稳定、增稠和乳化等作用[19]。同时褐藻胶作为一种可食用纤维对预防结肠癌、心血管疾病、肥胖症、体内重金属的积累具有辅助治疗的功效[20]。
在生物医学材料的应用方面,褐藻胶作为支架材料其柔韧性可以完全弥补组织缺陷,并且光滑的表面可以避免对损伤部位的二次伤害[21]。Li 等使用褐藻胶和阿拉伯树胶与钙离子介导,通过交联设计获得了最佳黏性水凝胶支架,用于介导和加速一种细胞膜修复中的重要蛋白质MG53 的释放,以改善伤口的再上皮化过程和持续释放用于治疗慢性伤口[22]。褐藻胶还是制药工业中常见的赋形剂。有研究者在西咪替丁固定组合片剂中添加褐藻胶用于改善食管反流[23]。
在医药领域中,褐藻胶具有抗过敏、调节免疫、抗氧化和抗炎等生物活性,能够激活人单核细胞产生在抗肿瘤、抗菌、抗病毒中发挥重要作用的免疫因子[24],故可用于治疗外伤、修复皮肤损伤,具有良好的止血作用、可靠的治疗效果和较低感染率等特性。Jiang 等证明褐藻胶寡糖显示出有效地抗氧化活性和抗凋亡活性[25]。
2 褐藻胶裂解酶
褐藻胶裂解酶能够将褐藻胶多糖降解为具有更高生物活性的褐藻胶寡糖[26]。此外褐藻胶裂解酶还可以用于褐藻资源的生物炼制[27]及褐藻胶多糖精细结构的表征[28]等方面。因此挖掘表征具有不同特性的褐藻胶裂解酶,对褐藻资源的利用具有十分重要的意义。
2.1 褐藻胶裂解酶的来源
在自然界中,褐藻胶裂解酶由许多利用褐藻胶作为碳源的细菌、动植物和病毒产生,目前细菌来源的褐藻胶裂解酶研究最为广泛,已报道的产褐藻胶裂解酶的微生物主要包括弧菌、假单胞菌、黄杆菌、固氮菌、交替假单胞杆菌、鞘氨醇单胞菌以及克雷伯氏菌等[29]。其次,来源于病毒、真菌以及动植物的褐藻胶裂解酶也有一定的报道,Suda 等于1999年在小球藻病毒中也发现了褐藻胶裂解酶的基因[30]。Inoue 等首次在褐藻植物中提取出了一种褐藻胶裂解酶,进一步拓宽了褐藻胶裂解酶的来源[31],近年来不断有人从盐藻、红藻和海带等海洋藻类中分离出褐藻胶裂解酶[32-33]。在海洋软体动物和棘皮动物体内也可以分离出褐藻胶裂解酶,如黑斑海兔(Aplysia kurodai)[34]、皱纹盘 鲍(Haliotis discushannai)和短滨螺(Littorina brevicula)等[35-36]。
2.2 褐藻胶裂解酶的分类
目前,褐藻胶裂解酶的分类方式主要有3 种:
1)根据氨基酸序列相似性多糖裂解酶被分成不同的家族,在CAZy 数据库中,褐藻胶裂解酶可归属 到14 个多糖 裂解酶家族(PL):PL5、PL6、PL7、PL8、PL14、PL15、PL17、PL18、PL31、PL32、PL34、PL36、PL39 和PL41 家族[31],还有一些并不属于以上家族的新型褐藻胶裂解酶,如Paenibacillus sp.LJ-23 中的Algpt[37]。其中来自细菌的褐藻胶裂解酶大多数属于PL5、PL6、PL7、PL15 和PL17 家族,而来自真核细胞和病毒中的褐藻胶裂解酶主要属于PL14 家族,不同的家族其在结构上有明显的差异。
2)如图1 所示,褐藻胶分子中存在4 种不同的化学键:M—M、G—G、M—G、G—M,大多数裂解酶对不同的化学键表现出不同的反应速率,根据对不同糖苷键的底物特异性,褐藻胶裂解酶可以分为:专一裂解聚甘露糖醛酸的裂解酶(EC4.2.2.3)、专一裂解聚古洛糖醛酸的裂解酶(EC4.2.2.11)以及对poly-M 和poly-G 均表现出高活性,可以更有效地降解褐藻胶的双功能裂解酶(EC4.2.2.-)[38],并且不是所有的褐藻胶裂解酶都能裂解乙酰化的褐藻胶[39]。来自软体动物的褐藻胶裂解酶和来自几种海洋细菌的褐藻胶裂解酶多具有poly-M 底物特异性,那些发现于细菌培养液的胞外酶则大部分具有poly-G底物特异性。值得注意的是,某些poly-M 裂解酶/poly-G 裂解酶并不是只对poly-M/poly-G 有活性,也可以裂解poly-G/poly-M 和poly-MG,只是活性较低。双功能裂解酶多集中在PL7、PL15 和PL17 家族中,许多双功能裂解酶对不同的糖苷键活性不同,例如来自Persicobacter sp.CCB-QB2 的双功能裂解酶AlyQ 对poly-G 和poly-M 的活性仅是对褐藻胶活性的60.7%和29.0%,表明AlyQ 更偏好裂解GM 或MG 之间的糖苷键[40]。而来自Wenyingzhuangia fucanilytica 的双功能裂解酶Aly7B_Wf 对poly-M和poly-G 的活性分别为(27.03±1.69)U/mg 和(21.48±1.10)U/mg,表明该酶的首选底物为poly-M[41]。另外来自Sphingomonas sp.ZH0 的ZH0-I 对poly-G的活性则是对褐藻胶和poly-M 活性的120%[42]。
3)从作用模式来看,褐藻胶裂解酶可以分为3类:(1)内切型褐藻胶裂解酶,目前报道的大多数的裂解酶均具有内切酶活性,这些酶在褐藻胶内部随机切割糖链上的1→4 糖苷键,并产生不同聚合度(Dps)的不饱和褐藻胶寡糖[43];(2)外切型褐藻胶裂解酶,一些外切酶可以从多糖的末端切除单体或二聚体寡糖产生不饱和单糖,然后通过非酶反应转化成DEH(4-deoxy-l-erythro-5-hexoseulose uronate),如来自Zobellia galactanivorans DsijT 的AlyA3[44],目前报道的大多数外切酶属于PL7、PL15 和PL17 家族;(3)内切和外切型褐藻胶裂解酶,有一些裂解酶同时具有内切和外切两种活性,例如Huang 等分离纯化出的Alg17B 裂解酶对褐藻胶表现出内切和外切两种活性,产生单糖和低相对分子质量寡聚糖[45]。目前只有PL6、PL7 和PL17 家族有过这种类型裂解酶的报道[38,46-49]。表1 中列举了已经表征的各个家族的典型褐藻胶裂解酶。

表1 典型的褐藻胶裂解酶Table 1 Typical alginate lyase
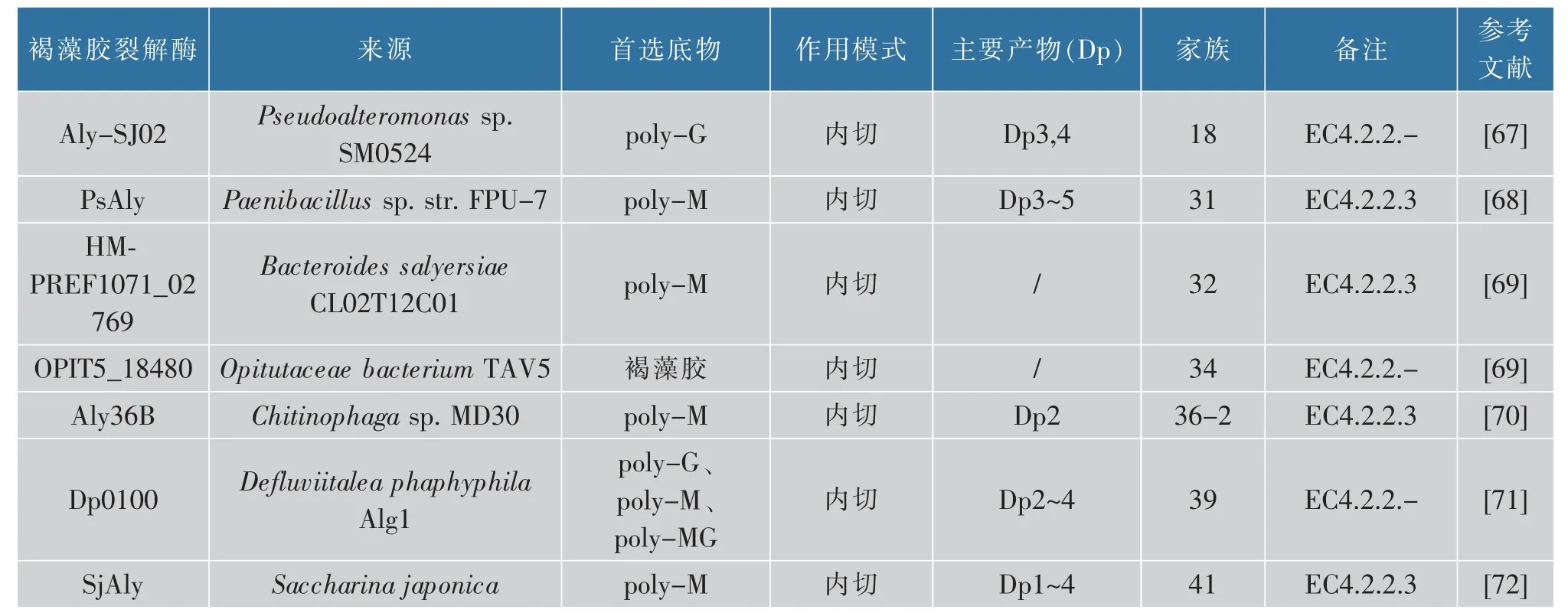
续表1
2.3 褐藻胶裂解酶的结构
作者所在课题组在褐藻胶裂解酶研究方面发表了多篇综述,详述了褐藻胶裂解酶的结构并阐释了其与底物特异性之间的关系[29,73-74]。褐藻胶裂解酶的结构可以分成4 种类型[39]:
1)β-胶冻卷结构 这是褐藻胶裂解酶中最常见也是研究得最透彻的一种结构,PL7、PL14、PL18、PL36 家族的褐藻胶裂解酶多采用这种结构(见图4)[75]。该结构可分为两个相互连接的弧形反平行β 片:内凹片(SA)和外凹片(SB)。它们在中间进一步弯曲,形成近90°的球状。内凹的薄片形成一个含有催化部位的裂隙并结合底物,在催化反应中起着不可或缺的作用。
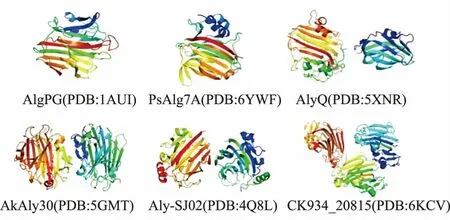
图4 β-胶冻卷结构示意图Fig.4 Schematic representation of β-jelly roll structure
2)β-螺旋结构 PL6 和PL31 家族的褐藻胶裂解酶多采用这种结构(见图5),它由3 个β-折叠和3 个转角(T)组成[76]。转角(T)分别位于两个β-折叠之间,一起形成了一个完整的β-螺旋(PB1-T1-PB2-T2-PB3-T3)。利用X 射线衍射仪等结构生物学技术对几种具有β-螺旋结构的褐藻胶裂解酶进行了研究。褐藻胶裂解酶BcelPL6 在溶液中是一种单体,它由两个结构域组成,N 末端结构域(NTD)和C 末端结构域(CTD)都采用右手平行的β-螺旋折叠。多肽的C 端(残基432~468)为两个平行于β-折叠PB3 平面的3 圈α-螺旋。β-螺旋的N 端部分在PB1 平面上有一个α-螺旋,C 端部分有一个α-螺旋和一个几乎垂直于PB3 的β 链。生化分析表明,底物结合亲和力主要由NTD 贡献,而BcelPL6 的CTD 参与将底物固定到合适的构象。然而,CTD 具有较弱的褐藻胶裂解酶活性,可与PL6 结构域协同起到更有效的催化作用。此外,CTD 参与形成一个封闭的催化口袋,它的缺失使BcelPL6 对高度聚合底物的活性增加[77-78]。
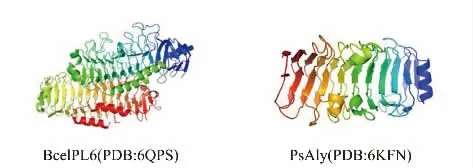
图5 β-螺旋结构示意图Fig.5 Schematic representation of β-helix structure
3)(α/α)n桶状结构 PL5 家族褐藻胶裂解酶多采用这种结构(见图6)。这种三维结构是由几个反平行的α-螺旋构成的桶状结构,从其顶部看螺旋环是逆时针方向的。例如,来自PL5 的A1-III 的活性中心由12 个α-螺旋形成,这些螺旋形成一个具有深隧道状裂隙的α6/α5桶折叠。在这种模式下,底物穿透到隧道状裂隙中,并进一步与催化位置相互作用[52]。
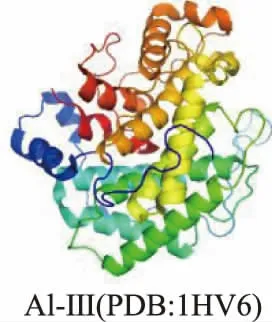
图6 (α/α)n 桶状结构示意图Fig.6 Schematic representation of(α/α)n barrel structure
4)(α/α)n桶+反平行β-折叠结构的组合结构PL15、PL17 以及PL39 家族褐藻胶裂解酶多采用这种结构(见图7)。PL15 家族中的Atu3025 被鉴定为该结构,其次还有一个口袋状结构,口袋由两个结构决定因素构成,即中心结构域和C 端结构域之间界面的构象变化和短α-螺旋H3 的存在,合理推测口袋状结构是PL15 家族褐藻胶外切裂解酶的特征,对于释放不饱和单糖作为唯一产物并识别底物非还原末端的外切模式至关重要[79]。PL39 中的Dp0100 褐藻胶裂解酶整体由3 个结构域组成,N 端结构域主要是螺旋结构,由不完整的(α/α)6环形成。中心结构域由16 条反平行的β 链排列在两个β-折叠中,并带有扭曲的α-螺旋。C 端结构域由两个反平行β-折叠组成,形成一个典型的由16 条β 链组成的β-三明治。中心结构域的一面紧贴C 端结构域,形成一个4 层β-折叠层,另一面紧贴N 端结构域[80]。

图7 (α/α)n 桶+反平行β-折叠结构结构示意图Fig.7 Schematic representation of(α/α)n barrel +antiparallel β-fold structure
而PL8、PL32、PL34 以及PL41 家族褐藻胶裂解酶的结构尚未得到解析。
2.4 褐藻胶裂解酶的作用机制
褐藻胶裂解酶通过β-消除反应裂解褐藻胶,在C4~C5 位形成不饱和双键,并在新的非还原末端存在一个4-脱氧-L-赤式-6-4-烯吡喃糖醛酸酯残基,这个双键在235 nm 处有吸光度,可以用来定量测定褐藻胶裂解酶的活性[81]。
Gacesa 提出整个β-消除反应通过三步反应去完成[82]:首先,带正电的氨基酸残基或者金属离子中和C5 位羧基上的负电荷从而降低H-5 质子的pKa;其次,催化碱从C5 位提取一个质子从而形成烯醇中间体,羧基上的电子转移裂解4-O-糖苷键,导致在C4~C5 位形成双键并最终使得糖苷键的断裂;最后,在糖苷键断裂的同时产生了含有4-脱氧-L-赤式-6-4-烯吡喃糖醛酸酯残基作为不饱和非还原末端的寡糖。该反应过程中需要催化碱去提取质子,并且需要催化酸去提供质子。当C5 位提取质子的方向与C4 位桥接氧在糖醛酸环的方向在同侧时为顺式消除(从M 残基处进行消除),当两者方向相反时为反式消除(从G 残基处进行消除)。
根据催化位点以及中和底物负电荷的方式不同可将绝大多数褐藻裂解酶的消除反应分为六大类:
1)金属离子辅助催化 PL6 家族使用钙离子去中和C5 位羧基上的负电荷,然后Lys 充当催化碱从C5 位提取一个质子,Tyr 充当催化酸提供一个质子[83]。
2)His/Tyr 型β-消除 PL7 和PL15 家族中的褐藻胶裂解酶采用Tyr 以及His 分别充当催化酸和催化碱[84-85]。
3)Tyr/Tyr 型β-消除 在催化过程中,两个Tyr分别充当催化酸和催化碱,例如PL17 家族中的Alg17c,该酶分别采用Tyr450 残基充当催化碱和Tyr258 作为催化酸[86]。
4)Tyr/Tyr 型β-消除 PL5、PL14 和PL18 家族中的褐藻胶裂解酶在催化过程中,同一个Tyr 既充当催化酸又充当催化碱[87-89]。
5)水催化型β-消除 在催化过程中水分子用于中和羧基上的负电荷,Arg 以及Lys 分别充当催化酸和催化碱。
6)Lys/Lys 型β-消除 在催化过程中同一个Lys 既充当催化酸又充当催化碱,例如PL36 家族中的Aly36B 在催化过程中Arg169、Tyr185 和Tyr187负责中和底物的负电荷,Lys143 既充当催化酸又充当催化碱[70]。
2.5 褐藻胶裂解酶的酶学特性
目前针对褐藻胶裂解酶酶学特性的研究报道较少,而某些酶学性质如嗜热、嗜冷、温度稳定性、pH 稳定性和盐活化等的研究有利于酶适应生存环境和应用于工业化生产。因此,作者对已报道的典型褐藻胶裂解酶的酶学性质进行了整理。
热稳定性是褐藻胶裂解酶应用中最重要的性质之一,在褐藻胶裂解酶催化过程中,由于热稳定性的存在,催化反应可以在更高的温度下进行,反应混合物黏度的降低和酶活性的提高从而促进底物的转化[90]。当催化海带粉等粗基质发生转化时,高工艺温度(高于45 ℃)还可以防止微生物污染。因此具有良好热稳定性的褐藻胶裂解酶对于褐藻胶低聚糖的酶促生产有重要价值。目前已知的大多数褐藻胶裂解酶不具有热稳定性,只在30~40 ℃表现出最佳催化活性[91],而关于具有热稳定性的褐藻胶裂解酶报道较少,表2 中列举了目前报道的一些热稳定性良好的褐藻胶裂解酶。
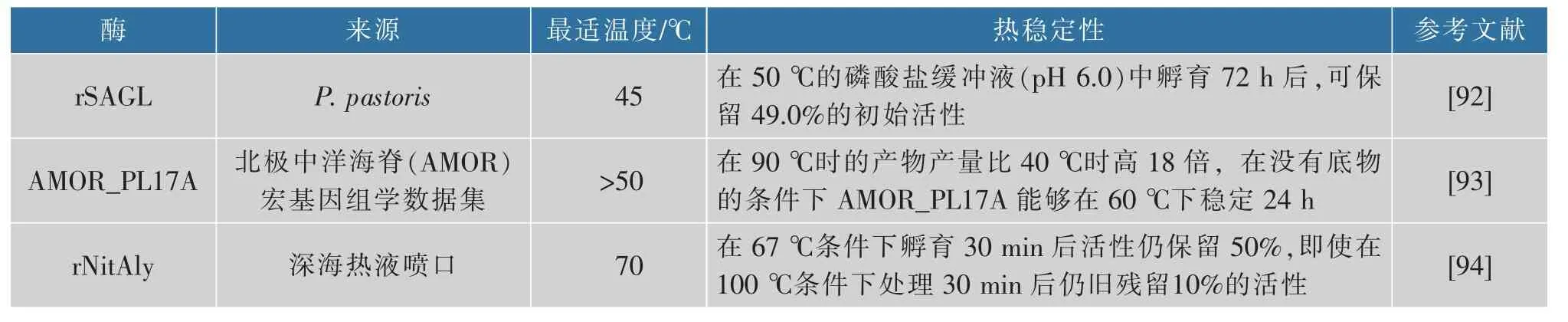
表2 典型的热稳定性褐藻胶裂解酶Table 2 Typical thermostable alginate lyase
到目前为止有关褐藻胶裂解酶耐热机制的相关研究还较少,根据已有报道,rNitAly 的热稳定性与Cys80 和Cys232 之间形成的二硫键有关[94]。来自Cobetia sp.NAP1 的AlgC-PL7 的热稳定性可能与α-螺旋有关[95]。Yang 等对AlyM 进行保守结构域重建,去除F5_F8_type_C 结构域后,在45 ℃下孵育1 h 的热稳定性由保留30%~40%的酶活力提升到了保留大约70%的酶活力[96],经截断后的突变体具有比全酶更紧凑的结构,能更好地抵抗热变性的影响,证明酶的热稳定性也可能与酶的结构紧凑程度有关。
在低温条件下进行酶促反应可以减少能耗、降低微生物污染的风险和终止催化反应的难度,一般的耐冷性褐藻胶裂解酶在低于35 ℃时具有最高的催化活性,并通常在20 ℃时保留最高活性的50%[57]。表3 中列举了3 种具有良好低温稳定性的褐藻胶裂解酶。
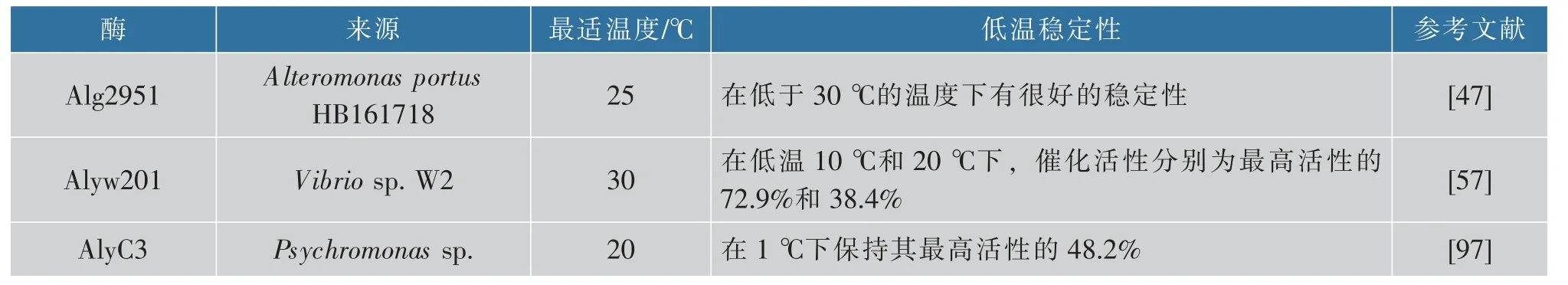
表3 典型的耐冷褐藻胶裂解酶Table 3 Typical cold-adapted alginate lyase
对于大多数褐藻胶裂解酶来说,催化的最适pH 接近中性,并且只在狭窄的pH 范围内表现出较高活性,也有一些酶在狭窄的pH 碱性条件下表现出最高活性。只有少数酶在较宽的pH 范围内表现出较高活性。例如来自Vibrio sp.NJ-04 的AlgNJ-04裂解酶在pH 4.0~10.0 的宽pH 范围内保留了超过80%的活性,表现出优异的pH 稳定性[98]。而Alyw201 在pH 5.0~10.0 孵育12h后仍保留超过70%的活性。特别是在检测到的整个pH范围(pH 3.0~11.0)中,孵育12 h 后仍保留超过40%的活性[57]。另外,来自Pseudoalteromonas carrageenovora ASY5 的Alg823[99]、Vibrio sp.SY01 的Aly08[100]、Serratia marcescens NJ-07 的AlgNJ-07[101]、Paenibacillus sp.LJ-23 的Algpt[37]等均具有良好的pH 稳定性。
从海洋环境中分离出的褐藻胶裂解酶通常还具有盐活化这一特性,即在一定浓度的氯化钠溶液中,褐藻胶裂解酶的活性增加数倍,反映了它们对海水环境的适应能力。如在1 mol/L NaCl 条件下,AlgM4 的活性 增加了 约7 倍[102];AlyPM 其活性 在0.5~1.2 mol/L NaCl 条件下可以增加6 倍[103];而对于来自Vibrio sp.的A9mT 在0.4 mol/L NaCl 条件下其活性增加了24 倍[104]。尽管到目前为止已经发现了很多褐藻胶裂解酶可以被盐激活,但是其中的激活机制并没有被彻底揭示出来。根据已有报道,AlgNJ-04 的盐活化特性是由于褐藻胶分子中结合水的去除或褐藻胶-酶复合物形成过程中的电荷效应[98]。AlgM4 的二级结构中α-螺旋和β-折叠的含量被NaCl 改变从而增强了其对底物的亲和力和抵抗热变性的能力[102]。AlyPM 的盐活化特性也是由于在NaCl 存在时其对底物亲和力增强,但是结构并不发生变化[103]。AlyC3 的盐活化机制则是因为保留了二聚体四元结构[97]。
总之,目前对褐藻胶裂解酶的基础研究依然主要集中在新型褐藻胶裂解酶的表征、酶学性质分析以及对酶的三级结构分析,而为了更好地利用褐藻胶裂解酶进行工业化生产,需要进行更多的研究来揭示褐藻胶裂解酶催化机制。
2.6 褐藻胶裂解酶的应用
褐藻胶裂解酶的应用包括褐藻胶寡糖的制备、原生质体分离、肺囊性纤维化病的治疗以及褐藻胶测序等方面。
1)褐藻胶寡糖的制备 褐藻胶寡糖相对分子质量小,具有多种生物活性。褐藻胶寡糖的制备方式包括酸解、热解和酶解等。Iwamoto 等比较了酸解和酶解制得的褐藻胶寡糖对肿瘤坏死因子TNF-α的诱导活性,结果证明酶解得到的褐藻胶寡糖具有更加广泛的生物活性[105]。根据Belik 等报道通过褐藻胶裂解酶降解天然的聚甘露糖醛酸,产生的甘露糖醛酸寡糖可用于协同治疗肿瘤[106]。
2)原生质体分离 褐藻胶是褐藻细胞壁中含量最丰富的成分,除此还有岩藻糖胶、纤维素、多酚和蛋白质等物质。研究表明多酚与褐藻胶网络相连从而进一步加强细胞壁的强度[107]。采用纤维素酶和褐藻胶酶混合的方法可以降解褐藻细胞壁,释放原生质体[108]。
3)肺囊性纤维化病的治疗 褐藻胶裂解酶能够配合一些抗生素降解肺囊性纤维化病人肺中病原菌产生的褐藻胶,使病原菌的细胞壁通透性增强,利于抗生素发挥抗生作用[109]。Patel 等开发了环丙沙星-褐藻胶裂解酶功能化壳聚糖纳米颗粒(AgLase-CIPR-CH-NPs)用于有效治疗肺囊性纤维化患者铜绿假单胞菌感染[110]。
4)褐藻胶测序 核磁共振是表征褐藻胶分子最常见的一种方法,然而其只能得出G 残基和M残基的统计分布,利用具有特殊底物特异性以及作用模式的酶来降解褐藻胶,再结合一些现代分析方法如质谱等对褐藻胶片段进行表征能够进一步测量片段长度分布[28]。
5)生物燃料的制备 褐藻因其高生长速率和高糖分含量而被认为是生物燃料乙醇生产中的可再生生物质。由于缺乏木质素,褐藻生物质的糖化相对容易。但是传统的工业微生物无法代谢褐藻胶,经代谢工程改造的微生物生产的外切型褐藻胶裂解酶可以有效利用褐藻胶,以此克服了该问题[111]。Wang 等优化了两种重组褐藻胶裂解酶(内切型Alg7D 和外切型Alg17C)的酶促糖化过程,以便从褐藻胶中高效生产DEH,而DEH 是利用褐藻生物质生产生物燃料的关键底物[112]。
2.7 提高褐藻胶裂解酶的应用能力
目前针对褐藻胶裂解酶的应用能力,主要是通过酶的固定化和酶的分子改造提高酶活性或者改善某种特性,大大提高了酶的工业化应用效率。
为了发挥酶的最大应用价值,近年来研究人员证明了固定化酶在稳定性、可重复利用性和易于分离方面显示出比游离酶更好的优势,酶可以通过吸附、包埋和交联进行固定化。目前对固体载体上固定褐藻胶裂解酶已经进行了一些研究,例如生物聚合物微球、超滤膜、壳聚糖纳米颗粒、介孔氧化钛颗粒等,为褐藻胶寡糖的生产、工业废水的处理以及抗生物膜治疗等方面提供了褐藻胶裂解酶应用的途径[25,83]。作者所在课题组将褐藻胶裂解酶AlyPL6固定在介孔氧化钛颗粒(MTOPs)上后,在重复使用10 次后,在45 ℃下保留>55.4%的活性[113]。Li 等将褐藻胶裂解酶Aly08 固定在低相对分子质量壳聚糖纳米颗粒上,与游离的Aly08 相比,固定化的ALLMW-CS-NPs 在抑制铜绿假单胞菌生物膜的形成和阻断成熟的生物膜方面表现出更高的效率,使得铜绿假单胞菌的生物量大大减少。该研究促进了褐藻胶裂解酶作为抗生物膜剂的进一步发展[114]。而Meshram 等将AlgL 固定在醋酸纤维素超滤膜上,成功地解决了多糖结垢问题对水净化的影响[115]。
酶的分子改造主要包括合理设计、半理性设计、定向进化、保守结构域重组和非催化结构域截断[116],经过分子改造后的突变体具有与初始酶不同的酶学特性。作者所在课题组系统总结了褐藻胶裂解酶分子改造的研究进展[117],目前常以引入二硫键、重建保守结构域以及定向进化来提高酶的活性和稳定性。例如,Yang 等在对cAlyM 的催化位点、二级结构以及空间构型进行综合分析后,在分子中引入了二硫键,设计出了突变体D102C-A300C 和G103C-T113C,t1/2(45 ℃)分别增加了2.25、1.16 h[118]。作者所在课题组研究发现褐藻胶裂解酶Aly7B 在35 ℃下表现出较差的热稳定性。然而,当截断Aly7B-CDI(非催化结构域:R2~Y181)时,Aly7BCDII(催化结构域:W190~H477)在35 ℃下活性可以保持不变[119],热稳定性大大提高。Xu 等通过在AlgL-CD 的活性中心引入碱性氨基酸来合理设计酶分子以增加酶活性,其中突变体E226K 的整体构象变得更加灵活,与底物的亲和力增加,表现出比野生型AlgL-CD 更高的酶活力,但同样由于钙结合环的灵活性变高,与Ca2+的结合能力变弱,E226K 的热稳定性变差[120]。而Su 等基于E226K 的作用模式,选择loop 环1 上的I211 位点和底物入口处的E276、Y292 和R294 位点作为工程靶点,设计出的突变体E226K/I211T/R294V 催化裂隙周围的环更灵活、底物入口更大,酶的催化效率提高了4.78 倍,半衰期t1/2(45 ℃)从89 min 增加到557 min[121]。此外,分子改造还可以用于改造酶的最终产物,Zhang等报道了借助AlyF 中间产物的裂解模式变化,对与糖结合的残基Arg266 进行位点突变,改变亚位点对糖的亲和力,结果证明F128T/W172R/R226H突变体的主要产物由三糖(三糖占比为87.0%)变为二糖和三糖(二糖占比提高到40.5%)[122]。
3 甘露聚糖C5 差向异构酶
甘露聚糖C5 差向异构酶(mannuronan C5-epimerase,MC5E)是一种褐藻胶修饰酶,催化褐藻胶中的β-D-甘露糖醛酸(M)转化为C5 同分异构体α-L-古洛糖醛酸(G)。研究表明纯化后的一些MC5Es 能在体外引入G 片段,并进一步增加褐藻胶中的G 残基含量,经验证AlgE2 在特定的褐藻胶中将G 残基相对含量从初始值(0~45%)提高到约70%[123]。而AlgE6 和AcAlgE1 甚至可以将G 残基相对含量分别提高到78%和87%[124]。考虑到褐藻胶的理化性质和生物活性与G/M 的含量有关,MC5E 作为一种褐藻胶修饰酶是生产具有特殊性质的褐藻胶的重要工具酶。
3.1 甘露聚糖C5 差向异构酶的来源及分类
MC5Es 有两个主要的来源:真核生物来源,包括褐藻、海带和昆布等;细菌来源,主要包括假单胞菌属(如荧光假单胞菌、铜绿假单胞菌、丁香假单胞菌和门多萨假单胞菌)和固氮菌属(如圆褐固氮菌和棕色固氮菌)[124]。不同物种中的MC5Es 具有不同的数量、类型和特征。
MC5Es 可分为Ca2+依赖亚型和Ca2+非依赖性亚型。例如丁香假单胞菌中的PsmE、圆褐固氮菌中的AcAlgE1 以及棕色固氮菌中AlgE1~7 的酶活性取决于Ca2+的存在,而丁香假单胞菌、棕色固氮菌、铜绿假单胞菌中的周质AlgG 可以在无Ca2+条件下高效地将甘露糖醛酸转化为古洛糖醛酸[125]。对于依赖Ca2+的MC5Es 来说,Ca2+参与中和异构化反应中甘露糖醛酸的电荷,而在丁香假单胞菌中的Ca2+非依赖型周质AlgG 中一些特殊的氨基酸,如Arg345,也可以执行同样的功能[126]。
MC5Es 也可以分为单功能和双功能MC5Es。例如棕色固氮菌中的AlgE2 和AlgE7 都具有差向异构酶活性和裂解酶活性,在存在Ca2+(3.3 mmol/L)的情况下,AlgE2 可以修饰褐藻胶并使其链中的糖苷键发生断裂,具体表现为催化后的褐藻胶平均相对分子质量下降和整个褐藻胶溶液的黏度下降[123]。同样,AlgE7 也具有与AlgE2 相同的双功能且其裂解酶活性高于AlgE2[127]。Gawin 等也在2020 年从棕色固氮菌中鉴定出3 种褐藻胶修饰酶,其中AcAlgE2和AcAlgE3 具有裂解酶和异构酶活性,且在体外条件下只显示出裂解酶活性[128]。来自铜绿假单胞菌的AlgG 不仅具有异构酶活性,而且还能保护褐藻胶不被降解[129]。来自丁香假单胞菌中Ca2+依赖的PsmE会催化褐藻胶中的M 残基的异构化和O-乙酰水解[125]。
3.2 甘露聚糖C5 差向异构酶的结构及催化机制
棕色固氮菌产生的7 种分泌性差向异构酶(AlgE1~7,AlgEs)结构特征已经研究清楚,AlgEs 由两个不同的蛋白质模块组成,包括一个或两个A 模块(约385 个氨基酸)和1~7 个R 模块(约150 个氨基酸)[123]。每个AlgE 都有一个独特的A 和R 模块的序列、数量和分布(见图8),每个胞外AlgE 的最后一个R 模块通常都有一个参与酶分泌的非结构化多肽[130]。含有与褐藻胶和Ca2+结合位点的A 模块可以进行异构化反应和确定最终的异构化反应模式[131]。而R 模块不具有异构化活性,主要通过降低催化反应对Ca2+浓度的要求,使A 模块的催化活性提高了约10 倍[132]。除此之外,具有9 个氨基酸序列的4~7 个重复的R 模块参与了酶的分泌和Ca2+的结合[130]。丁香假单胞菌的PsmE 具有与AlgEs 相似的A 和R 模块,同时还具有额外的M 区、N 区和RTX 区。M 区和RTX 区都是参与Ca2+的结合,而N区是一种乙酰化酶[125]。此外,圆褐固氮菌中的AcAlgE1、AcAlgE2 和AcAlgE3 具有与AlgEs 相 同的模块结构[35]。

图8 MC5Es 的模块结构Fig.8 Module structure of MC5Es
研究人员通过核磁共振方法确定了AlgE4 的结构,AlgE4 的A 模块折叠成一个右手平行β-螺旋,由4 个平行的β-折叠组成,包括12 个完整的匝数[133]。突变体实验证明,Tyr149、Asp152、His154 和Asp178 是AlgE4 活性的关键残基,甘露糖醛酸的质子化羧基可以与Asp152(或Asp178)形成氢键,Tyr149 作为催化碱提取与C5 结合的质子,质子化的His154 作为催化酸贡献一个质子对C5 进行亲核攻击,最后形成古洛糖醛酸[133]。R 模块形成了一个右手平行的β-胶冻卷。根据计算,A 模块可以结合11 个糖醛酸残基,R 模块可以结合5 个残基[134]。AlgE4 的结构模型可以用于更好地理解其他AlgE1~7 结构。
Wolfram 等解释了来自丁香假单胞菌的AlgG的分子结构,它折叠成右手平行β-螺旋,有11 个完整的线圈和一个不完整的线圈,其中线圈4~10 形成一个碳水化合物结合域或糖类水解结构域[126]。
研究表明,褐藻胶裂解酶和甘露聚糖C5 差向异构酶的催化机制是相似的[133],裂解反应和异构化反应都涉及3 个步骤,两者均需要中和羧基上的负电荷,并催化提取C5 位上的质子,两者的反应机理差异发生在最后一步,对于裂解酶来说,最后一步是糖苷键的断裂,同时在C4 和C5 之间形成双键,离开的基团发生质子化形成一个新的还原端。而甘露聚糖C5 差向异构酶需要一个氨基酸残基,该残基能够从吡喃糖环的另一侧向C5 提供一个质子,形成C5 差向异构体。
AlgG 和AlgE4 的A 模块的整体结构与一些β-螺旋结构的褐藻胶裂解酶(PL6、PL31 家族)在结构上有相似之处,然而使用Dail 进行蛋白质结构比较结果表明,它们之间没有任何可能表明共同进化起源的序列同源性,并且这些褐藻胶裂解酶的催化残基在AlgE4 中的A 模块中并不保守[133]。异构酶AlgE4 中的A 模块的催化位点更类似于褐藻胶裂解酶A1-III(PL5 家族)和ALY-1(PL7 家族),ALY-1和A1-III 的底物结合裂缝中心的4 个催化残基(Gln/Asn、His、Arg 和Tyr)在反应机理中起着关键作用。AlgE4 中的A 模块的活性位点Asp152、His154、Lys117 和Tyr149 也显示出相同的空间排列,并且甘露糖醛酸三糖以与A1-III 中结合的三糖非常相似的方向和位置结合。尽管4 个活性位点氨基酸残基的位置相似,但是其他重要残基(尤其是Asp178)和亚位点-2 和-3 的环境非常不同。
AlgG 与AlgE4 的活性位点结构非常相似,活性位点的主要区别在于AlgE4 不包含与AlgG 中发现的Arg345 相当的残基,而是包含参与形成AlgE4中Ca2+结合位点的几个酸性残基。正如在大多数β-螺旋褐藻胶裂解酶中所发现的那样,这种Ca2+在反应过程中能够中和糖醛酸的羧酸基团,从而发挥与Arg345 相当的作用[126]。依赖Ca2+的褐藻胶裂解酶和AlgE4 通过Ca2+中和糖醛酸上的负电荷,而不依赖Ca2+的褐藻胶裂解酶和AlgG 则使用一个精氨酸残基来完成这个反应[135]。在第二步催化中,精氨酸或赖氨酸通常作为裂解酶的催化碱基,而去质子化的His319 能够从甘露糖醛酸的C5 中提取质子,His319 很可能在AlgG 的催化反应中起催化碱基的作用。那么,水分子在AlgG 的催化过程中充当催化酸,这也与前文中提到的一些具有β-螺旋结构的褐藻胶裂解酶也有水分子作为催化酸的结论一致[126]。
对于双功能酶AlgE7,Gaardlos 等解释了两种活性如何相互调节的结构基础,首先异构酶和裂解酶活性具有相同的催化位点,这两种活性通过不断改变褐藻胶链而相互影响,并且产物的形成高度依赖于酶作用于哪种底物。当使用明确的底物poly-M和poly-MG 时,裂解酶优先的裂解位点为M↓XM和G↓XM(X 为G 或M)。其中H154 在反应中充当催化碱,Y149 充当催化酸,而突变体R148G 几乎失去了所有裂解酶活性,但保留了异构酶活性,因此推测R148 会影响Y149 将质子提供给糖苷键或糖环的另一侧[136]。
3.3 甘露聚糖C5 差向异构酶的作用方式
关于MC5E 作用方式的报道较少,相关报道主要集中在棕色固氮菌中的AlgE 家族,目前已经提出两种反应模式,即优先攻击模式和渐进作用模式[137]。在优先攻击模式中,酶优先攻击邻近G 残基中的M 残基,并在每次差向异构化反应后脱离底物[138]。而在渐进作用模式中,由于甘露糖醛酸之间通过β-1,4 糖苷键连接,每个残基相对于其相邻残基旋转近180°,因此酶和多糖链相对移动,使得下一次异构化反应可以在酶与底物不解离的情况下完成[138]。有研究报道了AlgE4 的渐进作用模式,酶沿着底物链进行滑动,每隔一个残基进行一次异构化,不需要发生旋转。即底物封闭在一个相对较大的凹槽中,并且在活性位点的每一侧都有一个夹子,该夹子封闭了聚合物并帮助其滑动[137]。而丁香假单胞菌中的AlgG 也遵循渐进作用模式,这也是为什么假单胞菌中的褐藻胶出现M 和G 交替的原因[126]。此外,AlgE2 和AcAlgE1 遵循优先攻击模式进行反应,并且与底物的组成和钙离子的浓度有关[126,128]。而其余的AlgEs 都是根据优先攻击模式或者两种机制的组合进行反应[132]。
由于反应模式的不同,不同的AlgEs 异构酶所产生的产物也不同。根据报道,AlgE1 具有两种不同的催化结构域,一种产生poly-G,一种产生poly-MG[139],AlgE2 和AlgE5 主要产生短的poly-G[140],PsmE、AlgE6 和AcAlgE1 主要产生长的poly-G[140],AlgE4 主要产生poly-MG[141]。人们可以利用该产物特点获得不同类型的褐藻胶低聚糖。
3.4 甘露聚糖C5 差向异构酶的酶学特性
目前已经表征的大多数异构酶的最适pH 在6.5~8.0,最适温度范围为30~40 ℃[124]。据报道,来自Pseudomonas mendocina sp.DICP-70 的PmC5A 作为裂解酶和异构酶时的最适pH 分别为8.0 和9.0,是目前最适pH 最高的酶[142]。金属离子影响酶活力,当Na+浓度为100~200 mmol/L 时,AlgE1 活性最高[124]。对于AlgE2,Ca2+浓度为0.58 mmol/L 时,初始反应速率随Na+浓度的增加而增加,当Ca2+浓度达到3.3 mmol/L 时,Na+对异构化反应没有促进作用,而当Na+浓度达到约20 mmol/L 时,对异构化反应有抑制作用[143]。对于双功能酶AlgE7,较高的Na+浓度可降低裂解酶活性并增加poly-G 的形成,而高Ca2+浓度则提高裂解酶活性并减少poly-G 的形成[136],因此,可以通过调节Na+与Ca2+浓度来调节AlgE7 的裂解酶活性与异构酶活性,获得目标产物。研究人员还证明在某些情况下Sr2+可以代替Ca2+,但酶的活性明显降低[144]。
3.5 甘露聚糖C5 差向异构酶的应用
MC5E 作为一种褐藻胶修饰酶,能够增加底物的G 残基含量,将褐藻胶或褐藻胶寡糖升级为具有长poly-G 或poly-MG 的产品,该类型的产品表现出优良的机械性能和独特的生物活性,可以应用于制备药物释放材料、用作抗菌剂、促进角质细胞增殖等方面。
1)制备具有优异机械性能的材料 富含G 的褐藻胶分子可以通过与一些二价离子结合而形成热稳定的三维凝胶网络,形成的凝胶[145]具备一定的刚性和机械强度,具有低收缩、高孔隙率[146]、高稳定性和高交联密度等特点。用MC5E 调节褐藻胶分子中的G 残基含量从而制备具有优异机械性能的材料是一种较为简单、可控和节能的方法。
2)制备应用于药物释放的褐藻胶 褐藻胶是输送药物的理想材料。药物扩散过程的速度主要与褐藻胶分子的孔隙大小有关,研究表明,poly-G 含量较高的褐藻胶分子具有更开放的孔隙结构,表现出较高的扩散能力。而富含M 的褐藻胶分子是软的,多孔性较差,并且随着时间的推移容易脱胶[147]。因此,富含G 的褐藻胶能够更好地保护药物不被破坏,使其达到特定的位置并最大限度地发挥药效。
3)增强褐藻胶寡糖的抗菌活性 富含G 的褐藻胶寡糖可以通过与细胞表面的结合来分解生物膜,影响表面电荷,导致微生物的聚集,并通过阻止微生物移动来影响致病微生物的活性并增强抗生素的效果,因此M/G 残基比率低的褐藻胶寡糖表现出突出的抗菌活性并可以用来制备抗菌剂[148]。
4)制备促进角质细胞增殖的褐藻胶寡糖 褐藻胶和褐藻胶寡糖也可以应用于治疗脱发症,因为它们不仅可以作为凝胶基质嵌入和装载活性成分,还可以促进角质细胞增殖。其中,具有由末端还原的poly-MG 组成的褐藻胶寡糖组分是角质形成细胞生长最有效的激活剂[149]。
4 褐藻胶乙酰化
细菌中的褐藻胶在O2/O3 位上发生乙酰化,增加了自身的水合能力和黏度,有助于聚合物作为保护膜靠近细菌并阻碍免疫细胞的运动,同时乙酰化还使褐藻胶裂解酶无法作用于M 残基,从而保护褐藻胶不被裂解成褐藻胶寡糖。然而到目前为止还没有发表过详细的褐藻胶乙酰化机制。
4.1 褐藻胶乙酰化机制初步分析
目前对铜绿假单胞菌中乙酰化褐藻胶的生物合成途径及相关基因已经基本了解,研究表明AlgI、AlgJ 和AlgF 形成一个多蛋白质复合体,并借助Alg8 和AlgX 形成的分泌多蛋白质复合体与包膜上的褐藻胶发生聚合作用,进行褐藻胶的O-乙酰化反应过程。虽然AlgI、AlgJ 和AlgF 不是褐藻胶合成蛋白质复合体的一部分,但它们是褐藻胶乙酰化所必需的,Chanasit 等也通过实验证明了这一点[150]。AlgI 是一种膜结合型O-乙酰基转移酶,其从未知的细胞质乙酰基供体通过细胞质膜转移乙酰基,而AlgJ 附着在内膜上,将乙酰基转移到AlgX,AlgX 是甘露聚糖O-乙酰化酶,包含一个碳水化合物结合模块,能够将M 残基乙酰化[151]。
研究表明乙酰化程度高的褐藻胶的异构化程度较低[152],原因可能是乙酰化酶AlgX 和周质异构酶AlgG 均是修饰酶复合体的一部分,可以看做是多糖底物的固定化酶,两者均能够结合M 残基并进行修饰反应,但目前尚不清楚两种酶在与褐藻胶的结合上是否存在竞争关系[126]。
4.2 研究乙酰化机制的意义
高乙酰化褐藻胶具有的黏度高、水合能力强、G残基含量低等特点使其在组织工程开发和再生医学中的水凝胶和支架以及含有生物活性胶囊化合物的伤口敷料等众多材料方面具有巨大潜力[153]。
铜绿假单胞菌形成以乙酰化褐藻胶为主要成分的生物被膜,可以提高生物被膜的稳定性,从而有助于细菌抵抗恶劣的生存环境。同时相比于浮游细菌,生物被膜内的铜绿假单胞菌对抗生素的耐药性提高了10~1 000 倍,乙酰化褐藻胶是导致细菌耐药性和细菌免疫逃逸的主要原因[154]。因此研究褐藻胶的乙酰化机制对于治疗铜绿假单胞菌感染也具有重要意义。
5 褐藻胶脱乙酰化酶
乙酰化的褐藻胶可以自发产生脱乙酰化,但在正常条件下反应缓慢,前文中提到,胞外甘露聚糖C5 差向异构酶可以催化产生G,而这些酶不能催化已经乙酰化的残基,根据对AlgE4 的晶体结构的分析表明这是由于空间位阻的限制,因此,为了获得高G 含量的褐藻胶,需要对已经乙酰化的残基进行去乙酰化。
目前还没有发现假单胞菌能够产生连续G 残基的褐藻胶,但是人们在丁香假单胞菌中发现了一种分泌性甘露聚糖C5 差向异构酶PsmE,该酶能够在体外催化生成连续的G 残基聚合物,PsmE 能够催化乙酰化底物进行差向异构化反应,是一种具有脱乙酰基和C5 差向异构功能的双功能酶,使得菌株产生的褐藻胶具有较低乙酰基数量和较高G 残基含量的特性[125]。
6 展 望
尽管目前已经表征了大量的褐藻胶裂解酶,特别是对于来自海洋细菌中的酶,但对极端环境中的裂解酶知之甚少,一些新发现的褐藻胶裂解酶表现出的新颖的酶学性质和作用机制也没有得到清晰地解释。纵观近年来发表的关于褐藻胶裂解酶分子改造的相关文章,对酶的改造仍旧需要建立在对酶结构和作用机制分析的基础上。因此现下仍旧迫切需要筛选、克隆和表征新型褐藻胶裂解酶并解析其酶学性质,了解褐藻胶裂解酶的调控机制。同时随着褐藻胶裂解酶在生物工业上应用的深入,迫切需要利用固定化和分子改造等手段以改善酶的催化效率、特殊性能和产量,以满足其日益增加的商业需求。
MC5E 作为一种生物工具酶在生产褐藻胶及具有特殊M/G 残基比率和序列分布的褐藻胶寡糖方面具有重要意义,至今人们已经分离和表征了几种具有不同性质的MC5Es 并根据其晶体结构初步阐明了其催化机制,但对于MC5Es 的结构和反应机制还需要进一步探索与研究。由于已知天然MC5Es 的热稳定性和催化效率并不理想,因此,需要通过计算机辅助设计、定点突变以及DNA 修饰等方式提高酶的催化活性和酶学性质,推动MC5Es 的工业化应用。
褐藻胶修饰酶作为一种生物技术工具表现出了重要的生物活性和应用价值。目前人们在褐藻胶裂解酶和甘露聚糖C5 差向异构酶上的研究较深,而对于褐藻胶乙酰化和脱乙酰化的了解尚未深入。随着结构分析技术不断发展,对褐藻胶修饰酶作用机制和条件的不断深入了解,可以利用各种酶的产物特性进行配合生产目标褐藻胶分子,满足不同的商业功能需求。

