米槠次生林和天然林细根养分及化学计量特征
陈铭, 王韦韦, 程慧梓, 陈蓉, 曹丽荣, 王小红, 陈光水, 姚晓东
米槠次生林和天然林细根养分及化学计量特征
陈铭, 王韦韦, 程慧梓, 陈蓉, 曹丽荣, 王小红, 陈光水, 姚晓东*
(福建师范大学地理科学学院,湿润亚热带生态地理过程教育部重点实验室,福州 350007)
探讨人为干扰对森林养分利用和生物地球化学循环特征的影响,对亚热带米槠()次生林和天然林细根化学计量特征及其随土壤深度(0~80 cm)的变化趋势进行了研究。结果表明,混合线性模型表明林分和土层深度对细根化学计量特征影响的主效应显著,但是交互作用不显著;米槠次生林细根N和P含量均显著低于天然林,而细根C浓度、C:N、C:P显著高于天然林,天然林1~2 mm细根C浓度显著低于次生林; 天然林和次生林细根N、P含量均随土层深度增加而呈显著下降趋势,C:N、C:P、N:P均随土层深度增加而呈显著上升趋势,且两林分下降趋势无显著差异;天然林和次生林细根N、P含量及N:P分别与土壤全N、全P含量和N:P存在线性关系,而细根N、P含量和N:P随土层深度变化均与直径显著相关,与细根比根长(SRL)无关。天然林经过人为干扰后,细根化学计量特征随土层深度变化规律虽未发生改变,但细根N和P浓度显著降低。
次生林;天然林;米槠;细根;化学计量特征
生态化学计量学是研究生物地球化学循环和生态过程中元素数量关系和规律性的一种综合而有效的方法[1–2]。细根是植物从土壤吸收养分和水分的重要器官[3–4],在植物与土壤之间的物质交换和能量流动中起着至关重要的作用。细根C:N、C:P能够反映植物对N、P养分的利用效率和周转速率[5],N:P能够反映植物生长对N、P养分的相对限制情况,对植物生长发挥着重要作用[6]。因此分析细根C、N、P的化学计量学特征有助于了解植物对外界环境的响应和适应能力,包括植物生长过程中的碳同化能力、养分元素的利用效率和限制性元素的诊断等[7–8]。
植物细根化学计量特征主要受外界生存环境的影响,特别是不同深度土壤的养分含量[9]和细根形态[10]等。细根的化学计量特征与土壤养分含量有关[11–12]。Makita等[13]的研究表明,日本京都山下锯齿栎()和梗冬青()在表层土壤(0~10 cm)的细根N浓度比40~50 cm土层土壤分别高出1.4和2.1倍,而且认为土壤养分在土壤剖面上分布的异质性可能是导致细根N浓度随土层深度发生变化的主要因素。由于生物地球化学循环过程的作用及P本身移动性差等特性[14],P元素在土壤表层的富集度要大于N, 可能会导致细根N:P随土壤深度呈现出上升趋势。除了土壤养分含量以外,细根形态特征也会影响细根养分的富集[15]。一般认为,细根比根长越大、直径越小,其N、P养分吸收效率相对较高[16]。然而,目前细根化学计量学特征随土壤深度变化的研究主要集中在0~50 cm土层,而50 cm以下土层细根化学计量特征相关研究还鲜有报道。因此,在50 cm以下土层开展细根化学计量特征随土壤深度变化及其影响因素的研究,有助于进一步理解植物与土壤相互作用及其对养分利用和周转的影响[17–18]。
20世纪70年代,福建省开展了常绿阔叶林人促更新试验,以米槠()为建群种的人促更新林已成为亚热带地区地带性植被经营的有效模式[10]。有关米槠天然林和次生林研究主要集中在叶片、凋落物和土壤之间的化学计量特征[9,19–20], 而对其细根化学计量特征的影响还知之甚少。森林次生演替过程中,森林物种组成结构、土壤养分浓度、细根形态等生物或非生物因素的变化,都可能会影响细根的化学计量特征。林开淼[9]报道天然林经过人促更新后,物种组成变化导致了森林土壤养分浓度发生显著变化,其中土壤N养分浓度在0~60 cm显著低于天然林,土壤P浓度在0~20 cm显著低于天然林。此外,王韦韦等[10]报道米槠次生林0~1 mm细根比根长随土层深度增加无显著变化, 而天然林0~1 mm细根比根长随着土层增加显著降低,同时次生林细根比根长在10~80 cm土层要显著小于天然林,这可能是由于米槠次生林中植株个体多,使得更多的根系分布到深层土壤以减少可能的资源竞争,进而导致根系比根长在次生林土壤剖面上分布更均匀。次生林和天然林土壤N、P含量会随土层深度的增加而减少[9],细根直径则随土层深度增加而增加,次生林比根长随土层深度而减少[10],土壤养分和细根形态等因素的差异会引起细根养分及化学计量特征的差异。然而,现有米槠天然林和次生林细根化学计量特征研究,还缺乏同时考虑林分与土壤深度的影响。因此,本文以米槠次生林为研究对象,以米槠天然林作为对照,研究亚热带地区米槠次生林和米槠天然林细根C、N、P浓度及化学计量特征的差异,以及随土壤深度的变化规律(0~80 cm),并提出2个假设:(1) 次生林细根N、P养分浓度显著低于天然林, C:N、C:P高于天然林,且次生林和天然林这种差异不受土层深度影响;(2)由于次生林和天然林土壤养分均随土层深度增加而降低。因此假设细根N、P浓度随着土层深度增加而均呈现下降的趋势,C:N、C:P、N:P逐渐增加,但由于次生林细根比根长在土层深度的均匀分布,导致次生林细根养分及化学计量特征随土层变化趋势比天然林要更缓,为理解人为干扰对深层根系化学计量特征的影响,并为亚热带地区森林恢复和经营提供依据。
1 材料和方法
1.1 研究区概况
研究区位于福建省三明市格氏栲()自然保护区(26°11′ N, 117°28′ E)和三明市金丝湾森林公园陈大林业采育场(26°19′ N, 117° 36′ E)内。该区属中亚热带季风气候,年均气温19.1℃,年均降水量1 749 mm,相对湿度81%,降水主要集中于3—8月。区内大量分布着以米槠为代表的典型常绿阔叶林,土壤以花岗岩发育的红壤和黄壤为主,土壤厚度超过1 m。
米槠天然林位于三明市格氏栲自然保护区内, 样地海拔为315 m,坡度35°,建群树种为米槠,主要树种有米槠、木荷()、杜英()、格氏栲()、桂北木姜子(),林分密度为1 955 ind./hm2,年凋落物为5.43 t/hm2,平均树高11.9 m,平均胸径20.0 cm。群落层次明显,可划分为乔木层、灌木层和草本层3个层次,其中乔木层以米槠占绝对优势。灌木层(树高小于3 m)植物种类较丰富,主要有米槠、黄丹木姜子()、赤楠()、冬青()等。草本层主要由草珊瑚()、山姜()、扇叶铁线蕨()等组成。林下地被层较厚,并且散布有枯立木、倒木和枯枝杆等,枯枝落叶厚度5~8 cm。米槠次生林位于三明市金丝湾森林公园陈大林业采育场,由米槠天然林在20世纪70年代经强度择伐后天然更新(历时约40 a), 并在更新过程中去除其它树种形成,样地海拔330 m,坡度40°,林分密度为3 788 ind./hm2, 年凋落物为4.35 t/hm2,平均胸径12.2 cm,平均树高10.8 m。主要树种有米槠、闽粤栲()、黄丹木姜子、新木姜子()等; 灌木层有木荚红豆()、米槠、褐毛石楠()、罗浮栲()等种类; 草本主要由狗脊蕨()、黑莎草()、油草()等组成。
1.2 试验设计及方法
2010年8月在米槠次生林和米槠天然林分别建立3个20 m×20 m样地,每个样地间隔30 m,2011年4月进行细根采样,用内径4.05 cm的土钻在每个样地按S形钻取土芯7根,深度为80 cm,将取回的土芯按0~10、10~20、20~40、40~60和60~80 cm土层分割,并把每个土层样品分别装入标记好的塑料袋中,带回实验室进行处理。
由于米槠次生林和天然林内树种丰富,各树种的细根难以区分,因此不对各树种的细根进行区分,只进行群落水平的细根研究。用镊子、剪刀等工具挑出土芯中的细根,根据细根颜色、外形、弹性、根皮与中柱分离的难易程度挑出活根,并将活根按0~1和1~2 mm分级,随后将细根于65 ℃下烘干,将杀青烘干的细根用球磨仪进行研磨。最后称取10 mg磨碎根样用元素分析仪(Vario EL Ⅲ Element Analyzer, 德国)测定细根C、N含量;利用连续流动分析仪(Skalar San++, Skalar, 荷兰)测定细根P浓度。随后将取完细根的土壤过2 mm筛,取部分过筛土进行自然风干,随后将风干土过100目筛用于测定土壤C、N和P含量,土壤的基本理化性质见表1。
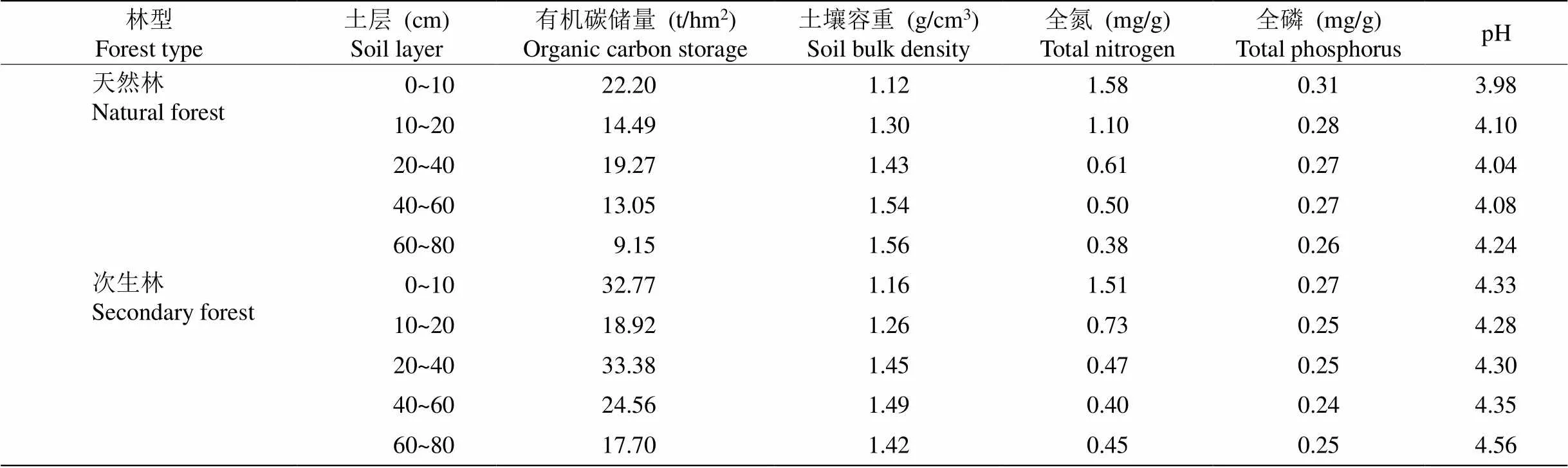
表1 土壤基本理化性质
1.3 数据分析
利用SPSS 21.0软件对数据进行统计分析。将C、N、P浓度进行对数化处理,土层深度作为连续性变量,采用混合线性模型分析米槠次生林和天然林细根之间的化学计量特征的差异,探究土层以及径级对细根化学计量特征的影响;此外,利用混合线性模型和线性拟合检验细根N、P与土壤N、P、N:P及细根比根长、直径之间的相关性,显著性水平设定为<0.05。利用Origin 2021软件作图。
2 结果和分析
2.1 细根C、N、P含量特征
米槠次生林和天然林间的C含量差异因径级而异, 在1~2 mm径级中,次生林细根C含量显著高于天然林(<0.05),而在0~1 mm径级中差异不显著。在2个林分中,1~2 mm径级细根C含量均显著高于0~1 mm径级(<0.05);次生林和天然林所有径级的细根C含量随土层深度增加均无显著变化(表2, 图1)。
细根N、P含量只受林分、径级和土层主效应的显著影响,不受林分和土层的交互影响。次生林细根N、P含量显著低于天然林(<0.05),分别低27.8%和28.7%;次生林和天然林0~1 mm细根的N、P含量均显著高于1~2 mm细根(<0.05);次生林和天然林细根N、P含量均随土层深度增加而呈显著下降趋势(<0.05)(表2, 图1)。
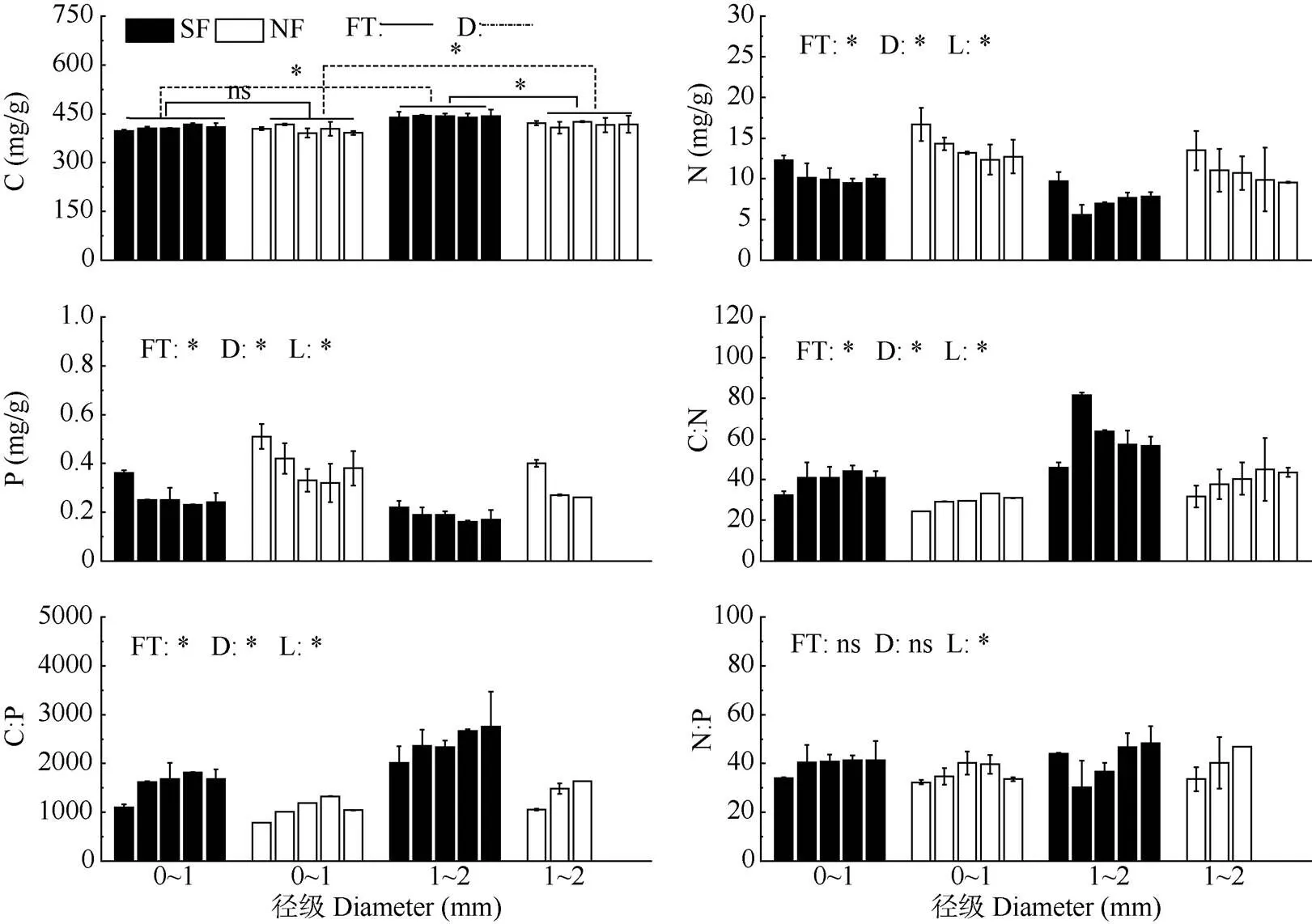
图1 细根 C、N、P含量和化学计量比。ns: 无显著差异; 5个柱子从左至右依次为0~10、10~20、20~40、40~60和60~80 cm土层; SF: 次生林; NF: 天然林; FT: 林分; SL: 土层; D: 径级; *: P<0.05。下同
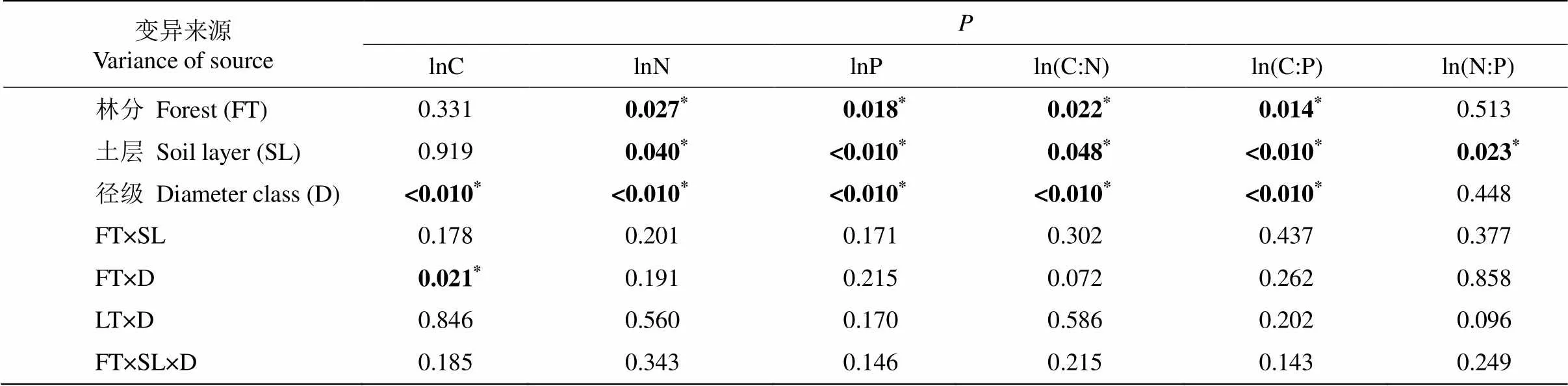
表2 林分、土层与径级对细根C、N和P含量影响的混合线性模型分析
2.2 细根化学计量比特征
次生林和天然林细根之间的C:N和C:P也只受到林分、径级和土层主效应的影响,不受林分和土层的交互影响。与0~1 mm相比,在1~2 mm细根中,次生林细根C:N和C:P显著高于天然林(<0.05),并且与天然林相比,米槠次生林细根C:N和C:P分别提高了34.9%和26.2%;次生林和天然林1~2 mm细根的C:N、C:P均显著高于0~1 mm细根(<0.05); 次生林和天然林所有细根C:N、C:P和N:P均随土层深度增加而表现出显著上升趋势(表2, 图1)。
2.3 相关性分析
由表3, 4可知,细根N含量与土壤全N含量存在显著相关(<0.05),随着土壤全N含量增加而显著升高,林分间和径级间的拟合线斜率均无显著差异,但次生林的拟合线截距显著高于天然林,0~ 1 mm细根的拟合线截距显著高于1~2 mm细根。细根与土壤的全P含量以及细根与土壤的N:P也存在线性关系,且其拟合线斜率和截距不受林分和径级影响。细根N、P含量及N:P随土层深度的变化受径级影响,与比根长无关(图2)。

表3 细根与土壤的N、P含量和N:P的混合线性模型

表4 N、P含量和N:P与细根比根长(SRL)、直径之间的混合线性模型分析
3 结论和讨论
3.1 次生林与天然林细根化学计量特征的差异
与假设(1)一致,米槠次生林细根N、P含量均显著低于天然林。细根N、P元素主要来源于土壤,不同林分细根N、P含量间的差异与土壤养分含量差异有关[21]。天然林和次生林的土壤与细根N、P含量协方差分析表明,土壤和细根N、P存在显著正相关。之前的研究也表明在0~80 cm土层中,次生林土壤N含量显著低于天然林土壤,P含量在0~ 20 cm土层显著低于天然林[9]。因此,次生林细根N、P含量显著低于次生林,可能与不同森林类型之间的土壤养分含量差异有关。此外,林分之间的细根N、P含量差异也可能与森林物种组成差异有关。相比于天然林,次生林中树种较多且密集,采集的根中米槠树种占比较少,同时米槠树种细根本身N、P含量要显著高于其他树种的平均值[22],因此导致次生林细根N、P含量显著低于天然林。细根C:N、C:P能在一定程度上反映细根周转能力,研究细根C:N、C:P在预测与调控森林生态系统中的养分循环方面具有重要意义[23]。细根C:N和C:P与细根周转速率呈负相关[24],即细根C:N、C:P越小,细根周转越快。米槠次生林C:N、C:P显著高于天然林, 支持假设(1)中次生林和天然林C:N、C:P差异,表明天然林经过人为干扰后,细根周转能力会降低,进而可能影响森林土壤的生物地球化学循环。

图2 细根和土壤的N、P含量和N:P与细根比根长间的关系
米槠次生林细根N、P含量均值分别为8.38、0.21 mg/g,天然林为11.25、0.28 mg/g,而全球植物细根的平均N和P含量分别为9.90~11.2和0.55~ 0.85 mg/g[7],中国植物细根的平均N和P含量分别为9.16和0.39 mg/g[25]。米槠天然林细根N含量高于全球和中国平均水平,主要由于亚热带地区受到N沉降的影响,导致植物N含量增加[26]。Li等[27]的Meta分析结果也表明,模拟氮沉降后, 细根N含量显著提高。米槠次生林细根平均N含量低于全球和中国平均水平,这可能与米槠次生林土壤本身N含量较低有关。此外,由于植物P限制现象在热带到温带生态系统中普遍存在,尤其是具有高风化土壤的热带和亚热带森林[14],这也导致了米槠次生林和天然林细根P含量均低于全球和中国平均水平。
此外,一般认为细根N:P低于14表示植物受N限制,高于16表示植物受P限制,14~16表示受N与P的共同限制[15]。Yuan等[25]对全球植被地下细根的化学计量研究表明,细根的N:P为13~18[28]; 马玉珠等[25]对中国植被细根化学组成进行研究,认为细根的N:P平均为14.30。2种林分细根N:P没有显著差异,平均为38.97,远高于全球和中国平均水平,表明该地区米槠次生林和天然林均受到强烈的P限制,这与一般认为温带森林和北方森林的生产力受N的限制,而热带雨林和亚热带常绿林生产力普遍受P限制的观点相似[29–30], Han等[31]的研究也表明中国南方的植物普遍受P限制。此外, 2种林分间N:P差异不显著,可能归结于植物N、P元素在各种生物功能上紧密耦合及协同变化,导致N:P相对恒定[32–34]
3.2 细根化学计量特征随土层深度变化
与假设(2)不一致,细根N、P养分含量随土层深度增加而减少,化学计量特征随土层深度增加而增加,同时次生林和天然林细根养分及化学计量特征随土层深度变化趋势无显著差异。细根N、P含量随土层深度的变化趋势分别与土壤N、P含量变化趋势呈显著正相关,与Joslin等[35]的研究结论一致。次生林细根N含量与土壤全N含量拟合线截距要显著低于天然林,0~1 mm细根回归直线截距显著低于1~2 mm细根,这表明在相同土壤养分条件下,次生林以及直径更大的细根对N养分的吸收能力更弱,这与Gong等[16]的研究结果一致。此外,细根和土壤的P含量、N:P的拟合线斜率和截距不受林分和径级影响,表明细根与土壤的P含量的相关性及细根与土壤的N:P的相关性不受林分和径级影响。细根N、P含量和N:P与细根直径显著相关,这与Mattia等[24]的结论一致,但与比根长不存在显著相关,这可能说明细根N、P养分和N:P随土层变化均不受比根长的影响。细根C:N、C:P能够反映细根周转速率,其值越高表明周转速率越低[35]。天然林和次生林细根C:N、C:P随土层深度增加均表现出指数型增加的趋势,不仅支持了本研究假设(2)中C׃N、C׃P随土层增加而增加的趋势,同时也反映了细根周转速率随土层深度的变化趋势。随土层深度增加,细根N:P呈现增加趋势,表明随着土壤深度增加,细根受P限制比N更严重,这可能是因为P元素在土壤中移动性较差[14],在土壤表层的富集度又大于N,同时随土层深度增加,P元素含量减少程度要显著高于N,进而导致细根N:P随土层深度增加而增加。这些结果表明,森林细根养分及化学计量特征随土层深度变化趋势可能主要受到了土壤养分的调控,对细根比根长无明显响应。同时能够进一步揭示细根养分利用及周转能力在土壤剖面的变化规律,有助于进一步加深对森林土壤的生物地球化学循环过程的理解。
综上所述,天然林在人促更新后物种组成、土壤养分含量等性状会发生显著改变,进而导致植物细根本身养分含量及周转能力发生变化。相比天然林,次生林细根N、P含量显著降低,C:N、C:P及N:P显著增加,但细根化学计量特征随土层深度变化规律没有发生显著变化,表明人促更新后,森林树种之间的竞争加强,导致森林细根养分含量及周转能力下降,但细根养分利用和周转的能力在土壤剖面上的变化已经接近天然林,说明人促更新对森林的恢复、经营有着比较好的效果。因此,在未来森林经营中,可考虑将人促更新纳入主要森林恢复、经营的方式中,同时将米槠作为主要树种进行保育,以利于森林生产力的提高。
[1] ELSER J J, ACHARYA K, KYLE M, et al. Growth rate-stoichiometry couplings in diverse biota [J]. Ecol Lett, 2003, 6(10): 936–943. doi: 10.1046/j.1461-0248.2003.00518.x.
[2] SARDANS J, RIVAS-UBACH A, PEÑUELAS J. The elemental stoichiometry of aquatic and terrestrial ecosystems and its relationships with organismic lifestyle and ecosystem structure and function: A review and perspectives [J]. Biogeochemistry, 2013, 111(1/2/3): 1–39. doi: 10.1007/s10533-011-9640-9.
[3] KOCHSIEK A, TAN S, RUSSO S E. Fine root dynamics in relation to nutrients inrain forest soils [J]. Plant Ecol, 2013, 214(6): 869–882. doi: 10.1007/s11258-013-0215-9.
[4] WANG P, SHU M, MOU P, et al. Fine root responses to temporal nutrient heterogeneity and competition in seedlings of two tree species with different rooting strategies [J]. Ecol Evol, 2018, 8(6): 3367–3375. doi: 10.1002/ece3.3794.
[5] ÅGREN G I. Stoichiometry and nutrition of plant growth in natural communities [J]. Annu Rev Ecol Evol Syst, 2008, 39(1): 153–170. doi: 10.1146/annurev.ecolsys.39.110707.173515.
[6] SONG Z L, LIU H Y, ZHAO F J, et al. Ecological stoichiometry of N:P:Si in China’s grasslands [J]. Plant Soil, 2014, 380(1/2): 165– 179. doi: 10.1007/s11104-014-2084-y.
[7] ELSER J J, BRACKEN M E S, CLELAND E E, et al. Global analysis of nitrogen and phosphorus limitation of primary producers in fresh- water, marine and terrestrial ecosystems [J]. Ecol Lett, 2007, 10(12): 1135–1142. doi: 10.1111/j.1461-0248.2007.01113.x.
[8] ZHAO M Y, LUO Y K, CHEN Y H, et al. Varied nitrogen versus phosphorus scaling exponents among shrub organs across eastern China [J]. Ecol Indic, 2021, 121: 107024. doi: 10.1016/j.ecolind.2020. 107024.
[9] Lin K M. Accumulation of carbon, nitrogen, phosphorus, and frac- tionation of soil phosphorus in the subtropical human-assisted natural regeneration secondaryforests [D]. Fuzhou: Fujian Normal University, 2015. [林开淼. 亚热带米槠人促林碳、氮、磷积累特征及土壤磷素有效性分级研究 [D]. 福州: 福建师范大学, 2015.]
[10] WANG W W, HUANG J X, CHEN F, et al. Effects of tree species diversity on fine-root biomass and morphological characteristics in subtropicalforests [J]. Chin J Appl Ecol, 2014, 25(2): 318–324. [王韦韦, 黄锦学, 陈锋, 等. 树种多样性对亚热带米槠林细根生物量和形态特征的影响 [J]. 应用生态学报, 2014, 25 (2): 318–324. doi: 10.13287/j.1001-9332.2014.0034.]
[11] KOERSELMAN W, MEULEMAN A F M. The vegetation N:P ratio: A new tool to detect the nature of nutrient limitation [J]. J Appl Ecol, 1996, 33(6): 1441–1450. doi: 10.2307/2404783.
[12] YESTE A, BLANCO J A, IMBERT J B, et al.L. andL. effects on soil and root properties and their inter- actions in a mixed forest on the southwestern Pyrenees [J]. For Ecol Manag, 2021, 481: 118726. doi: 10.1016/j.foreco.2020.118726.
[13] MAKITA N, HIRANO Y, MIZOGUCHI T, et al. Very fine roots respond to soil depth: Biomass allocation, morphology, and physiology in a broad-leaved temperate forest [J]. Ecol Res, 2011, 26(1): 95–104. doi: 10.1007/s11284-010-0764-5.
[14] HOU E Q, LUO Y Q, KUANG Y W, et al. Global meta-analysis shows pervasive phosphorus limitation of aboveground plant production in natural terrestrial ecosystems [J]. Nat Commun, 2020, 11(1): 637. doi:10.1038/s41467-020-14492-w.
[15] WANG Z Q, HUANG H, YAO B Q, et al. Divergent scaling of fine- root nitrogen and phosphorus in different root diameters, orders and functional categories: A meta-analysis [J]. For Ecol Manag, 2021, 495: 119384. doi: 10.1016/j.foreco.2021.119384.
[16] GONG L, ZHAO J J. The response of fine root morphological and physiological traits to added nitrogen in Schrenk’s spruce () of the Tianshan Mountains, China [J]. PeerJ, 2019, 7: e8194. doi: 10.7717/peerj.8194.
[17] PIERRET A, MAEGHT J L, CLÉMENT C, et al. Understanding deep roots and their functions in ecosystems: An advocacy for more uncon- ventional research [J]. Ann Bot, 2016, 118(4): 621–635.
[18] MAEGHT J L, REWALD B, PIERRET A. How to study deep roots and why it matters [J]. Front Plant Sci, 2013, 4: 299. doi: 10.3389/ fpls.2013.00299.
[19] MENG Q Q, GE L L, LIN Y, et al. Ecological stoichiometric charac- teristic of leaf-litter-soil in natural and planted forests ofand[J]. J NW For Univ, 2019, 34(6): 8–15. [孟庆权, 葛露露, 林宇, 等. 格氏栲天然林及人工林和杉木人工林生活叶-凋落叶-土壤生态化学计量特征 [J]. 西北林学院学报, 2019, 34(6): 8–15. doi: 10.3969/j.issn.1001-7461.2019.06. 02.]
[20] HU S C, XIONG D C, HUANG J X, et al. Fine root production in initial stage ofunder different regeneration modes in Sanming, Fujian Province, China [J]. Chin J Appl Ecol, 2015, 26 (11): 3259–3267. [胡双成, 熊德成, 黄锦学, 等. 福建三明米槠次生林在不同更新方式下的初期细根产量 [J]. 应用生态学报, 2015, 26 (11): 3259–3267. doi: 10.13287/j.1001-9332.20150915.004.]
[21] WANG Z Q, LV S Q, SONG H, et al. Plant type dominates fine-root C:N:P stoichiometry across China: A meta-analysis [J]. J Biogeogr, 2020, 47(5): 1019–1029. doi: 10.1111/jbi.13791.
[22] XIONG D C, HUANG J X, YANG Z J, et al. Nutrient heterogeneity in fine roots of six subtropical natural tree species [J]. Acta Ecol Sin, 2012, 32(14): 4343–4351. [熊德成, 黄锦学, 杨智杰, 等. 亚热带六种天然林树种细根养分异质性 [J]. 生态学报, 2012, 32(14): 4343– 4351. doi: 10.5846/stxb201106280966.]
[23] YANG J J, ZHANG X R, MA L S, et al. Ecological stoichiometric relationships between components offorest in Loess Plateau [J]. Acta Pedol Sin, 2014, 51(1): 133–142. [杨佳佳, 张向茹, 马露莎, 等. 黄土高原刺槐林不同组分生态化学计量关系研究 [J]. 土壤学报, 2014, 51(1): 133–142. doi: 10.11766/trxb2012112 80492.]
[24] TERZAGHI M, MONTAGNOLI A, DI IORIO D, et al. Fine-root carbon and nitrogen concentration of European beech (L) in Italy Prealps: Possible implications of coppice conversion to high forest [J]. Front Plant Sci, 2013, 4: 192. doi: 10.3389/fpls.2013. 00192.
[25] MA Y Z, ZHONG Q L, JIN B J, et al. Spatial changes and influencing factors of fine root carbon, nitrogen and phosphorus stoichiometry of plants in China [J]. Chin J Plant Ecol, 2015, 39(2): 159–166. [马玉珠, 钟全林, 靳冰洁, 等. 中国植物细根碳、氮、磷化学计量学的空间变化及其影响因子 [J]. 植物生态学报, 2015, 39(2): 159–166. doi: 10.7521/cjpe.2015.0015.]
[26] LIU X J, ZHANG Y, HAN W X, et al. Enhanced nitrogen deposition over China [J]Nature, 2013, 494(7438): 459–462. doi: 10.1038/nat ure11917.
[27] LI W B, JIN C J, GUAN D X, et al. The effects of simulated nitrogen deposition on plant root traits: A meta-analysis [J]. Soil Biol Biochem, 2015, 82: 112–118. doi: 10.1016/j.soilbio.2015.01.001.
[28] YUAN Z Y, CHEN H Y H, REICH P B. Global-scale latitudinal patterns of plant fine-root nitrogen and phosphorus [J]. Nat Commun, 2011, 2(1): 344. doi: 10.1038/ncomms1346.
[29] REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude [J]. Proc Natl Acad Sci USA, 2004, 101(30): 11001–11006. doi: 10.1073/pnas.0403588101.
[30] WARDLE D A, WALKER L R, BARDGETT R D. Ecosystem pro- perties and forest decline in contrasting long-term chronosequences [J]. Science, 2004, 305(5683): 509–513. doi: 10.1126/science.109 8778.
[31] HAN W X, FANG J Y, GUO D L, et al. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China [J]. New Phytol, 2005, 168(2): 377–385. doi: 10.1111/j.1469-8137.2005.01530.x.
[32] AERTS R, DE CALUWE H, BELTMAN B. Is the relation between nutrient supply and biodiversity co-determined by the type of nutrient limitation? [J]. Oikos, 2003, 101(3): 489–498. doi: 10.1034/j.1600- 0706.2003.12223.x.
[33] GÜSEWELL S. N:P ratios in terrestrial plants: Variation and func- tional significance [J]. New Phytol, 2004, 164(2): 243–266. doi: 10. 1111/j.1469-8137.2004.01192.x.
[34] YU Q, ELSER J J, HE N P, et al. Stoichiometric homeostasis of vascular plants in the Inner Mongolia grassland [J]. Oecologia, 2011, 166(1): 1–10. doi: 10.1007/s00442-010-1902-z.
[35] JOSLIN J D, GAUDINSKI J B, TORN M S, et al. Fine-root turnover patterns and their relationship to root diameter and soil depth in a14C- labeled hardwood forest [J]. New Phytol, 2006, 172(3): 523–535. doi: 10.1111/j.1469-8137.2006.01847.x.
Difference of Fine Root Nutrients and Stoichiometric Characteristics BetweenSecondary Forest and Natural Forest in Subtropical China
CHEN Ming, WANG Weiwei, CHENG Huizi, CHEN Rong, CAO Lirong, WANG Xiaohong, CHEN Guangshui, YAO Xiaodong*
(School of Geographical Science, Key Laboratory for Humid Subtropical Eco-Geographical Processes of the Ministry of Education, Fujian Normal University, Fuzhou 350007, China)
In order to understand the effects of human disturbance on forest nutrient utilization and biogeo- chemical cycling, the stoichiometric characteristics of fine roots insecondary forest and natural forest and their variation trend with soil depth (0-80 cm) were studied. The results showed that the main effect of stand and soil depth on fine root stoichiometry was significant by mixed linear model, but the interaction effect was not significant. The contents of N and P in fine roots of secondary forest were significantly lower than those in natural forest, while the C content, C:N and C:P in fine roots were significantly higher than those in natural forest. The C content of fine root at 1-2 mm diameter in secondary forest was significantly higher than that of natural forest. Fine root The N and P contents of fine root in natural and secondary forest decreased significantly with the increase of soil depth, while C:N, C:P, N:P increased with the increase of soil depth, and the change trend of root stoichiometric characteristics with soil layer were similar between secondary forest and natural forest. The contents of N, P and N:P in fine roots of natural and secondary forests were linear with the contents of total N, total P and N:P in soil, respectively. The contents of N, P and N:P in fine roots were significantly correlated with the soil depth, but not with the specific root length (SRL). Therefore, the stoichio- metric characteristics of fine roots did not change with soil depth in the natural forest after human disturbance, but the concentrations of N and P in fine roots decreased significantly.
Secondary forest;;Natural forest; Fine root; Stoichiometry character
10.11926/jtsb.4542
2021-10-11
2022-04-14
福建省杰出青年科学基金项目(2010J06009)资助
This work was supported by the Project for Outstanding Youth Science Research in Fujian (Grant No. 2010J06009).
陈铭,男,硕士研究生,主要从事森林地下生态研究。E-mail: 1759911043@qq.com
E-mail: 874868097@qq.com

