大叶桃花心木树皮化学成分研究
张曼莉, 孙云鹏, 金文芳, 黄宇飞, 徐泽荣, 刘劲松,2, 王国凯,2*
大叶桃花心木树皮化学成分研究
张曼莉1, 孙云鹏1, 金文芳1, 黄宇飞1, 徐泽荣1, 刘劲松1,2, 王国凯1,2*
(1. 安徽中医药大学药学院,中药研究与开发安徽省重点实验室,合肥 230012;2. 安徽省中医药科学院药物化学研究所,合肥 230012)
为了解大叶桃花心木()树皮的化学成分,采用硅胶、凝胶、制备液相等手段分离、纯化,从其树皮提取物中分离得到9个化合物。根据理化性质及波谱数据,鉴定化合物结构分别为香草酸(1)、东莨菪素(2)、大黄素甲醚(3)、3,4,5-三甲氧基苯基--d-吡喃葡萄糖苷(4)、(+)-儿茶素(5)、5′-甲氧基异落叶松脂素-9′---d-吡喃木糖苷(6)、南烛木树脂酚-9′---d-吡喃木糖苷(7)、豆甾醇(8)、豆甾醇-3---d-吡喃葡萄糖苷(9)。除化合物5外,其余化合物为首次从该植物中分离。细胞毒活性试验表明化合物均无显著的细胞毒活性。
大叶桃花心木;化学成分;分离鉴定;细胞毒活性
大叶桃花心木()为楝科(Meliaceae)桃花心木属植物,别名美洲红木,树高约为30~40 m,属于常绿大乔木[1],其直根系发达,抗风力强,生长迅速,原产于美洲热带至亚热带地区,是热带广泛栽培的珍贵用材树种[2],于十九世纪末由墨西哥引入中国。据研究表明,大叶桃花心木的种子主要可用于治疗高血糖、高血压等疾病[3];树干部分可被用作珍贵木材[4]。随着对大叶桃花心木活性成分研究的深入,研究者们从其根、茎、叶、果实和种子等部位分离得到多种化学成分,其中以柠檬苦素类化合物为主,具有抗炎[5]、细胞毒[6–7]、拒食[8]等生物活性;同时,人们也从被一直视作为废料的大叶桃花心木树皮中分离得到酚类成分,研究表明其成分具有抗氧化、治疗2型糖尿病等活性作用[9–11]。目前对大叶桃花心木树皮的化学成分及相关生物活性研究较少,因此为了继续深入了解大叶桃花心木,寻找活性成分,发掘更多的药用价值, 本研究在前期对果实化学成分研究基础上[7,12–13], 继续研究了大叶桃花心木树皮的化学成分,并对化合物进行细胞毒活性测定。
1 材料和方法
1.1 仪器和材料
Bruker AM-400、DRX-500、Avance III 600型核磁共振谱仪(德国布鲁克公司);Waters AutoSpec Premier P776、Xevo TQ-S质谱仪测定(美国Waters公司); Waters1525型高效液相色谱仪(美国Waters公司)。柱层析硅胶:100~200、200~300目(青岛海洋化工厂); 反相硅胶Lichroprep Rp-18 (40~75m)型(日本Fuju Silysia化学公司);Sephadex LH-20型(GE公司)。
植物材料于2015年采自广州,经安徽中医药大学方成武教授鉴定为楝科(Meliaceae)植物大叶桃花心木()的茎皮。
1.2 提取和分离
大叶桃花心木树皮7.5 kg,粉碎,甲醇浸泡, 回收提取液,残渣用80%乙醇回流提取3次,浓缩, 合并浸膏,得1 200 g干膏。硅胶柱色谱[二氯甲烷-甲醇,100:0~0:100,(下同)]梯度洗脱,得7个部位T1~T7。组分T2经硅胶柱色谱(石油醚-乙酸乙酯,20:1~0:100)梯度洗脱,得5个亚组分T21~T25。组分T21经硅胶柱(石油醚-乙酸乙酯, 20:1~1:1)梯度洗脱,得化合物8 (60.5 mg);组分T24经常压ODS色谱柱(甲醇-水,50:50~100:0)梯度洗脱, 得6个亚组分T241~T246;组分T241经硅胶色谱(二氯甲烷-丙酮,50:0~2:1)梯度洗脱后,再经Sephadex LH-20柱色谱(氯仿-甲醇,1:1)纯化后得到化合物2 (12.4 mg);组分T3经MCI柱色谱(甲醇-水,40:60~100:0)梯度洗脱,得9个亚组分T31~T39。组分T32经硅胶柱色谱(二氯甲烷-甲醇, 50:0~2:1)梯度洗脱,得3个亚组分T321~T323, 组分T321经Sephadex LH-20柱色谱(氯仿-甲醇,1:1)纯化后得化合物1 (8.3 mg); T4组分中洗出黄色针状结晶,反复重结晶后得到化合物3 (23.5mg);组分T4经硅胶柱色谱(二氯甲烷-甲醇,30:0~1:1)梯度洗脱,得8个亚组分T41~T48。组分T44经硅胶柱色谱(二氯甲烷-甲醇,100:0~1:1)梯度洗脱, 得7个亚组分T441~T447,组分T443经Sephadex LH-20柱色谱(甲醇)纯化得到化合物9 (14.3 mg);组分T45经Sephadex LH-20柱色谱(甲醇)分离得到3个亚组分T451~T453,组分T453经Sephadex LH-20柱色谱(甲醇)纯化得到化合物5 (35.8 mg)和3个亚组分T4531~T4533;组分T4533经高效液相色谱(甲醇-水, 30:70~49:51, 45 min)制备得到化合物4 (11.2 mg, t=12 min)、7 (18.6 mg, t= 17.9 min)和6 (9.4 mg, t=19.8 min) (图1)。
1.3 结构鉴定
化合物1 淡黄色油状液体,溶于氯仿、甲醇等溶剂。ESI-MS: 191.0 [M + Na]+;1H NMR (400 MHz, CD3OD):7.43 (1H, m, H-2), 7.41 (1H, d,= 8.0 Hz, H-6), 6.86 (1H, d,= 8.0 Hz, H-5), 3.83 (3H, s, -OCH3)。以上数据与文献[14]报道一致,故鉴定为香草酸。
化合物2 淡黄色针状结晶(氯仿),溶于氯仿、甲醇等溶剂。ESI-MS: 193.0 [M + H]+;1H NMR (400 MHz, CDCl3):7.60 (1H, d,= 9.2 Hz, H-4), 6.92 (1H, s, H-5), 6.85 (1H, s, H-8), 6.26 (1H, d,= 9.6 Hz, H-3);13C NMR (125 MHz, CDCl3):161.5 (C-2), 113.4 (C-3), 143.4 (C-4), 107.5 (C-5), 149.7 (C-6), 150.2 (C-7), 103.2 (C-8), 144.0 (C-9), 111.5 (C-10), 56.4 (6-OCH3)。以上数据与文献[15]报道一致,故鉴定为东莨菪素。
化合物3 黄色针状结晶,溶于氯仿、丙酮等溶剂。EI-MS: 284.2 [M]+;1H NMR (400 MHz, CDCl3):12.31 (1H, s, 8-OH), 12.11 (1H, s, 1-OH), 7.62 (1H, br s, H-4), 7.36 (1H, d,= 2.6 Hz, H-5), 7.08 (1H, br s, H-2), 6.68 (1H, d,= 2.6 Hz, H-7), 3.93 (3H, s, 6-OCH3), 2.45 (3H, s, 3-CH3);13C NMR (125 MHz, CDCl3):165.2 (s, C-1), 124.5 (d, C-2), 148.5 (s, C-3), 121.3 (d, C-4), 108.2 (d, C-5), 166.6 (s, C-6), 106.8 (d, C-7), 162.5 (s, C-8), 190.8 (s, C-9) 182.1 (s, C-10), 135.3 (s, C-11), 113.7 (s, C-12 , C-13), 133.2 (s, C-14), 22.2 (q, 3-CH3), 56.1 (q, 6-OCH3)。以上数据与文献[16]报道一致,故鉴定为大黄素甲醚。
化合物4 白色粉末,溶于甲醇、DMSO等溶剂。[α]D20−8.6° (0.1, MeOH), EI-MS: 346.3 [M]+;1H NMR (400 MHz, CD3OD):6.51 (2H, s, H-2, 6), 4.83 (1H, d,= 7.2 Hz, H-1′), 3.94 (1H, dd,= 2.0, 12.0 Hz, H-2′), 3.83 (6H, s, 3,5-OCH3), 3.72 (3H, s, 4-OCH3), 3.68 (1H, m, H-3′), 3.48~3.45 (3H, m, H-4′, 5′, 6′);13C NMR (150 MHz , CD3OD):156.2 (s, C-1), 96.2 (d, C-2, 6), 154.9 (s, C-3, 5), 134.5 (s, C-4), 103.3 (d, C-1′), 75.1 (d, C-2′), 78.2 (d, C-3′), 71.8 (d, C-4′), 78.6 (d, C-5′), 62.9 (t, C-6′), 56.7 (q, 3,5-OCH3), 61.4 (q, 4-OCH3)。以上数据与文献[17]报道一致, 故鉴定为3,4,5-三甲氧基苯基--d-吡喃葡萄糖苷。
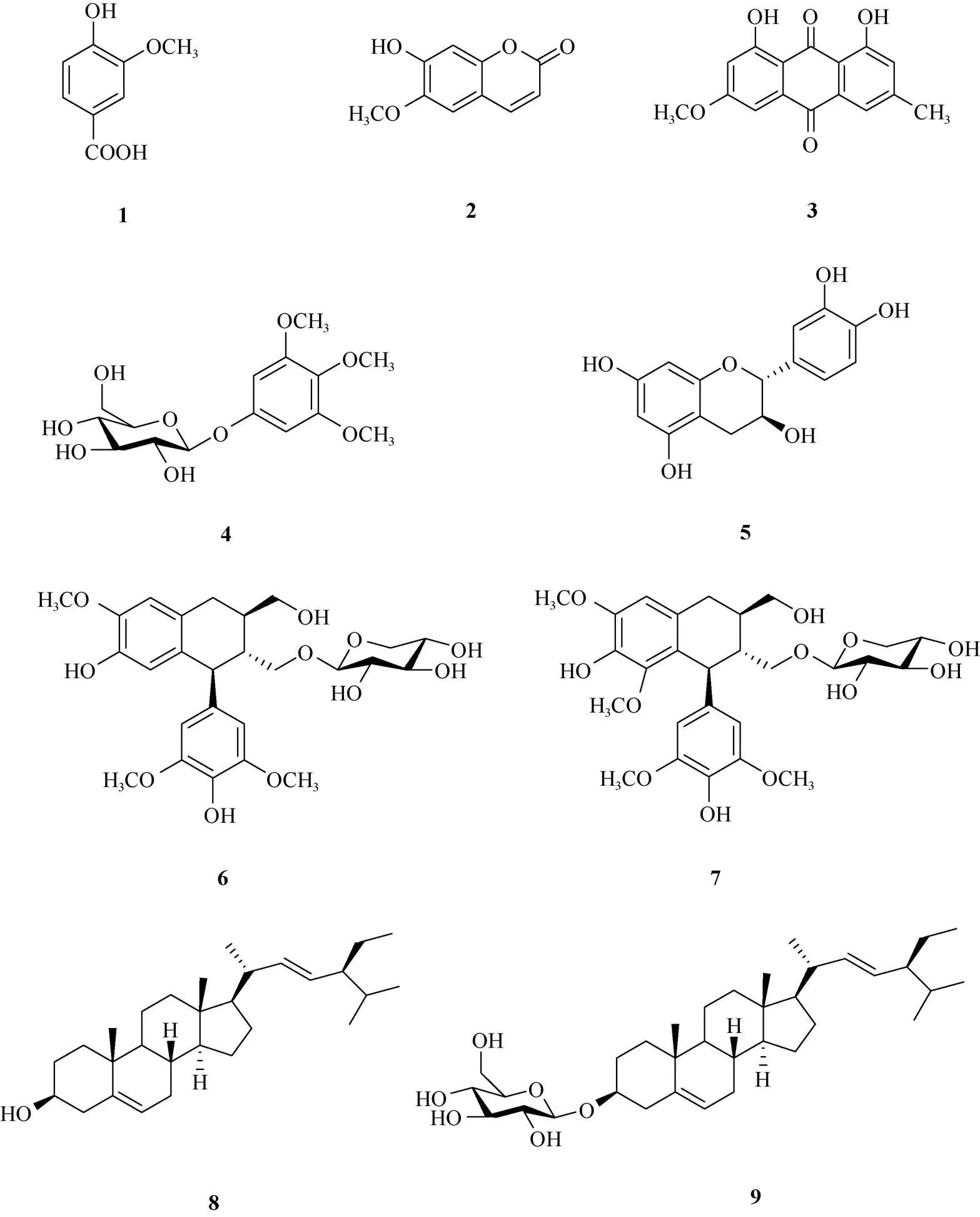
图1 化合物1~9的结构
化合物5 白色粉末,溶于甲醇、DMSO等溶剂。[α]D20+10.2° (0.1, MeOH), ESI-MS: 289.2 [M − H]−;1H NMR (400 MHz, DMSO-d):6.74 (1H,s, H-2′), 6.70 (1H, d,= 8.0 Hz, H-6′), 6.60 (1H, d,= 8.0 Hz, H-5′), 5.90 (1H, br s, H-8), 5.72 (1H, br s, H-6), 4.52 (1H, d,= 7.6 Hz, H-2), 3.86 (1H, m, H-3),2.65 (1H, dd,= 5.2, 16.0 Hz, H-4a ), 2.38 (1H, dd,= 8.0, 16.0 Hz, H-4b);13C NMR (125 MHz, DMSO-d):81.9 (d, C-2), 66.3 (d, C-3), 27.7 (t, C-4), 156.2 (s, C-5), 95.1 (d, C-6), 156.4 (s, C-7), 93.9 (d, C-8), 155.3 (s, C-9), 99.1 (s, C-10), 130.6 (s, C-1′), 114.5 (d, C-2′), 144.8 (s, C-3′, 4′), 115.1 (d, C-5′), 118.5 (d, C- 6′)。以上数据与文献[18]报道一致,故鉴定为(+)-儿茶素。
化合物6 白色粉末,溶于甲醇、DMSO等溶剂。[α]D20+0.5° (0.1, MeOH), ESI-MS: 545.3 [M + Na]+;1H NMR (DMSO-d, 400 MHz):6.60 (1H, s, H-6), 6.43 (1H, s, H-2′, 6′), 6.10 (1H, s, H-3), 4.44 (1H, m, H-7′), 4.06 (1H, d,= 10.8 Hz, H-1″), 3.71 (3H, s, 3-OCH3), 3.69 (6H, s, 3′, 5′-OCH3), 2.73 (2H, m, H-7), 1.90 (1H, m, H-8′), 1.72 (1H, m, H-8);13C NMR (125 MHz, DMSO-d):127.0 (s, C-1), 132.5 (s, C-2), 116.1 (d, C-3), 144.0 (s, C-4), 145.5 (s, C-5), 111.8 (d, C-6), 32.6 (t, C-7), 37.4 (d, C-8), 62.5 (t, C-9), 135.8 (s, C-1'), 106.6 (d, C-2′, 6′), 147.8 (s, C-3′, 5′), 133.5 (s, C-4′), 46.2 (d, C-7′), 43.8 (d, C-8′), 67.1 (t, C-9′), 104.7 (d, C-1″), 73.4 (d, C-2″), 76.6 d, C-3″), 69.6 (d, C-4″), 65.7 (t, C-5″), 55.4 (q, 5-OCH3), 55.9 (q, 3′, 5′-OCH3)。以上数据与文献[19]报道一致,故鉴定为5′甲氧基异落叶松脂素9′---d-吡喃木糖苷。
化合物7 白色粉末,溶于甲醇、DMSO等溶剂。[α]D20+3.9° (0.1, MeOH), ESI-MS: 575.1 [M + Na]+;1H NMR (400 MHz, CD3OD):6.59 (1H, s, H-6), 6.45 (1H, s, H-2′, 6′), 4.41 (1H, d,= 6.8 Hz, H-7′), 4.23 (1H, d,= 7.6 Hz, H-1″), 3.87 (3H, s, 3- OCH3), 376 (6H, s, 3′, 5′-OCH3), 3.36 (3H, s, 5- OCH3), 2.73~2.66 (2H, m, H-7), 2.07 (1H, br s, H-8′), 1.73 (1H, br s, H-8);13C NMR (125 MHz, CD3OD):130.1 (s, C-1), 126.4 (s, C-2), 147.6 (s, C-3), 138.9 (s, C-4), 148.6 (s, C-5), 107.7 (d, C-6), 33.9 (t, C-7), 40.4 (d, C-8), 65.9 (t, C-9), 139.4 (s, C-1′), 106.8 (d, C-2′, 6′), 148.9 (s, C-3′, 5′), 134.4 (s, C-4′),43.0 (d, C-7′), 46.7 (d, C-8′), 70.9 (t, C-9′), 105.5 (d, C-1″), 74.9 (d, C-2″), 78.0 d, C-3″), 71.2 (d, C-4″), 67.0 (t, C-5″), 60.0 (q, 3-OCH3), 56.8 (q, 3′, 5′-OCH3), 56.5 (q, 5- OCH3)。以上数据与文献[19]报道一致,故鉴定为南烛木树脂酚9′---d-吡喃木糖苷。
化合物8 白色粉末,溶于氯仿、丙酮等溶剂。[]D20−8.1° (0.1, MeOH), ESI-MS: 435.8 [M + Na]+;1H NMR (400 MHz, CDCl3):5.29 (1H, s, H- 6), 5.01 (1H, m, H-23), 3.45 (1H, m, H-3), 0.99 (3H, s, H-19), 0.78 (3H, d, H-29), 0.70 (3H, d, H-27)。以上数据与文献[20]报道一致,故鉴定为豆甾醇。
化合物9 白色粉末,溶于甲醇、DMSO等溶剂。[]D20−28.2° (0.1, MeOH), ESI-MS: 597.9 [M + Na]+;1H NMR (400 MHz, DMSO-d):5.33 (1H, br s, H-6), 4.92~4.88 (2H, m, H-22, 23), 4.22 (1H, d,= 8.0 Hz, H-1′), 3.63 (1H, m, H-3), 0.96 (3H, s, H-19), 0.79~0.91 (12H, m, H-21, 26, 27, 29), 0.66 (3H, s, H-18);13C NMR (150 MHz, DMSO-d):36.9 (t, C-1), 27.9 (t, C-2), 76.9 (d, C-3), 38.3 (t, C-4), 140.5 (s, C-5), 121.7 (d, C-6), 31.4 (t, C-7), 31.5 (d, C-8), 49.6 (d, C-9), 36.3 (s, C-10), 20.6 (t, C-11), 39.1 (t, C-12), 41.9 (s, C-13), 56.2 (d, C-14), 23.9 (t, C-15), 25.4 (t, C-16), 55.5 (d, C-17), 11.7 (q, C-18), 19.8 (q, C-19), 35.5 (d, C-20), 18.7 (q, C-21), 138.1 (d, C-22), 128.7 (d, C-23), 45.2 (d, C-24), 29.1 (d, C-25), 19.2 (q, C-26), 19.0 (q, C-27), 29.3 (t, C-28), 11.7 (q, C-29), 100.8 (d, C-1′), 73.5 (d, C-2′), 76.8 (d, C-3′), 70.1 (d, C-4′), 76.8 (d, C-5′), 61.1 (t, C-6′)。以上数据与文献[20]报道一致,故鉴定为豆甾醇-3---d-吡喃葡萄糖苷。
1.4 抗肿瘤活性
采用MTT法测定9个化合物分别对人肝癌细胞株(SMMC-7721)、人宫颈癌细胞株(Hela)、人结肠癌细胞株(SW620)、人肺癌细胞株(A549)、人乳腺癌细胞系(MDA-MB-231)的细胞毒活性。结果表明各化合物并未表现出明显的细胞毒活性。
2 结果和讨论
本研究对大叶桃花心木的树皮进行了化学成分研究,分离出9个单体化合物,包括芳香化合物、香豆素、黄烷醇、蒽醌、木脂素、甾醇等化合物, 分别鉴定为香草酸(1)、东莨菪素(2)、大黄素甲醚 (3)、3,4,5-三甲氧基苯基--d-吡喃葡萄糖苷 (4)、(+)-儿茶素 (5)、5′-甲氧基异落叶松脂素9′---d-吡喃木糖苷 (6)、南烛木树脂酚9′---d-吡喃木糖苷 (7)、豆甾醇 (8)、豆甾醇-3---d-吡喃葡萄糖苷 (9)。除化合物5外,其余化合物为首次从该植物中分离得到。9个化合物对5种癌细胞株均未表现出明显的细胞毒活性。
在有关大叶桃花心木的化学成分研究中,除了广泛存在于楝科植物中的柠檬苦素外[21],不同部位的化学成分存在差异。果实和种子中含有三萜、香豆素、甾醇和脂肪酸类成分[11,22–23];树叶中含有挥发油等[24]成分;茎和根等主干部分中则发现了少量酮、黄酮、木脂素、三萜、甾体、聚乙炔以及邻苯二甲酸衍生物等其他类型成分[6,18,25–26]。本研究从大叶桃花心木树皮中分离得到一系列酚类化合物,丰富了大叶桃花心木中非柠檬苦素化合物的类型和数量。尽管这些成分的细胞毒性实验为阴性, 但是在以往的研究中,部分化合物存在着显著的生物活性,例如东莨菪素与儿茶素均具有比较强的抗肿瘤活性[27–28]。目前对大叶桃花心木的研究大部分围绕柠檬苦素类成分及其活性探究展开,因此为了尽可能多的发掘大叶桃花心木的药用价值,有必要对其他类型成分的分离产物进行进一步的活性探索。本研究丰富了大叶桃花心木的化学成分,为大叶桃花心木树皮的成分研究提供了一定的参考意义。
[1] XIE G G, HUANG S M. The resources of meliaceae plants in Hainan Island and their exploitation [J]. Trop Geogr, 1991, 11(4): 313–319. [谢国干, 黄世满. 海南岛楝科植物资源及其开发利用 [J]. 热带地理, 1991, 11(4): 313–319. doi: 10.13284/j.cnki.rddl.002127.]
[2] ZOU L L, JIA X R. Bibliometrical analysis of endangered tree species of[J]. S China For Sci, 2019, 47(4): 38–44. [邹璐璐, 贾小容. 濒危树种大叶桃花心木的文献计量分析 [J]. 南方林业科学, 2019, 47(4): 38–44. doi: 10.16259/j.cnki.36-1342/s.2019. 04.009.]
[3] GOH B H, KADIR A H.cytotoxic potential ofKing seeds against human carcinoma cell lines [J]. J Med Plant Res, 2011, 5(8): 1395–1404.
[4] HUSEIN I, SADIYO S, NUGROHO N, et al. Electrical properties of Indonesian hardwood case study:,and[J]. Wood Res, 2014, 59(4): 695–704.
[5] CHEN L C, LIAO H R, CHEN P Y, et al. Limonoids from the seeds ofand their anti-inflammatory activities [J]. Molecules, 2015, 20(10): 18551–18564. doi: 10.3390/molecules2010 18551.
[6] MI C N, WANG H, CHEN H Q, et al. Polyacetylenes from the roots ofKing [J]. Molecules, 2019, 24(7): 1291–1299. doi: 10.3390/molecules24071291.
[7] PAMPLONA S G S R, ARRUDA M S P, CASTRO K C F, et al. Phragmalin limonoids fromand their anti- feedant assay against mahogany predator [J]. J Braz Chem Soc, 2018, 29(8): 1621–1629. doi: 10.21577/0103-5053.20180033.
[8] FALAH S, SUZUKI T, KATAYAMA T. Chemical constituents frombark and their antioxidant activity [J]. Pak J Biol Sci, 2008, 11(16): 2007–2012. doi: 10.3923/pjbs.2008.2007. 2012.
[9] MASENDRA M, PURBA B A V, LUKMANDARU G, et al. Anti- oxidant activity ofking bark extracts [J]. Wood Res, 2021, 66(1): 57–70. doi: 10.37763/wr.1336-4561/66.1.5770.
[10] OBOH G, ADEBAYO A A, ADEMOSUN A O. Effects of water extrac- table phytochemicals of mahogany () and axle- wood () stem bark on some enzymes implicated in erectile dysfunction and type-2 diabetes [J]. J Food Biochem, 2017, 41(6): e12430. doi: 10.1111/jfbc.12430.
[11] SUN Y P, ZHU L L, LIU J S, et al. Limonoids and triterpenoid from fruit of[J]. Fitoterapia, 2018, 125: 141–146. doi: 10.1016/j.fitote.2018.01.004.
[12] LIU J S, ZHU L L, WANG G K, et al. Studies on chemical constituents from the fruit of[J]. J Chin Med Mat, 2016, 39(7): 1530–1535. [刘劲松, 朱莉莉, 王国凯, 等. 向天果化学成分研究 [J]. 中药材, 2016, 39(7): 1530–1535. doi: 10.13863/j.issn1001- 4454.2016.07.020.]
[13] ZHU L L, WANG G K, LIU J S, et al. Gas chromatography-mass spectrometry analysis of fatty acids in fruit of[J]. J Anhui Univ Chin Med, 2014, 33(3): 85–86. [朱莉莉, 王国凯, 刘劲松, 等. 向天果脂肪酸成分的气相色谱-质谱分析 [J]. 安徽中医药大学学报, 2014, 33(3): 85–86. doi: 10.3969/j.issn.2095-7246.2014. 03.029.]
[14] LIU P, DENG R X, DUAN H Q, et al. Chemical constituents from roots of[J]. China J Chin Mat Med, 2009, 34(7): 867–870. [刘普, 邓瑞雪, 段宏泉, 等. 糙苏根的化学成分研究 [J]. 中国中药杂志, 2009, 34(7): 867–870. doi: 10.3321/j.issn:1001-5302. 2009.07.017.]
[15] ZHOU W, WANG X, FU S H, et al. Chemical constituents of[J]. Chin Pharm J, 2017, 52(1): 25–30. [周雯, 王霞, 付思红, 等. 羊耳菊的化学成分研究 [J]. 中国药学杂志, 2017, 52(1): 25–30. doi: 10.11669/cpj.2017.01.005.]
[16] LIU Y, ZHANG Y H, SHI R B. Studies on the chemical constituents in herb of[J]. China J Chin Mat Med, 2005, 30(14): 1086–1088. [刘颖, 张援虎, 石任兵. 薄荷化学成分的研究[J]. 中国中药杂志, 2005, 30(14): 1086–1088. doi: 10.3321/j.issn:1001-5302. 2005.14.009.]
[17] ACHENBACH H, BENIRSCHKE G. Joannesialactone and other compounds from[J]. Phytochemistry, 1997, 45(1): 149–157. doi: 10.1016/S0031-9422(96)00777-7.
[18] MI C N, MEI W L, LI W, et al. Chemical constituents from the roots ofKing [J]. J Trop Subtrop Bot, 2017, 25(6): 610– 616. [米承能, 梅文莉, 李薇, 等. 大叶桃花心木根的化学成分研究 [J]. 热带亚热带植物学报, 2017, 25(6): 610–616. doi: 10.11926/jtsb. 3754.]
[19] CHENG W, XU W D, ZHU C G, et al. Glycosides from[J]. China J Chin Mat Med, 2015, 40(6): 1102–1107. [程伟, 许文东, 朱承根, 等. 信宜润楠中的苷类成分 [J]. 中国中药杂志, 2015, 40(6): 1102–1107. doi: 10.4268/cjcmm20150622.]
[20] ZHANG X Q, QI J, YE W C, et al. Chemical constituents from[J]. J China Pharm Univ, 2004, 35(5): 404–405. [张晓琦, 戚进, 叶文才, 等. 苍耳茎化学成分的研究 [J]. 中国药科大学学报, 2004, 35(5): 404-405. doi: 10.3321/j.issn:1000-5048.2004. 05.005.]
[21] MOGHADAMTOUSI S Z, GOH B H, CHAN C K, et al. Biological activities and phytochemicals ofKing [J]. Molecules, 2013, 18(9): 10465–10483. doi: 10.3390/molecules1809 10465.
[22] CHEN J J, HUANG S S, LIAO C H, et al. A new phragmalin-type limonoid and anti-inflammatory constituents from the fruits of[J]. Food Chem, 2010, 120(2): 379–384. doi: 10. 1016/j.foodchem.2009.09.093.
[23] CHEN J J, CHO J Y, HWANG T L, et al. Benzoic acid derivatives, acetophenones, and anti-inflammatory constituents from[J]. J Nat Prod, 2008, 71(1): 71–75. doi: 10.1021/np 0704349.
[24] SOARES M G, BATISTA-PEREIRA L G, FERNANDES J B, et al. Electrophysiological responses of female and male(Zeller) toessential oils [J]. J Chem Ecol, 2003, 29(9): 2143–2151. doi: 10.1023/A:1025694720727.
[25] WU S F, LIN C K, CHUANG Y S, et al. Anti‐hepatitis C virus activity of 3‐hydroxy caruilignan C fromstems [J]. J Viral Hepat, 2012, 19(5): 364–370. doi: 10.1111/j.1365-2893.2011. 01558.x.
[26] MI C N, LI W, CHEN H Q, et al. Two new compounds from the roots of[J]. J Asian Nat Prod Res, 2019, 21(10): 1005–1012. doi: 10.1080/10286020.2018.1488831.
[27] WEI L J, ZHOU J P, DAI Y. Progress in the study of natural product scopoletin [J]. Strait Pharm J, 2009, 22(4): 10–13. [魏丽娟, 周金培, 戴岳. 天然产物东莨菪素的研究进展 [J]. 海峡药学, 2009, 22(4): 10–13. doi: 10.3969/j.issn.1006-3765.2009.04.003.]
[28] QIAO X Y, CHEN D, LIU Z H. Advances in synergistic mechanism of tea catechins on cancer chemoprevention [J]. J Food Sci Biotechnol, 2021, 40(2): 1–9. [乔小燕, 陈栋, 刘仲华. 茶叶儿茶素的癌症化学预防增效机制研究进展 [J]. 食品与生物技术学报, 2021, 40(2): 1–9. doi: 10.3969/j.issn.1673-1689.2021.02.001.]
Chemical Constituents from Barks of
ZHANG Manli1, SUN Yunpeng1, JIN Wenfang1, HUANG Yufei1, XU Zerong1, LIU Jinsong1,2, WANG Guokai1,2*
(1. School of Pharmacy,Anhui University of Chinese Medicine, Anhui Province Key Laboratory for Research & Development of Chinese Medicine, Hefei 230012, China; 2. Department of Medicinal Chemistry, Anhui Academy of Chinese Medicine, Hefei 230012, China)
To understand the chemical constituents ofbarks, nine compounds were isolated and purified from bark extracts by using silica gel, gel and MPLC. Based on the physicochemical properties and spectral data, their structures were identified as vanillic acid (1), scopoletin (2), physcion (3), 3,4,5-trimeth- oxyphenyl--d-glucopyranoside (4), (+)-catechin (5), (+)-5′-methoxy-isolariciresinol-9′---dxylopyranoside (6), lyoniresinol-9′---d-xylopyranoside (7), stigmasterol (8), stigmasterol-3---d-glucopyranoside (9).Except for compound 5, the remaining compounds were isolated from this plant for the first time. The cytotoxicity assay showed that none of the compounds had significant cytotoxic activities.
; Chemical constituent; Isolation and identification; Cytotoxic activity
10.11926/jtsb.4539
2021-09-30
2022-03-22
安徽省自然科学基金项目(2008085MH289);安徽省高校优秀青年人才支持计划重点项目(gxyqZD2019035)资助
This work was supported by the Project for Natural Science in Anhui (Grant No. 2008085MH289), and the Key Project for College Outstanding Young Talents in Anhui (Grant No. gxyqZD2019035).
张曼莉(1995年生),女,硕士研究生,研究方向为天然药物化学。E-mail: manli501@163.com
E-mail: wanggk@ahtcm.edu.cn

