单环刺螠体腔液细胞的流式分布及抗菌活性研究
黄 栋,杨林彤,焦绪栋,秦 松,蒲 洋
(1.鲁东大学农学院,山东烟台 264025;2.中国科学院烟台海岸带研究所,山东烟台 264003;3.烟台大学生命科学学院,山东烟台 264005)
据推测,海洋无脊椎动物占海洋中动物总量的90%以上[1],大部分种类动物体内的体腔液或血液细胞尚未明确功能。目前普遍认为体腔液细胞是海洋无脊椎动物天然免疫防御系统的重要组成部分,具有清除感染[2]、吞噬异物[3-4]、分泌免疫因子(如C1q凝菌因子[5]、凝集素[6]、棘色素-A[7-8]等)、修复创伤组织[9]等功能。
海洋无脊椎动物体腔液或血细胞尚缺乏统一的分类标准[10]。在部分贝类[11-13]、虾类[14]、螃蟹[15-16]血液细胞的研究中,透明细胞(hyalinocyte)和颗粒细胞(granulocyte)被认为是普遍存在的主要细胞类群。刘东武等[11]和许秀芹等[12]将中国蛤蜊、太平洋牡蛎等8种常见双壳贝类的血淋巴细胞分为大颗粒细胞、小颗粒细胞和透明细胞;李光友等[14]和Martin等[15]将中国对虾和2种单肢虾的血淋巴细胞分为大颗粒细胞、小颗粒细胞及透明细胞。Bodammer[16]和胡锦丽等[17]将蓝蟹和中华绒螯蟹的血淋巴细胞分为颗粒细胞、透明细胞及半颗粒细胞。
单环刺螠(Urechisunicinctus)是环渤海及北太平洋区域特有的一种海洋低等无脊椎动物。作为一种新兴的养殖品种,它具有较高的营养和经济价值[18-19]。单环刺螠无心脏、血管等循环系统分化,推测其体腔液及体腔液细胞具有营养物质输送、免疫防御等功能。目前对单环刺螠的研究较少。笔者利用密度梯度离心结合流式细胞术对单环刺螠体腔液细胞进行聚类分析,并对其体腔液细胞的抗菌/杀菌活性进行测定,旨在为单环刺螠育苗养殖过程中的病害防控提供基础理论支撑。
1 材料与方法
1.1 试验材料购买市售活力较强、体表无明显损伤的单环刺螠,平均体重(25.36±5.12)g;置于50 L海水暂养池暂养7 d,池底铺设15~20 cm洁净海沙,温度18~20 ℃,适量曝气,不饲喂。
1.2 体腔液细胞的流式分布随机取单环刺螠3只,先用70%乙醇擦拭体表消毒,将含EDTA-2K(0.1 mg/mL)的无菌注射器沿身体纵向刺入,抽取1 mL红色体腔液并混匀。用无菌PBS缓冲液按说明书配制Percoll工作液,在10 mL离心管中依次加入浓度40%、35%、26%、20%、16%的1 mL Percoll工作液,形成不连续密度梯度。在最上层加入1 mL体腔液,4 ℃、2 500 r/min离心30 min[20-21]。离心结束后小心将形成的细胞层分别吸出并收集备用。
取不同梯度离心层,使用流式细胞仪FACSAria(美国BD,Becton Dickinson)进行检测,检测前向角散射光(forwardscatter,FSC)和侧向角散射光(sidescatter,SSC)。试验数据使用CELL Quest软件处理。获取细胞数为10 000个,分别以FSC和SSC为横、纵坐标绘图,从门水平上圈出各个细胞亚群。
1.3 样品预处理
1.3.1细菌悬浊液的制备。从-80 ℃冰箱中取出实验室保存的枯草芽孢杆菌(ATCC W0825)、大肠杆菌(ATCC 25922)菌种,分别接种至5 mL LB液体培养基中,37 ℃摇床培养过夜。将菌液5 000 r/min离心5 min,弃上清,沉淀用PBS洗涤,上述步骤重复3次,再用PBS重悬,并调节细菌浓度至1×107CFU/mL,备用。
1.3.2体腔液细胞的制备。用0.1 mg/mL肝素钠浸润后的1.5 mL无菌注射器从海肠体腔中采集1 mL体腔液,将体腔液于4 ℃、1 500 r/min下离心30 min,弃上清,沉淀用无菌生理盐水(0.9 g NaCl,100 mL H2O)洗涤,上述步骤重复3次,再用L-15液体培养基重悬,并调节细胞浓度至1×106CFU/mL,备用。
1.4 溶血试验参照秦真东[22]的方法测定枯草杆菌和大肠杆菌对体腔细胞的溶血情况。取0.5 mL的体腔细胞溶液,分别与0.5 mL枯草芽孢杆菌和大肠杆菌悬液混匀,室温孵育,分别于孵育后不同时间点取样,3 800 r/min 离心5 min后取200 μL上清液加到96孔酶标板中,置于酶标仪404 nm处检测吸光值。
1.5 抗菌活性测定
1.5.1呼吸爆发水平测定。
1.5.1.1活性氧(ROS)水平的检测。参照单环刺螠呼吸肠ROS检测的方法[23],取0.5 mL单环刺螠体腔细胞悬液与0.5 mL终浓度1×105CFU/mL 的枯草芽孢杆菌和大肠杆菌悬液混匀,28 ℃孵育 30 min。按1‰比例加入DCFH-DA探针,37 ℃、80 r/min下避光孵育60 min。4 ℃、3 400 r/min下离心10 min,用PBS缓冲液(pH 7.4)洗涤3次,重悬后置于96孔荧光酶标板。使用荧光酶标仪(Fluoroskan Ascent FL,Thermo)设置激发波长488 nm、发射波长525 nm,检测吸光值。
取0.5 mL单环刺螠体腔细胞悬液分别与0.5 mL不同浓度(1×105~3×105CFU/mL)的大肠杆菌悬浊液混合,按照同样方法测定吸光值。
1.5.1.2一氧化氮水平的测定。参照张梦兰等[24]对一氧化氮的检测方法,将单环刺螠体腔液细胞悬液与枯草芽孢杆菌、大肠杆菌(终浓度为1×107CFU/mL)按体积比1∶1加入96孔酶标板中,各50 μL。28 ℃孵育30 min;加入100 μL gress A,37 ℃孵育10 min后再加入100 μL gress B,37 ℃孵育10 min后,使用酶标仪检测540 nm处的吸光值。
取50 μL单环刺螠体腔细胞悬液分别与50 μL不同浓度(1×107~3×107CFU/mL)的大肠杆菌悬浊液混合,按上述同样方法测定吸光值。
1.5.2抗菌活性测定。参照Du等[25]的方法将1 mL单环刺螠体腔细胞悬液分别与枯草芽孢杆菌和大肠杆菌(1×105CFU/mL)28 ℃温育60 min。先将处理后的混合液进行10倍稀释,再涂布于LB固体培养基表面,28 ℃过夜培养后计算平皿上细菌菌落数量。以生理盐水作为阴性对照。
2 结果与分析
2.1 体腔液细胞分布前期采用显微观察的方法分析单环刺螠体腔液细胞分布,发现单环刺螠体腔液细胞主要由红色颗粒细胞、白色透明细胞等构成。
利用Percoll不连续密度梯度离心可将单环刺螠体腔液细胞主要分为3层(图1):红色颗粒细胞主要集中在20%~26%的Percoll工作液中;20%的Percoll工作液以近圆状、细胞内充满颗粒的红色细胞为主,内含少量无色透明细胞;26%的Percoll工作液以近圆状、充满颗粒的红色细胞为主,含少量的透明细胞;白色透明细胞主要分布在16%和35%~40%的Percoll工作液。16%的Percoll工作液以小型近圆状透明细胞为主,同时含有少量的红色颗粒细胞;35%和40%的Percoll工作液多为近圆状、大透明细胞及极少数红色颗粒细胞。
各密度层细胞群体的流式细胞分析结果如图2所示。通过与完整体腔液细胞对比,根据其FSC和SSC特性,将体腔液细胞分为3个亚群(图3):R1 亚群的SSC值最小,表明细胞的颗粒程度最低,主要为白色透明细胞;R3亚群的FSC 和 SSC 值均较大,表明细胞体积较大且含颗粒较多,主要为红色颗粒细胞;R2 亚群细胞的体积和颗粒程度处于 R1 和 R3 亚群之间,主要为半颗粒细胞。

注:A.16%的Percoll工作液;B.20%的Percoll工作液;C.26%的Percoll工作液;D.35%的Percoll工作液;E.40%的Percoll工作液。Note:A.16% Percoll solution;B.20% Percoll solution;C.26% Percoll solution;D.35% Percoll solution;E.40% Percoll solution.图1 体腔液细胞Percoll不连续密度梯度离心图Fig.1 Percoll discontinuous density gradient centrifugation results of coelomocytes
2.2 溶血试验试验结果表明,测试菌对体腔液细胞有一定的溶血效果。其中大肠杆菌引起的溶血现象较为迅速,混合后10 min即可形成明显的溶血现象,随时间的延长,溶血现象受到抑制(图4A);枯草芽孢杆菌引起的体腔液细胞溶血现象较为迟缓,但随时间的延长,溶血现象持续发生(图4B)。由此推测,单环刺螠体腔液细胞对大肠杆菌有一定的耐受能力。
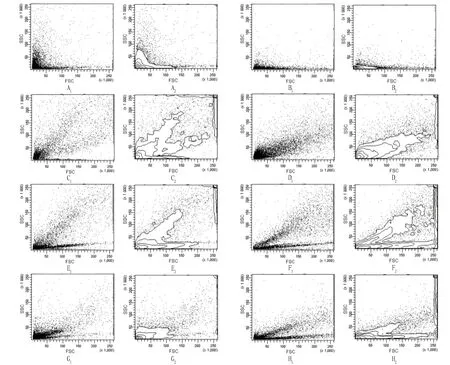
注:A1和A2分别为EDTA-2K溶液FSC和SSC双参数散点图和等高线图; B1和B2分别为Percoll工作液FSC和SSC双参数散点图和等高线图; C1和C2分别为体腔液细胞FSC和SSC双参数散点图和等高线图; D1和D2为16%Percoll工作液FSC和SSC双参数散点图和等高线图; E1和E2分别为20%Percoll工作液FSC和SSC双参数散点图和等高线图; F1和F2分别为26%Percoll工作液FSC和SSC双参数散点图和等高线图; G1和G2为35%Percoll工作液FSC和SSC双参数散点图和等高线图; H1和H2分别为40%Percoll工作液FSC和SSC双参数散点图和等高线图。Note:A1 and A2 were FSC and SSC dual-parameter scatter plot and contour map of EDTA-2K respectively;B1 and B2 were FSC and SSC dual-parameter scatter plot and contour map of Percoll origninal solution respectively;C1 and C2 were FSC and SSC dual-parameter scatter plot and contour map of coelomic fluid cells respectively;D1 and D2 were FSC and SSC dual-parameter scatter plot and contour map of 16% Percoll solution respectively;E1 and E2 were FSC and SSC dual-parameter scatter plot and contour map of 20% Percoll solution respectively;F1 and F2 were FSC and SSC dual-parameter scatter plot and contour map of 26% Percoll solution respectively; G1 and G2 were FSC and SSC dual-parameter scatter plot and contour map of 35% Percoll solution respectively; H1 and H2 were FSC and SSC dual-parameter scatter plot and contour map of 40% Percoll solution respectively.图2 不同Percoll工作液的流式细胞FSC 和 SSC 双参数散点图和等高线图Fig.2 FSC and SSC dual-parameter scatter plot and contour map of flow cytometry in different Percoll solution
2.3 抗菌活性
2.3.1呼吸爆发水平测定。分别测定了大肠杆菌、枯草芽孢杆菌刺激后单环刺螠体腔液细胞呼吸爆发水平的变化,结果见图5。结果表明,在与2种细菌共培养后,单环刺螠体腔液细胞产生的活性氧(ROS)水平均高于对照(图5A),一氧化氮(NO)水平亦有所提高(图5B)。随着大肠杆菌浓度的升高,体腔液细胞产生的ROS变化不明显(图5A),但 NO 水平随着大肠杆菌浓度的增加而明显增加(图5B)。
2.3.2抗菌活性分析。将待测菌与单环刺螠体腔液细胞共培养1 h后,利用平板计数法测定了2种细菌的菌落数量,结果见表1。结果显示,体腔液细胞对大肠杆菌有一定的杀伤效果,抑菌率为22.36%;体腔液细胞对枯草芽孢杆菌没有杀伤效果,反而促进了其生长。体腔液细胞组大肠杆菌和枯草芽孢杆菌的存活率分别为77.64%和179.35%。
3 讨论与结论
该试验采用Percoll不连续密度梯度可将单环刺螠体腔液细胞初步可分为3层,但分离效果不明显,推测各层体腔液细胞间比重差异较小,后期有必要选择更好的分离方法或条件。流式细胞术用FSC反映细胞体积大小,SSC反映细胞的颗粒度[26-27]。该研究通过将不同浓度的Percoll细胞层与完整体腔液细胞流式分布图对比,将单环刺螠体腔液细胞聚为红色颗粒细胞、半颗粒细胞和白色透明细胞3个亚群,与贝类、虾类、蟹类等物种分类结果类似[11-12,14-17];海洋无脊椎动物血细胞的种类及其细胞亚群随季节和地点的不同而不同[28-29],单环刺螠是否也存在此现象值得进一步研究。

注:A.FSC 和 SSC 双参数散点图;B.FSC 和 SSC 双参数等高线图。Note:A.FSC and SSC dual parameter scatter plot;B.FSC and SSC dual parameter contour map.图3 单环刺螠体腔液细胞 FSC 和 SSC 双参数散点图及等高线图Fig.3 FSC and SSC dual-parameter scatter plot and contour map of U.unicinctus coelomocytes

注:A.大肠杆菌对单环刺螠体腔液细胞的溶血效果;B.枯草芽孢杆菌对单环刺螠体腔液细胞的溶血效果。Note:A.Hemolytic effect of E. coli on U.unicinctus coelomocytes;B.Hemolytic effect of B.subtilis on U.unicinctus coelomocytes.图4 细菌对单环刺螠体腔液细胞的溶血试验结果Fig.4 Hemolysis experiment results of bacteria on U.unicinctus coelomocytes

注:A.ROS水平;B.NO水平。Note:A.ROS level;B.NO level.图5 2种细菌对单环刺螠体腔液细胞呼吸爆发水平的影响Fig.5 The effects of two kinds of bacteria on the respiratory burst level of U.unicinctus coelomocytes
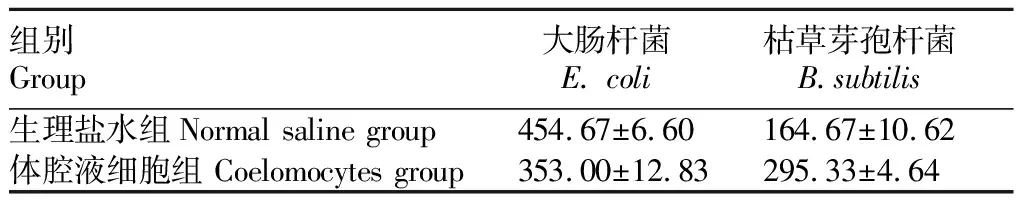
表1 2种细菌菌落数量的测定Table 1 Determination of the colonies of two kinds of bacteria 单位:CFU/mL
单环刺螠的体腔液存在一定的抑菌效果[30]。溶血试验结果表明,大肠杆菌可快速导致体腔液细胞呈现溶血现象,但溶血现象随时间的延长趋于平稳,推测单环刺螠体腔液细胞对大肠杆菌具有一定的耐受性;单环刺螠体腔液细胞对枯草芽孢杆菌的耐受性较差,其溶血现象随时间的延长而持续增加。作为细胞非特异性免疫防御的机制之一,呼吸爆发的过程可产生ROS、NO等对细菌、病毒或其他外来物的刺激,产生应答反应[31-32]。该试验结果显示,体腔液细胞可通过呼吸爆发对细菌进行杀灭,但杀菌效果随细菌浓度的增加而增大有限,而平板计数结果表明单环刺螠体腔液细胞对大肠杆菌具有明显的抑制作用,而对枯草芽孢杆菌的抑制效果不明显。
该研究结合不连续密度梯度离心和流式细胞术对单环刺螠体腔液细胞进行了聚类分析,并初步测试了其体腔液细胞对不同类型细菌的抑菌/杀菌效果。后续仍要对单环刺螠生活周期、时空变化下的体腔液细胞差异进行深入研究,并逐步明确不同类型体腔液细胞的生理功能,以期为单环刺螠的育苗、养殖提供基础理论支撑。

