长链非编码RNA在皮肤纤维化疾病中的研究进展
潘 铃综述,李冬青 吴信峰审校
(1.中国医学科学院皮肤病医院整形美容外科 江苏 南京 210042;2.中国医学科学院皮肤病研究所江苏省皮肤病与性病分子生物学重点实验室 江苏 南京 210042)
皮肤纤维化包括增生性瘢痕、瘢痕疙瘩和系统性硬化症,可导致永久性瘢痕和器官功能损伤,影响患者身心健康和美容外观,目前全球有数十亿人遭受这类疾病的困扰[1-2]。随着高通量测序和生物信息技术的发展,逐年增多的证据表明lncRNA作为一类重要的表观遗传调控分子,可通过多种途径参与皮肤纤维化疾病的发病过程。lncRNA是一类长度大于200个核苷酸的非编码RNA,序列保守性较低,有明显的时空表达特异性,部分lncRNA可翻译形成功能性短肽[3-4]。本文主要回顾lncRNAs与病理性瘢痕、系统性硬化症的相关研究,希望为这类疾病的诊治提供理论依据。
1 lncRNA与瘢痕疙瘩
瘢痕疙瘩是皮肤损伤后的一种异常纤维化疾病。近年来,二代测序和基因微阵列芯片结果显示,瘢痕疙瘩组织成纤维细胞(Keloid fibroblast,KFb)中多种lncRNA表达量发生改变,可通过影响相关信号通路促进瘢痕疙瘩发生,或可成为瘢痕疙瘩治疗的新靶点(见图1)。

图1 lncRNAs和瘢痕疙瘩
1.1 H19:Lu等[5]发现瘢痕疙瘩组织及其来源的成纤维细胞中H19表达明显上调,可靶向miR-214-5p/FGF2轴调控缺氧环境下KFb的糖酵解、迁移和侵袭表型,促进瘢痕疙瘩发生。后有学者陆续发现H19可靶向miR-769-5p/EIF3A[6]、miR-29a/COL1A1[7]及miR-196b-5p/SMAD5轴[8],促进瘢痕疙瘩形成。
1.2 HOXA11-AS:Zhou等[9]发现瘢痕疙瘩组织中HOXA11-AS表达上调,敲低该分子可通过miR-188-5p/VEGFA轴抑制KFb增殖、迁移,促进其凋亡。Wang等[10]发现HOXA11-AS可靶向miR-148b-3p/IGFBP5轴,从而促进KFb增殖、迁移并抑制其凋亡。Zou等[11]发现HOXA11-AS通过miR-182-5p/ZNF217轴,促进瘢痕疙瘩形成,其中ZNF217是TGFβ转录激活因子。
1.3 LINC01116:Yuan等[12]发现LINC01116在瘢痕疙瘩中上调,敲低该分子可通过miR-203/SMAD5轴抑制KFb增殖、迁移、侵袭和细胞外基质产生,诱导其凋亡。后续Wu等[13]发现LINC01116可靶向miR-3141调节TGF-β1/SMAD3信号轴,进而调节KFb增殖、迁移和凋亡。
1.4 Hedgehog信号通路相关lncRNAs:研究发现,Hedgehog信号通路在胚胎发育和创面愈合中发挥关键作用,成纤维细胞中该通路激活可促进胶原合成和向肌成纤维细胞分化[14]。Huang等[15]在瘢痕疙瘩组织中发现30个Hedgehog通路相关lncRNA表达量发生改变,生信分析预测lncRNA AC073257.2和HNF1α-AS1可分别调控上游靶基因Gli和邻近靶基因HNF1α表达,参与瘢痕疙瘩形成。
1.5 Wnt信号通路相关lncRNAs:Wnt信号通路是由配体蛋白质Wnt和膜蛋白受体结合后激发的一组多下游通道的信号转导途径,在瘢痕疙瘩发生中起关键作用[16]。Sun等[17]利用lncRNA微阵列筛选了瘢痕疙瘩中116个wnt靶向基因和69个wnt相关lncRNA,后续生信分析和体外实验验证发现lncRNA CACNA1G-AS1、HOXA11-AS、LINC00312和RP11-91I11.1及与之共表达的6个Wnt基因为瘢痕疙瘩中皮肤相关lncRNA基因对,同时作者认为lncRNA依赖的Wnt基因调控可能协调KFb在增殖和分化间维持微妙的平衡,从而保证细胞良性生长。
1.6 EMT相关lncRNAs:研究证实,缺氧可诱导瘢痕疙瘩角质形成细胞波形蛋白和纤连蛋白上调,上皮标记物E-cadherin下调,细胞侵袭性增加且外观形态呈成纤维细胞样改变,提示瘢痕疙瘩组织存在上皮间质转化(Epithelial-mesenchymal transition,EMT)现象[18]。Chen等[19]利用EMT微阵列芯片检测三组瘢痕疙瘩及其周围正常组织,发现11个EMT相关lncRNAs和16个EMT相关 mRNAs。生信分析提示lncRNA XLOC_000587通过增强ENAH表达促进细胞增殖和迁移,lncRNA AF268386通过上调DDR2促进瘢痕疙瘩侵袭性生长。
上述研究提示,不同lncRNA可通过同种经典信号通路(如:TGFβ/SMAD)促进瘢痕疙瘩发生发展,同一种lncRNA也可海绵吸附多种不同的miRNA,靶向调控不同目标分子或信号通路,参与疾病发生。充分探究瘢痕疙瘩中lncRNA的作用模式将有助于全面认识该病的发病机制,为瘢痕疙瘩的诊断治疗提供潜在的有效靶点。
2 增生性瘢痕与lncRNA
增生性瘢痕(Hypertrophic scar,HS)多继发于皮肤创伤、烧伤、手术等,创伤后HS发生率为40%~70%,烧伤后发生率高达75%[20]。有学者利用微阵列芯片比较HS和正常皮肤的成纤维细胞,发现增生性瘢痕成纤维细胞(Hypertrophic scar fibroblast,HSF)中6 104个lncRNAs和2 952个mRNAs表达发生改变。有学者分析表明,它们参与细胞周期、DNA复制、ECM受体相互作用和TGF-β信号通路等生物过程,提示HS发生机制与差异表达的lncRNAs相关[21],见图2。
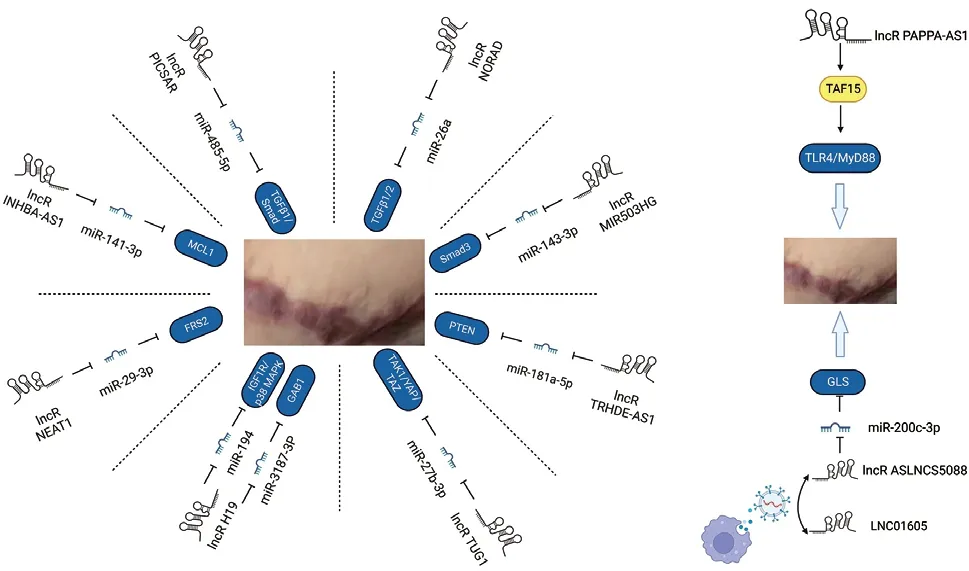
图2 lncRNAs和增生性瘢痕
2.1 lncRNAs靶向miRNA:lncRNA常作为“miRNA海绵”调节目标基因表达,该作用模式可靶向HS中TGFβ/SMAD、PTEN、TAK1/YAP/TAZ、IGF1R/MAPK、FSR、MCL1等分子或通路。先后有学者发现,HS中lncRNA PICSAR通过miR-485-5p激活TGF-β1/Smad通路[22];Wei等[23]发现HS组织和成纤维细胞中lncRNA TRHDE-AS1表达降低,可修饰miR-181a-5p进而抑制PTEN表达,促进HSF增殖、抑制其凋亡;Li等[24]发现lncRNA TUG1通过miR-27b-3p激活TAK1/YAP/TAZ通路,发挥促纤维活性;Liu等[25]发现lncRNA H19可通过miR-194/IGF1R/p38 MAPK轴促进HSF增殖、抑制其增殖;Wu等[26]发现HS中lncRNA NEAT1过表达,敲低该分子可上调miR-29-3p抑制FRS2轴,进而抑制HSF细胞活力、增殖和ECM过度产生;Yang等[27]发现HS中lncRNA INHBA-AS1过表达,敲低该分子后可调控miR-141-3p/MCL1通路,抑制HSF增殖、迁移和细胞外基质分泌。
2.2 lncRNAs靶向蛋白:近年来研究发现,lncRNA可与RNA结合蛋白相互作用,促进HS发生。Fan等[28]发现HSF中lncRNA PAPPA-AS1与TAF15相互作用,上调TLR4/MyD88和TGFβ通路诱导增生性瘢痕发生。其中,TAF15属于FET家族,该家族蛋白广泛表达于多种组织,可与lncRNA相互作用,调控靶基因转录和翻译,参与转录、剪接、miRNA形成和RNA运输等生物过程。
2.3 外泌体来源lncRNAs:巨噬细胞可分为经典激活的M1型和交替激活的M2型,其介导的免疫炎症反应对伤口愈合和瘢痕形成具有重要作用[29]。外泌体属胞外囊泡的一种,可包裹并运输核酸、激素、细胞因子等生物分子,介导细胞间信号传递和生物学功能调控。研究表明,阻断M2巨噬细胞来源富含LINC01605或lncRNA ASLNCS5088的外泌体产生,可抑制M2型巨噬细胞协调成纤维细胞增殖、活化作用[30-31]。其中,M2巨噬细胞外泌体来源的lncRNA ASLNCS5088通过抑制成纤维细胞miR-200c3p调节胞内谷氨酰胺酶表达,该酶对M2型巨噬细胞和成纤维细胞分化起重要作用,从而参与瘢痕形成[31]。
以上报道揭示了lncRNA参与HS发生发展的部分调节机制,即lncRNA可海绵吸附目标miRNA或作用于RNA结合蛋白,进而调控下游信号通路、促进HS发生。此外,lncRNA可由巨噬细胞分泌并包裹于外泌体中,作为细胞间通讯分子,调控成纤维细胞的生物活动。
3 LncRNA与系统性硬化症
系统性硬化症(Systemic sclerosis,SSc)是一种以微血管病变、免疫失调及多器官纤维化为特征的自身免疫性疾病。依据皮肤受累程度,SSc可分为局限性皮肤型系统硬化症(Limited cutaneous systemic sclerosis,lcSSc)和弥漫性皮肤型系统硬化症(Diffused cutaneous systemic sclerosis,dcSSc)[32]。临床常采用改良Rodnan皮肤评分(即mRSS评分)评估患者皮肤硬化程度[33]。近年来,SSc和lncRNAs相关研究逐年增多,主要集中在患者皮损成纤维细胞和外周血单核细胞中,见表1。
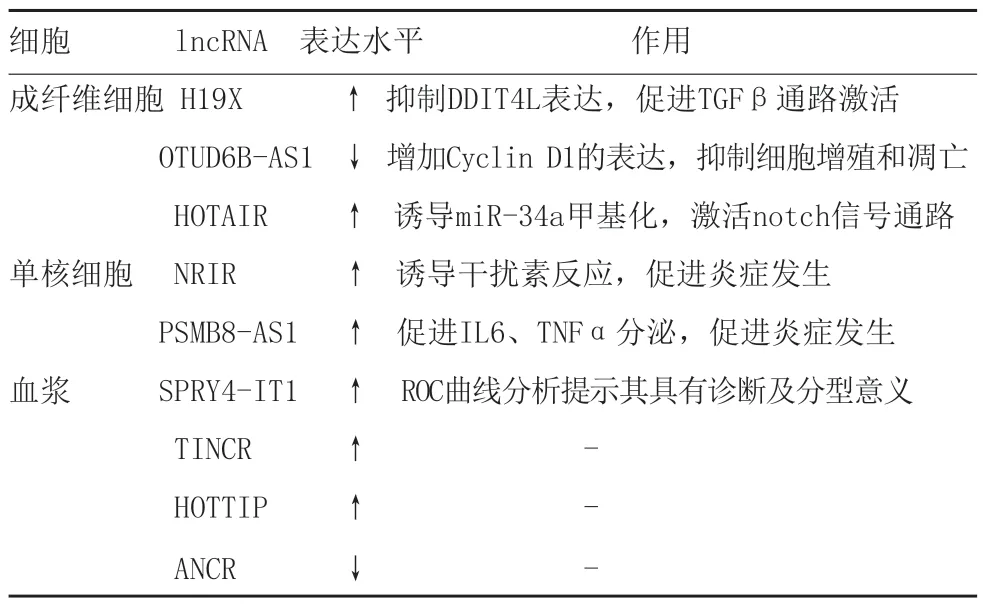
表1 LncRNA和系统性硬化症
3.1 lncRNA与SSc患者皮肤成纤维细胞:有报道称,SSc患者皮损中lncRNA H19X过表达,该分子可作用于DDIT4L上游DNA调控元件,进而抑制DDIT4L表达,阻断其对TGF-β通路的抑制作用,导致细胞外基质合成增多、肌成纤维细胞激活和成纤维细胞凋亡抑制[34]。Takata等[35]发现SSc患者皮损组织lncRNA OTUD6B-AS1表达下调,敲低该分子可增加细胞周期蛋白D表达,阻止细胞DNA修复和进入DNA合成期,进而抑制细胞增殖,同时代偿性抑制细胞凋亡。另有报道称,SSc患者皮损中lncRNA HOTAIR上调,可诱导EZH2特异性甲基化miR-34A,进而激活notch信号通路,促进GLI2转录,诱导胶原蛋白、a-SMA、CTGF表达增多,促进组织纤维化[36]。
3.2 lncRNA与SSc患者外周血单核细胞:既往研究发现,SSc患者中外周血单核细胞增多且浸润受累组织,呈现促炎激活状态和干扰素反应失调,即干扰素刺激基因表达上调[37]近年研究提示lncRNA可调节SSc患者单核细胞中的干扰素反应,促进疾病发生。Mariotti等[38]发现SSc患者单核细胞中lncRNA NRIR表达上调,敲低后干扰素相关趋化因子cxcl10、cxcl11表达减少,SSc外周血单核细胞中NRIR异常调节可能是SSc患者体内异常干扰素反应原因之一。该团队后续发现scc患者单核细胞中lncRNA PSMB8-AS1上调,可促进IL-6和TNFα分泌,而后两种促炎因子在外周血的含量与患者纤维化和疾病严重程度相关,提示lncRNA PSMB8-AS1参与系统性硬化症发生[37]。
3.3 lncRNA在SSc中的诊断价值:目前系统性硬化症诊断和分型主要依赖病史、临床表现、自身抗体谱及组织病理,无有效血清诊断标志分子辅助早期诊断、分级治疗。有报道称,硬皮病患者皮损及血清中lncRNA TSIX上调,敲低该分子可降低I型胶原蛋白mRNA稳定性和表达水平,且TSIX表达量与dcSSc∶lcSSc比率及mRSS评分正相关,提示该分子可作为SSc潜在的诊断标志物[39]。另外,有学者发现SCC患者外周血中lncRNA SPRY4-IT1、TINCR、HOTTIP上调,lncRNA ANCR下调,ROC曲线分析证实SPRY4-IT1最具诊断意义,且弥漫型皮肤受累患者该分子表达量高于局限型,有助于SSc的诊断和分型[40]。
上述研究证实多种lncRNA在SSc患者血液和皮损中上调,可通过靶向目标基因或经典信号通路调控皮肤成纤维细胞及外周血单核细胞的相关生物过程,促进SSc的炎症反应和组织纤维化发生。深入研究lncRNA在系统性硬化症中的具体作用机制可辅助该病的早期诊断和治疗。
4 小结和展望
本文回顾了瘢痕疙瘩、增生性瘢痕、系统性硬化症相关文献中lncRNA差异表达谱和分子调控机制,提示lncRNA可通过多种方式影响成纤维细胞增殖、凋亡、迁移、侵袭及胶原蛋白的异常沉积,进而调控该类疾病进展。随着现代分子生物学技术的进展,这些差异表达的lncRNAs有望成为有效的诊断标志物及基因编辑治疗的靶点。然而,目前尚无令人满意的动物模型,尤其是瘢痕疙瘩,因此实验设计缺乏对该类疾病体内试验的进一步验证,部分降低了基础研究的完整性和结论的可信度。此外,lncRNAs临床应用转化领域还处于早期阶段,其靶向传递、治疗稳定性、不良反应和安全性等方面有待进一步探索。未来仍需扩大研究样本、建立理想动物模型以及开展相关临床试验,以便更科学系统地探索lncRNAs在该类疾病发生发展中确切的生物学角色和临床转化潜力,为皮肤纤维化疾病的诊治带来新的希望。

