蓟马取食诱导的苜蓿代谢物变化
陈 崎,姜晓红,谭 瑶,爽 爽,刘慧杰,代 蕊,特木尔布和,张志强
(1.内蒙古农业大学草原与资源环境学院,内蒙古呼和浩特 010010;2.内蒙古农业大学草原昆虫研究中心,内蒙古呼和浩特 010020)
苜蓿属(Medicago)植物因其适应性强、产量高及品质好等优点,已成为我国乃至全世界畜牧业和乳业发展的重要物质基础。然而,苜蓿生产中会受到各种生物或非生物胁迫,严重影响苜蓿的产量和品质,进而影响苜蓿产业的健康发展。对苜蓿害虫的研究报道显示,苜蓿害虫共计297种[1],其中蓟马已经成为苜蓿生产的主要害虫之一[2]。蓟马通过取食绿色植物的叶、茎、果实和(或)花粉并注入破坏性病毒,导致植物生长受阻、产量下降,并严重影响植物产量[3]。调查发现,在我国苜蓿总产区,大部分苜蓿蓟马虫害发生率在70%以上,最高可达100%[4],蓟马每年造成约10%~30%的产量损失[5]。然而,由于蓟马高度杂食性及其复杂的生活方式,其防治成为农牧业生产中的难题。
在植物与草食性昆虫的长期“斗争”中,植物形成了一套有效的动态防御策略,包括组成型防御策略和诱导型防御策略[6]。与组成型防御相比,诱导型防御在植物体内更常见,在昆虫没有取食植物时,诱导抗性能量利用效率更高,对植物造成的代谢负担更小,是更为经济有效的防御机制[7]。植物被昆虫取食后产生的诱导型防御又包括直接防御和间接防御[8]。研究发现,昆虫取食会导致寄主某些初生代谢物和次生代谢物的积累。初生代谢物主要包括氨基酸、核苷酸、脂质和糖类等[9]。次生代谢物主要包括黄酮类、单宁类、酚类、萜类和生物碱等[10]。王小珊研究发现,在蓟马不同虫口压力下,抗感苜蓿中总酚、总皂苷、木质素和总黄酮的含量均发生显著变化[11]。Cao 等探究不同抗性苜蓿品种对蓟马危害的生理生化响应,得出蓟马危害后显著提高了3个品种的可溶性糖(SS)、游离脯氨酸(Pro)、黄酮、单宁和H2O2含量,显著降低了多酚氧化酶(PPO)和超氧化物歧化酶(SOD)活性(P<0.05)[2]。Tu等通过转录测序发现,蓟马侵染能够诱导类黄酮物质生物合成基因、β-丙氨酸代谢及水杨酸代谢途径相关基因的表达,进而产生诱导抗性[12]。然而,诱导性化学物质的变化随昆虫及寄主的不同而变化[13-14]。笔者所在课题组前期以草原2号、草原4号苜蓿开展抗蓟马机制研究,从形态结构、物理防御等角度探究草原4号的组成型防御机制[15],而对于蓟马取食苜蓿后,苜蓿自身产生的诱导性防御机制的研究尚未深入开展,国内外也无相关报道。
草原2号(M.variaMartin.Caoyuan No.2)感蓟马品种(虫情指数为0.901)、草原4号(M.sativaL.Caoyuan No.4)抗蓟马品种为材料(虫情指数为0.334)[16],分别进行牛角花齿蓟马(Odontothripsloti)接虫和不接虫处理,利用广泛靶向代谢组学技术,分析蓟马取食诱导的苜蓿代谢物变化,从代谢水平探究蓟马取食引起的苜蓿诱导性防御机制,丰富植物诱导性抗虫理论。
1 材料与方法
1.1 材料与试验设计
本研究于2019年在内蒙古农业大学草地资源教育部重点实验室进行。供试苜蓿材料为草原2号、草原4号苜蓿,供试虫源为实验室饲养的牛角花齿蓟马成虫。在人工气候室种植草原2号、草原4号苜蓿各20盆,每盆3株,昼夜平均气温分别控制在(30±5)、(20±5)℃;昼夜相对湿度控制在(55±5)%、(70±5)%,保证所有材料生长环境一致。待苜蓿生长60 d后,进行蓟马接种,分别记为草原2号接种蓟马(2-T)、草原4号接种蓟马(4-T),草原2号未接种蓟马(2-CK)、草原4号未接种蓟马(4-CK)。选择长势一致的牛角花齿蓟马成虫,在苜蓿植株上进行接种,每盆50头,并用防虫网罩住。接种7 d后,选取上述材料相同部位的叶片,送北京百迈克生物科技有限公司进行广泛靶向代谢组分析,3次重复。
1.2 代谢组分析
用于代谢组学分析的样品处理、提取和代谢物检测均在北京百迈克生物科技有限公司按照其标准化程序进行。正离子模式:流动相A:0.1%甲酸水溶液;流动相B:0.1%甲酸乙腈溶液;负离子模式:流动相A:0.1%甲酸水溶液;流动相B:0.1%甲酸乙腈溶液,进样体积为1 μL。
质谱条件:在采集软件[MassLynx V4.2,沃特世科技(上海)有限公司]的控制下,沃特世Xevo G2-XS QTof高分辨质谱仪在全信息串联质谱模式下采集质谱数据。在每个数据采集循环中,可以同时对低碰撞能量(2 V)和高碰撞能量(10~40 V),以0.2 s扫描频率进行双通道数据采集。ESI离子源参数如下:毛细管电压:2 000 V(正离子模式)或-1 500 V(负离子模式);锥孔电压:30 V;反吹气流速:50 L/h;脱溶剂流速:800 L/h;离子源温度:150 ℃;脱溶剂气温度500 ℃[17]。
1.3 代谢组数据分析
利用软件Analyst 1.6.3(AB SCIEX,Ontario,Canada)对质谱数据进行处理。在获得不同样本中代谢物的质谱分析数据后,按峰面积对所有物质的质谱峰进行积分,并对不同样品中相同代谢物的质谱峰进行积分校正。缺失值被认为低于检测限,并用最小记录值进行估算。离子强度通过对数转换归一化,代谢物丰度使用Dunnett检验计算,多重检验由FDR控制。使用正交信号校正偏最小二乘判别分析(OPLS-DA)和投影中的变量重要性投影(VIP)来获得控制和蓟马感染之间的最大差异。VIP>1.0 的代谢物被认为是用于群体区分的差异代谢物。KEGG数据库用于注释和显示差异代谢物。其他分析包括主成分分析(PCA)和通路富集,是通过使用R完成的[18]。
2 结果与分析
2.1 样本质控分析
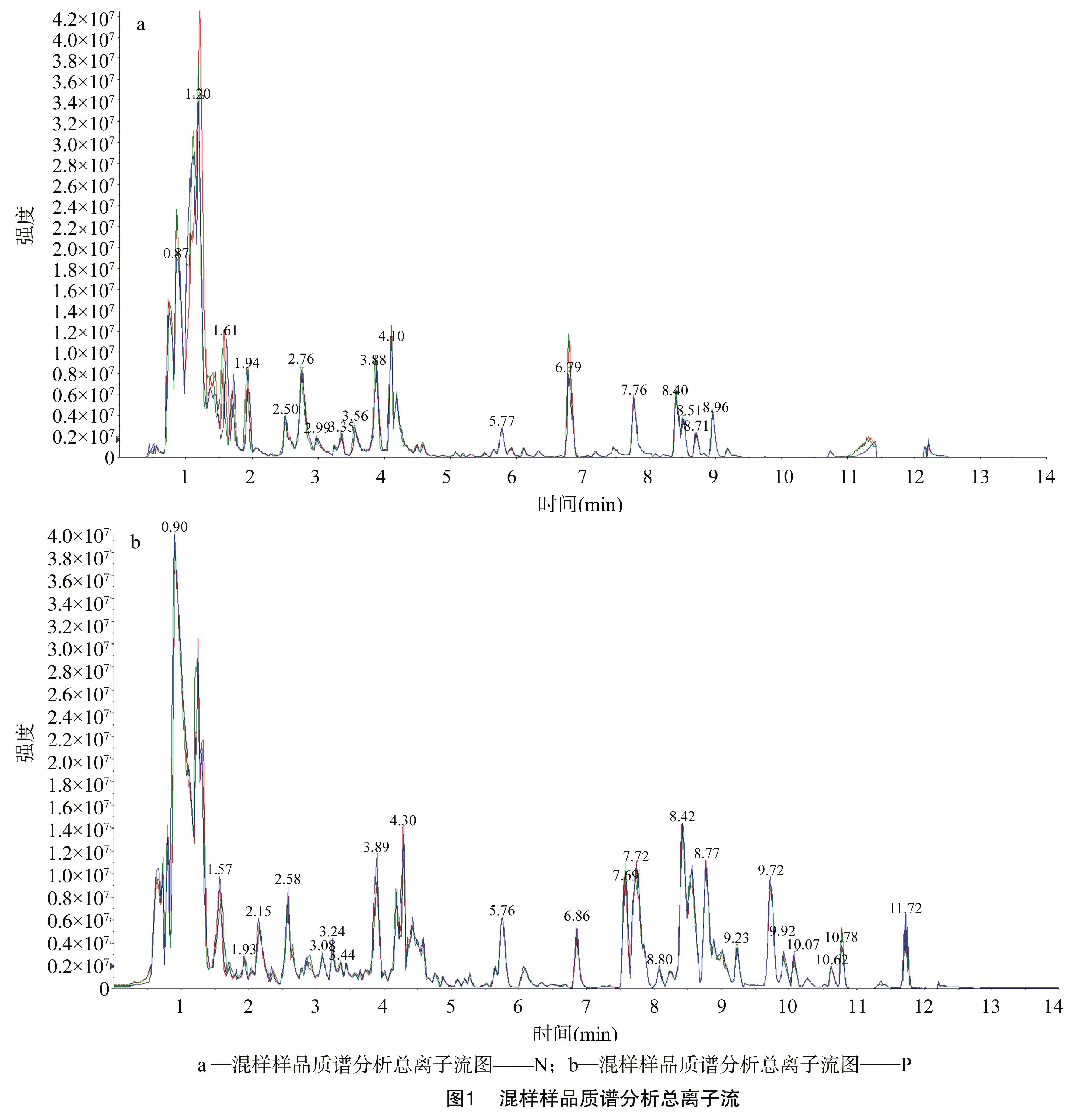
通过混合所有样本提取物制备质控样品,并用于在相同处理方法下分析样本的重复性。本试验在每10个检测分析样本中插入1个质控样本,结果(图1)表明,代谢物检测到的总离子流曲线重叠性高,表明质谱在不同时间检测同一样品时,信号稳定性好。
2.2 总体样本主成分分析
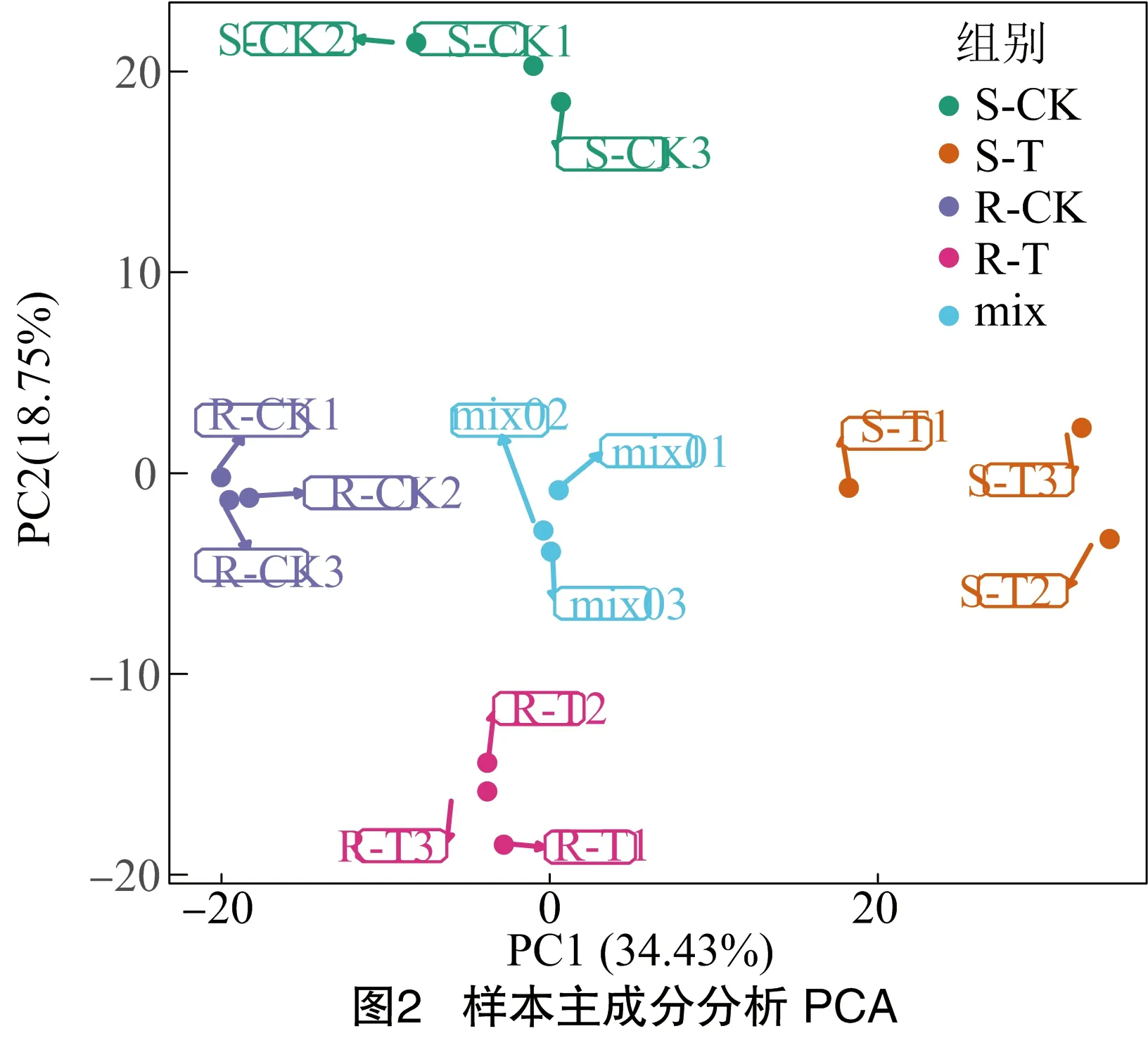
为了解各组样本之间的总体代谢差异以及组内样本之间的变异度,对样本进行PCA分析。如图2所示,第1主成分(PC1)、第2主成分(PC2)共解释了样品之间53.18%的差异。同时,4个不同处理之间分离明显,同一处理的3个重复聚在一起,表明代谢物在组间变化明显,组内重复较好。
2.3 正交偏最小二乘判别分析(OPLS-DA)
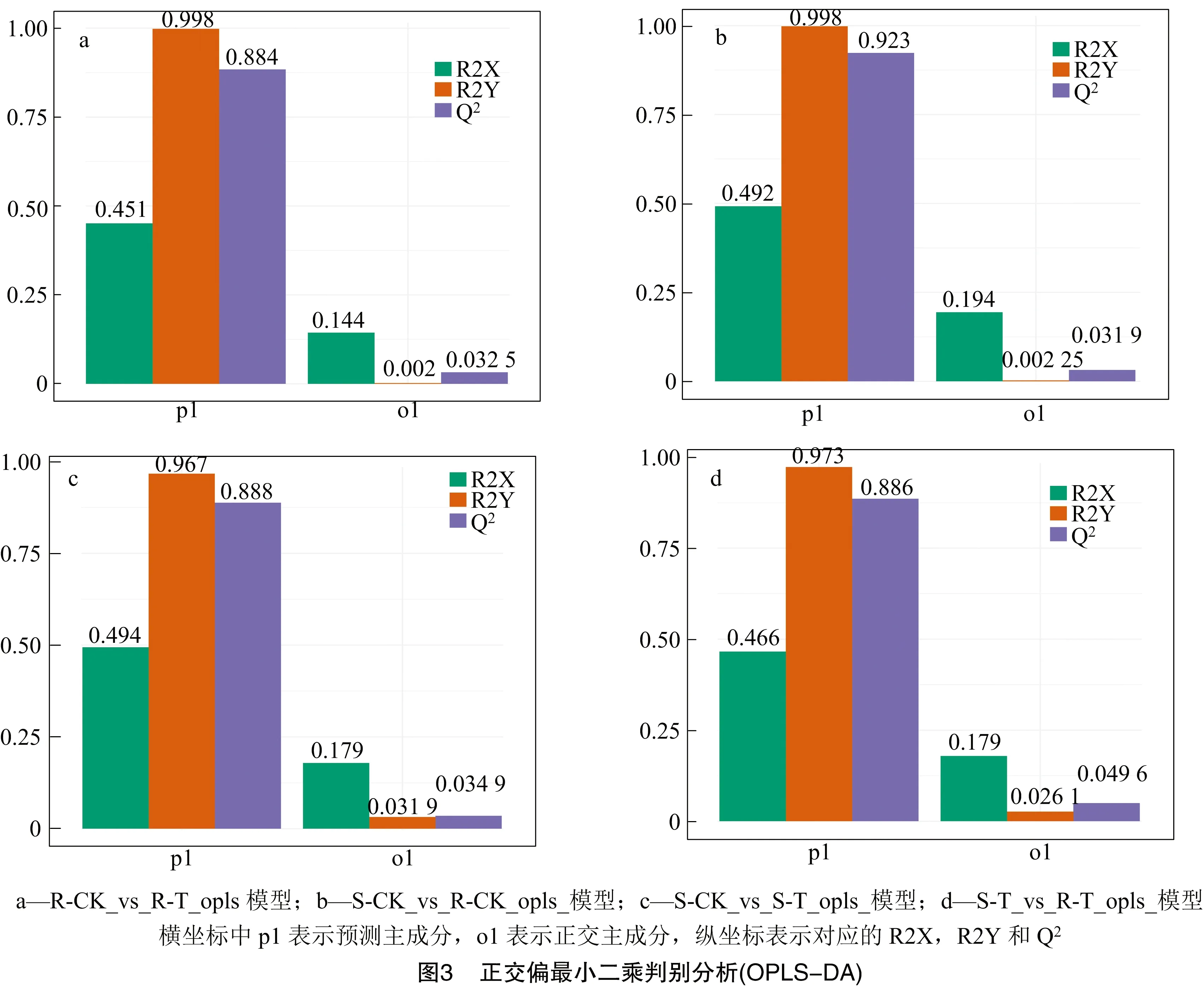
虽然主成分分析可以有效地提取主要信息,但对相关性较小的变量不敏感。正交偏最小二乘判别分析可解决这一问题。与PCA相比,OPLS-DA可以将X矩阵信息分解成与Y有关的信息和无关的信息,通过清除无关差异的方法来筛选差异变量,以最大限度地区分各组,更容易筛选差异代谢物。由图3可得,R-CK_vs_R-T的Q2为0.884;S-CK_vs_R-CK 的Q2为0.923;S-CK_vs_S-T的Q2为0.888;S-T_vs_R-T的Q2为0.886。不同组间的Q2均大于0.5,接近或高于0.9,说明所构建的模型是有效或出色的模型,可用于后续的差异分析。
2.4 蓟马取食诱导的苜蓿差异代谢物筛选
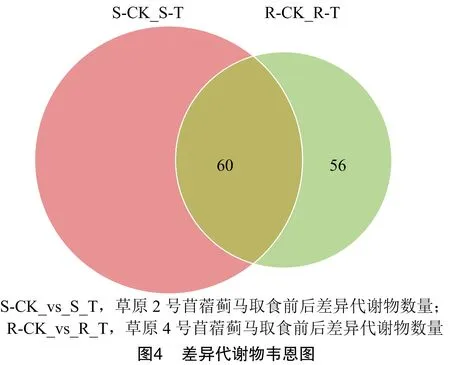
基于正交偏最小二乘判别分析的结果,利用获得的OPLS-DA 模型的变量重要性投影筛选差异代谢物。结果发现,草原2号苜蓿在蓟马取食前后的差异代谢物为178个(S-CK vs S-T),而草原4号苜蓿在蓟马取食前后差异代谢物为116个(R-CK vs R-T)。其中,有60个差异代谢物在2个品种中都受到蓟马取食影响(图4)。为了进一步分析蓟马取食对苜蓿代谢物影响的普遍规律,探究苜蓿诱导性抗蓟马代谢调控机理,笔者所在课题组对这60个差异代谢物进行进一步分析。
通过对共同诱导表达的60个差异代谢物的KEGG功能注释(表1)发现,包括生物碱、氨基酸及衍生物、核苷酸及衍生物、有机酸及衍生物、黄酮类、吲哚及衍生物、苯丙素、花青素、多酚、酚胺、醌类等12大类。其中主要集中在黄酮类化合物(图5),包括黄酮、黄酮类、黄烷酮、黄酮醇和异黄酮,共有31个,约占51%,其次为有机酸及衍生物、苯丙素及氨基酸及衍生物,分别占11%、11%和8%。
在31个黄酮类化合物中,与麦黄酮、槲皮素和木樨草素等相关的24个代谢物蓟马取食以后整体表现为上调,而与白杨素、芹菜苷和芒柄花苷相关的4个化合物在抗虫品种和感虫品种中均表现为下调,只有柚皮苷、芸香柚皮苷和阿福豆苷3个化合物在 S-CK_vs_S-T表现为下调,而在R-CK_vs_R-T表现为上调。此外,7个有机酸及衍生物和7个苯丙素在抗虫品种和感虫品种中均表现为上调;5个氨基酸及衍生物中,N-苯乙酰基-L-谷氨酰胺、苯乙酰甘氨酸等含苯环的氨基酸表现为上调,谷胱甘肽还原型、3-N-甲基-L-组氨酸及γ-L-谷氨酸-L-半胱氨酸等与谷胱甘肽代谢相关的氨基酸及衍生物则下调(表1)。
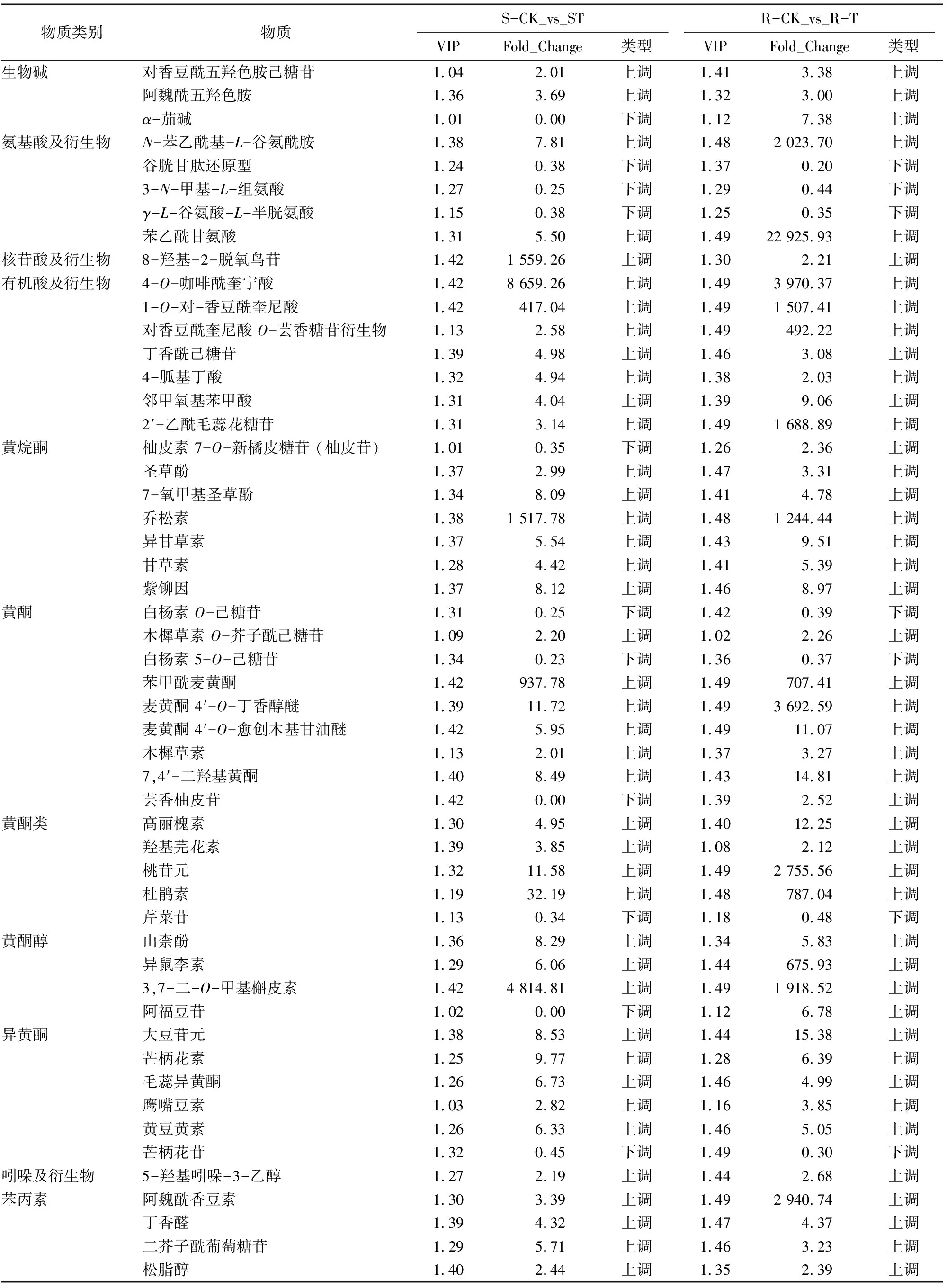
表1 蓟马取食诱导的苜蓿差异代谢物
3 讨论与结论
植物的诱导型防御是植物对病虫的一种重要防御反应,近年来,也受到更多的重视,并从生理生化、代谢调控、生态调控、分子机制等方面取得了系列进展[19-20]。随着生物技术的发展,通过组学技术开展植物抗虫机制研究的相关报道逐年增多[21-22]。代谢组学可以对某一生物体或细胞在特定生理时期的所有低分子量代谢产物进行定性和定量分析。本研究采用广泛靶向代谢组学技术,探究蓟马取食引起的苜蓿诱导性代谢防御反应。
无论是抗虫材料还是感虫材料,昆虫取食都会诱导代谢物或相关基因发生变化,但感虫品种变化更多[12]。本研究中草原2号(感虫)苜蓿在蓟马取食前后差异代谢物178个(S-CK vs S-T),而抗性材料草原4号(抗虫)苜蓿在蓟马取食前后差异代谢物116个(R-CK vs R-T),说明同抗蓟马品种相比,感蓟马品种受蓟马取食诱导的代谢变化更敏感。
研究发现,昆虫取食植物诱导初生代谢物和次生代谢物变化,包括糖类、氨基酸、有机酸、黄酮类、酚类和单宁等[23-24]。为了进一步分析蓟马取食对苜蓿代谢物影响的普遍规律,探究苜蓿诱导性抗蓟马代谢调控机制,笔者所在课题组对蓟马取食引起的抗蓟马品种和感蓟马品种共同变化的60个差异代谢物进行分析。KEGG功能注释发现差异代谢物主要包括黄酮类、生物碱、氨基酸及衍生物、有机酸及衍生物和苯丙素等12大类。
众多报道发现,次生代谢物在诱导性防御中更重要[25-28]。本研究中78%的次生代谢物大多都表现为上调。Burghardt等研究发现,黄酮含量的显著提升与抗虫相关[29]。本研究也发现,蓟马诱导取食代谢物变化也主要集中在黄酮类化合物,说明黄酮类化合物在苜蓿诱导性防御中具有重要作用。研究报道麦黄酮及其衍生物在禾本科植物的抗虫性中有重要的作用[30-31]。本研究中发现,3个麦黄酮相关的化合物均显著上调,说明麦黄酮可能参与了苜蓿的诱导性防御。Bouaziz等研究发现,木樨草素对昆虫取食植物没有影响[32]。但本研究中2个与木樨草素相关的代谢物都上调,推测木樨草素也参与了苜蓿的诱导性抗虫。此外,本研究发现2个与白杨素相关的代谢物和1个芹菜苷无论在抗蓟马品种和感蓟马品种中都表现为下调,在其他研究中暂无相关报道,推测白杨素与芹菜苷可作为苜蓿抗蓟马研究的候选代谢物。
生物碱在植物抗虫中发挥重要作用[33]。张文辉等研究发现,生物碱中的茄碱能够组织马铃薯甲虫取食[34]。本试验结果显示,蓟马取食诱导草原2号和草原4号中α-茄碱、对香豆酰五羟色胺己糖苷、阿魏酰五羟色胺3种生物碱含量均上升,推测生物碱也不利于蓟马的生长发育。
除了次生代谢物,可溶性糖、氨基酸和蛋白质等初生代谢物在植物诱导性防御中也发挥着重要的作用[35-36]。本研究发现除氨基酸及衍生物之外的酸类均表现为上调,说明昆虫取食可能导致酸的增加。谷胱甘肽及其衍生物是植物清除活性氧的一种信号物质[37]。本研究发现3个与谷胱甘肽代谢相关的氨基酸均表现为下调,说明谷胱甘肽对苜蓿的诱导性抗虫也具有重要作用。此外,本研究发现2个含苯环的氨基酸:N-苯乙酰基-L-谷氨酰胺和苯乙酰甘氨酸均表现为上调,推测含苯环的氨基酸可能与苜蓿诱导性抗虫相关。
蓟马取食会诱导代谢物发生变化,但感蓟马品种比抗蓟马品种更敏感。在次生代谢物中,主要集中在黄酮类化合物,包括麦黄酮、木樨草素、白杨素、芹菜苷等,说明它们在苜蓿诱导性防御中可能具有更重要的作用。此外,也包括一些初生代谢物的变化,包括氨基酸及衍生物和有机酸及衍生物等也参与了苜蓿诱导性蓟马防御反应。

