外部因素对钙矾石晶体结构及形貌的影响综述
李妤茜,乔秀臣
(华东理工大学资源与环境工程学院,上海 200237)
0 引 言
钙矾石(3CaO·Al2O3·3CaSO4·32H2O)是通用硅酸盐水泥重要的早期水化产物之一,由铝酸三钙(3CaO·Al2O3)、氢氧化钙(Ca(OH)2)与石膏(CaSO4·2H2O)水合形成,针状形貌的钙矾石晶体相互搭接、互锁,与水化硅酸钙(C-S-H)结合在一起,形成网状结构,既利于早强,又可改变水泥浆体流变性[1-4]。钙矾石也是硫铝酸盐水泥水化的主要产物,由无水硫铝酸钙(4CaO·Al2O3·SO3)在石膏存在条件下水合形成[1,5-8]。钙矾石的形成过程非常复杂,会受到多种环境因素(温度、浓度、杂质离子等)影响,其晶体结构与晶体形貌也会相应地发生变化,进而影响水泥基材料的自应力、抗裂性、收缩补偿、抗腐蚀、抗冻融、抗渗透等性能[9]。国内外关于环境因素对钙矾石晶体结构及性能影响的研究较为分散,没有形成系统、明确的体系。本文针对温度、浓度、杂质离子和合成方法等对钙矾石晶体结构和性能的影响进行了系统性综述,厘清了这些环境因素对钙矾石晶体结构的作用机制,为研究环境因素对钙矾石晶体结构及性能的影响提供了方法论和探索方向,同时也为拓宽钙矾石在胶凝材料中的应用提供了理论基础。
1 钙矾石晶体结构
1.1 钙矾石晶体结构的组成
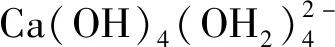

图1 钙矾石晶体结构在(0001)平面上的投影(中心柱平行于Z轴,中心柱间的沟槽中有硫酸根和水分子,基团与水分子位于中心柱之间的间隙)(a)和中心柱的4组钙、铝多面体交叠层示意图(b)[13]Fig.1 Projection of ettringite crystal structure on (0001) plane (the columns are parallel to Z axis,and there are sulfate and water molecules in grooves between columns, groups and water molecules are located in the gap between central columns) (a) and picture of 4 groups of calcium polyhedral and aluminum octahedral overlapping layers of central columns (b)[13]

钙矾石晶体结构的形成一般概括为三个步骤[18]:第一步,形成铝氧八面体(式(1));第二步,钙多面体与铝氧八面体结合形成中心柱(式(2));第三步,硫氧四面体和水分子围绕在中心柱(式(3))组成完整的钙矾石结构。
(1)

(2)
(3)
大部分学者认可钙矾石属于三方晶系,空间群为P31c,单位晶胞分子数Z=2(表1),晶胞参数大致为a0=b0=(1.122±0.002) nm,c0=(2.146±0.001) nm。可以发现,不同合成方法和材料会导致所合成钙矾石晶胞参数存在差异。

表1 钙矾石晶体结构数据Table 1 Ettringite crystal structure data
1.2 钙矾石晶体结构的化学键
钙矾石晶体结构中的化学键主要包括氢键、范德华力、离子—共价键和配位共价键,这些化学键对钙矾石晶体内部结构的稳定起重要作用。
1.2.1 氢键
氢键的形成需要满足两个条件:一是不同分子的H和O之间的距离小于0.245 nm;二是角度O—O—H(受体中的氧—供体中的氧—供体中的氢)应小于30°(图2(a))[25-26]。氢离子体积小,静电场强度大,钙矾石体系中的OH-和H2O分子分别提供H与电负性很大的O发生作用,形成氢键(图2(b))。
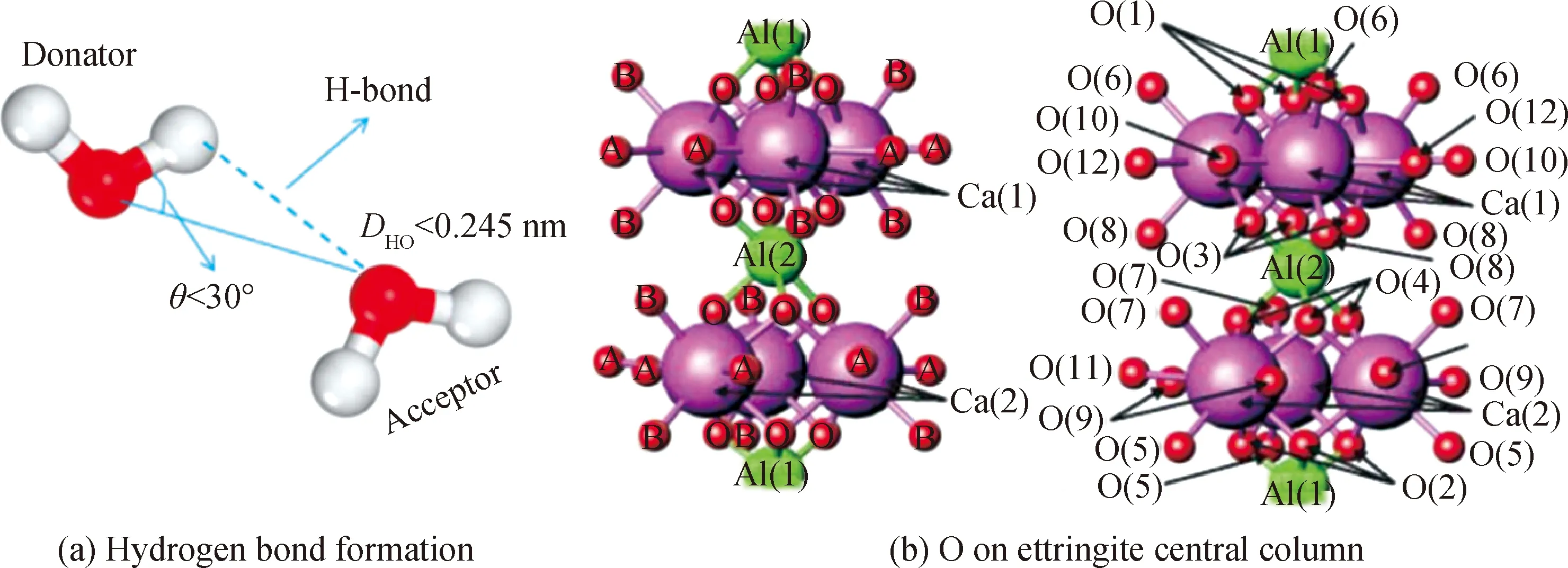
图2 氢键形成示意图与钙矾石中心柱上的O示意图[22,25]Fig.2 Schematic diagram of hydrogen bond formation and O on ettringite central column[22,25]
Moore等[19]通过X射线单晶衍射测试了钙矾石晶体结构中Ca2+、Al3+、S4+以及O2-的排列,但未明确H的位置。Hartman等[22]用TOF中子粉末衍射技术结合Rietveld精修方法研究了钙矾石的晶体结构,用氘代替氢来标记H的位置,降低背景信号,提高信噪比,减少H的非相干散射截面,同时用软约束来处理羟基和水分子,使得在确定H的平衡位置时有更大的自由度,从而精确测定了H的位置并阐明了钙矾石结构中以O为中心的潜在氢键(表2)。

表2 氘化钙矾石(Ca6[Al(OD)6]2(SO3)25.5D2O)晶体基于Rietveld结构精修后的潜在氢键位[22]Table 2 Potential hydrogen bonding sites of deuterated ettringite (Ca6[Al(OD)6]2(SO3)25.5D2O) crystal based on refinement of Rietveld structure[22]
氢键网络的H除了通过可以实验检测外,还可采用分子模拟技术来研究。Tararushkin等[26]通过Lammps软件构建钙矾石模型,采用ClayFF-MOH力场对钙矾石晶体界面的结构和动力学进行了定量计算,期间在ClayFF力场(库仑力、范德华力、键长扩展势能和键角扭曲势能)的基础上增加了金属—O—H(M—O—H)角弯曲项的附加参数值:Mg—O—H、Al—O—H和Si—O—H角。模拟结果显示,在钙矾石晶体结构中存在11种不同的氢键给体-受体对,各种氢键种类、数量和平均寿命汇总于表3。
表3中氢键种类可分为三个部分。第一部分为基础结构部分,由Hw…Os、Hw*…Os和Hh…Ow组成。这三种氢键平均寿命最长,数量最多,将中心柱与沟槽部分、沟槽部分水分子与硫氧四面体以及中心柱中钙多面体与铝氧八面体结构紧密结合在一起,为钙矾石晶体提供结构稳定性。第二部分为水分子部分,由Hw…Ow、Hw*…Ow、Hw…Ow*、Hw*…Ow*组成。水分子与水分子之间形成的氢键平均寿命和数量次于第一部分,在晶体结构中不稳定,容易断裂。第三部分是铝羟基部分,由Hw…Oh、Hw*…Oh、Hh…Ow*、Hh…Os组成。铝羟基中H/O会参与氢键的形成,但形成的氢键平均寿命短,数量趋近于0,对钙矾石晶体结构稳定性的贡献很小。Scholtzov等[27]通过对天然钙矾石矿进行单晶X射线衍射和采用VASP软件DFT法计算验证了钙矾石晶体中钙多面体中水分子的H与硫酸根离子的O形成的氢键强度远远大于铝羟基与水分子之间形成的氢键。

表3 钙矾石晶体中的平均H键数量(n)和寿命(τ)[26]Table 3 Average number of H bonds (n) and lifetime (τ) in ettringite crystals[26]
1.2.2 其他化学键
钙矾石晶体中,结构单位为中性的水分子之间存在微弱的分子键,也称范德华力。Moore等[19]认为,沟槽中的2个H2O分子与中心柱的结合力很弱,主要是靠范德华力连接,很容易从晶体结构中失去。Manzano等[28]还报道过钙矾石晶体结构中存在一种离子—共价键,主要位于铝八面体和钙多面体形成的中心柱。除了上述化学键外,钙矾石晶体结构中硫氧四面体、铝八面体和钙多面体中还存在一些配位共价键。
1.3 钙矾石晶体结构的水
钙矾石晶体(3CaO·Al2O3·3CaSO4·nH2O)在理想状态下含有32个H2O分子,占钙矾石45.9%(质量分数)。水分子对钙矾石晶体结构至关重要,也是氢键形成和正电荷均匀分布的前提[29-30]。钙矾石晶体共有四类结构水:沟槽水、钙多面体副配位水、钙多面体主配位水、铝OH-。结构水在钙矾石晶体中的位置如图3所示,图3(a)为在(1120)投影的钙矾石中心柱,符号A或B代表H2O分子O,A为副配位水,B为主配位水,O代表铝OH-基团O;图3(b)为(0001)投影,2个黑色三角形代表2个沟槽水。

图3 钙矾石晶体结构水位置[31]Fig.3 Water position of ettringite crystal structure[31]
当沟槽水、钙副配位水受到环境因素影响时,会按照占位顺序脱去。由于环境差异,2个沟槽H2O分子可能被吸附在钙矾石晶体表面或者存在于钙矾石晶体缺陷之中,最容易优先脱离。每个钙多面体的形状为三棱柱形,有两个主顶点B和两个附加顶点A,主顶点B上的H2O分子为主配位水,以双键形式与钙原子相连,具有较短的Ca—O键;附加顶点A上的H2O分子为副配位水分子,以单键的形式与钙原子相连,具有较长的Ca—O键[31-33]。在50~55 ℃干燥条件下,钙矾石首先失去12个副配位水,由30个H2O分子变成18个H2O分子。Skoblinskaya等[32]和刘崇熙[34]研究指出钙的副配位水的损失不会改变晶体结构,但是钙多面体的配位数会由8变为6,Ca原子会加强与2个主配位H2O分子和4个铝OH-之间的连接,2个主配位H2O向Ca原子更加靠近,铝八面体的OH-键力得以加强,最终钙多面体由十一面体变成四面楔形体。
当钙副配位水完全脱去后,钙矾石的后续脱水顺序不再是按照占位顺序继续脱水,而是钙矾石会先脱去部分钙多面体的主配位水,随后脱去铝OH-,两部分水交叉脱去。Shimada等[31]通过核磁共振技术发现当钙矾石晶体的沟槽水、钙副配位水共14个H2O分子完全脱去后,再脱去2个H2O分子时,铝八面体的配位数由最开始的6降到5和4。Hartman等[22]利用中子衍射技术测量H2O和OH-的占有率时,发现H2O分子脱去24~25个时,钙配位平均降到4.5左右,铝配位平均降低到3.6左右(表4)。

表4 钙矾石晶体结构中水分子的脱去顺序[22,31]Table 4 Removal sequence of water molecules in crystal structure of ettringite[22,31]
脱除部分主配位水分子后,Ca原子的配位数发生较大改变,中心柱扭曲,晶体结构的长程有序遭到破坏,为了要保持钙多面体中的电荷平衡和中心柱内的短程有序,一些与Ca和Al连接的羟基则脱除,残余H2O和OH-将进行重排;由于钙多面体上的H2O仅与Ca结合,而OH-还连接着Al,因此钙多面体上水分子的结合相对于羟基更为稳固。
2 外部因素对钙矾石晶体结构及形貌的影响
钙矾石晶体结构在水泥等胶凝材料的水化反应中,容易受到所处环境等外部因素的影响。其中反应物离子的过饱和度、温度和杂质离子等外部因素往往会改变钙矾石晶体结构中水分子和氢键的数量,进而改变晶体结构的稳定性,表现为水化反应体系中钙矾石晶体数量减少/增多、形貌改变等现象,对水化体系的性能产生重要影响。此外,科研人员在研究钙矾石晶体结构及形貌时,由于实验合成方法的不同也会产生很多对钙矾石结构认知的不统一。
2.1 反应物离子过饱和度的影响

反应物离子的过饱和度是钙矾石晶体成核和生长的驱动力,当离子过饱和度较低时,如图4(a)所示,钙矾石晶体生长占主导,该阶段离子过饱和度越高晶体生长速率越大,成核速率较低,新生成的钙矾石晶体较少。钙矾石晶体以(0001)面(c轴方向)为主生长面,晶体生长速率越大,钙矾石晶体的长径比越大,长度随着过饱和度的增加逐渐增长。当过饱和度进一步提高时,溶液体系内成核的作用逐渐占据主导地位,大量晶核快速形成,每个单独的晶核只有较少的离子来供其生长,导致新生成的钙矾石晶体尺寸偏小,如图4(b)所示。由于较小的生长速率,主生长面的生长速率和其他晶面差距减小,钙矾石晶体形貌从针状转变为短而小的棱柱状。

图4 在pH值12.5、不同过饱和度条件下,钙矾石晶体的SEM照片[21]Fig.4 SEM images of ettringite crystals at pH value 12.5 and different supersaturation levels[21]
2.2 温度的影响
温度也是影响钙矾石晶体结构的重要环境因素,升高温度可以促进反应物离子的迁移,提高反应速率的同时还会影响钙矾石晶体结构、氢键以及结构水,表现在晶格参数、晶核形成、晶体形貌、溶解度和稳定性等方面。
2.2.1 温度对钙矾石晶胞参数的影响
钙矾石晶体结构中的离子和水分子会随着温度的改变而发生脱离,表现为a、b轴晶格参数增加,c轴晶格参数减小。Hartman等[22]在研究天然钙矾石矿热脱水时,观察到在110 ℃条件下,钙矾石单晶的a轴从1.124 nm下降到0.840 nm,c轴从2.145 nm下降到1.021 nm。Shimada等[31]用天然钙矾石也发现同样的规律,随着钙矾石晶体结构中15个水分子的脱去后,c轴晶胞参数从2.146 nm减小到2.104 nm,a轴晶胞参数从1.122 nm增加到1.152 nm。
与天然钙矾石矿类似,人工合成钙矾石的晶胞参数也会受到温度的影响。Hartman等[22]对人工合成钙矾石进行结构分析,结果显示随着脱水程度的增加,钙矾石晶体结构沿a轴扩张,沿c轴收缩。当钙矾石晶体损失19.6个水分子时,a轴晶胞参数增加0.2%,c轴收缩0.4%。Hall等[38]采用能量色散同步X射线衍射和红外光对钙矾石热分解过程进行分析,发现在70~110 ℃温度条件下,钙矾石晶体a和b晶胞参数随温度的升高显著增加,热膨胀系数在a轴方向为42×10-6K-1,在c轴方向为22×10-6K-1。
无论天然钙矾石矿还是人工合成的钙矾石,温度升高都会导致晶体结构不稳定,结构中的水和部分离子会逐步脱离晶体,表现为a轴方向的拉伸,而在中心柱内部作用力和部分水分子脱去的作用下,c轴出现收缩现象。
2.2.2 温度对钙矾石晶核形成和晶体形貌的影响
温度升高会增加形成钙矾石的反应物离子的碰撞概率,进而促进钙矾石结构中心柱和沟槽部分快速形成,随着反应温度升高,钙矾石晶核迅速形成,晶体生长空间相对常温时受限较大,形成的钙矾石长度明显变短[39-40]。兰蒙等[39]在研究温度对碳硫硅钙石-钙矾石固溶体的影响时,利用SEM-EDS对晶体形貌进行分析。在n(Al)/n(Si)=1 ∶9(摩尔比),20 ℃时,晶体长度为5~6 μm,宽约为0.5 μm;40 ℃条件下晶体长约为4 μm,宽约为0.5 μm。陈凤琴[40]发现常温溶液中可合成长为2~3 μm,宽约为0.5 μm的钙矾石晶体;而50 ℃溶液则合成长为0.5~1.0 μm,宽约为0.1 μm的钙矾石晶体。
当温度继续升高时,晶体的生长速率也会增加,并逐渐大于成核速率。孙奇[41]将Al2(SO)3和Ca(OH)2的混合液从40 ℃加热至90 ℃时,在40~50 ℃时,钙矾石晶体长度从550 nm减小到500 nm,宽度从100 nm减小到50 nm;当温度升高至60~90 ℃时,钙矾石长度逐渐增大,从1 μm增至5 μm,宽度从0.5 μm增至1 μm。当温度升高到足以同时促进钙矾石晶核和晶体生长时,容易得到粗大的杆状晶体。
钙矾石晶体形貌在常温、中温、高温阶段时分别为短棒状、细针状、长杆状,晶体结构长度先减小后增加。当温度升高时,加速了体系内的离子运动和碰撞,促进溶质的传递,有利于钙矾石晶核的生成[42],晶核迅速形成后,占据大部分空间,导致钙矾石晶体生长的空间不足,晶体尺寸变小。随着温度持续增加,钙矾石晶体的生长速率也开始增大,晶体的(0001)面快速生长,长度逐渐增长。当温度升到高温阶段时,晶体的长度和宽度同时增加,生成长杆状的钙矾石晶体。国内外对于不同温度条件下钙矾石晶体形貌的研究已经非常成熟,但对温度如何影响钙矾石晶体中心柱和沟槽形成,进而影响其形貌的研究还较少。
2.2.3 温度对钙矾石溶解度的影响

(4)
(5)
利用钙矾石溶解度随温度增加而增加的性质,可以通过冷却结晶的方法制备钙矾石晶体。Vladu[1]通过此法合成了具有1 ∶100的高纵横比的钙矾石晶体。但这种合成方法是否会对钙矾石晶体结构产生影响还需要更多实验研究。
2.2.4 温度对钙矾石稳定性的影响

环境湿度和温度的共同作用,可以使钙矾石形成不同的分解产物。Mehta等[49-50]通过热力学计算和实验证明钙矾石在湿热条件下的热稳定性大于在干燥环境下。在干燥条件下温度超过93 ℃钙矾石开始发生分解,形成偏钙矾石。在饱和水蒸气条件下,钙矾石在(93±17) ℃以内是稳定的,当温度达到149 ℃才开始分解成AFm[49-50]。Hall等[38]采用0.5 ℃/min的速率将温度从70 ℃升至120 ℃,在1.63 bar饱和水蒸气压下发现,当温度达到(114±1) ℃时,钙矾石发生分解生成AFm、半水石膏,如式(6)所示。

(6)
目前的文献普遍认为钙矾石稳定存在的温度范围在40~50 ℃,在此范围下钙矾石的生成量随温度升高而升高。当温度在60 ℃条件下,钙矾石的生成伴随着部分钙矾石的分解。超过80 ℃后,钙矾石以分解为主,生成量随着温度升高而逐渐降低。钙矾石分解产物与环境温度和湿度密切相关。在干燥/低饱和水条件下,温度升至50~110 ℃时,钙矾石分解为偏钙矾石;在湿热/高饱和水条件下,随着温度逐渐升高,钙矾石稳定性降低,AFm、二水石膏的稳定性逐渐增强。当温度在114 ℃左右时,钙矾石开始分解为AFm和半水石膏,温度继续升高,AFm和二水石膏也会分解。
3.3 杂质离子的影响
3.3.1 减水剂的影响
高效减水剂通常用于改善水泥胶凝材料的流动性,使水泥颗粒具有良好的分散效果。然而减水剂的添加会对钙矾石晶体的形成和生长产生影响,进而改变钙矾石晶体的形貌和数量。
(1)减水剂对钙矾石晶体的作用机制
减水剂对钙矾石晶体一般存在两种作用机制:减水剂基团与构成钙矾石晶体结构离子的反应机制和静电吸附机制。

静电吸附机制与钙矾石晶体结构中自身所带电荷有关。钙矾石晶体的表面电荷通常为正,单位晶胞中有4个Al3+、12个Ca2+和24个OH-,每9.59 nm2产生12 e,从化学计量/结构考虑估计钙矾石的表面电荷密度σ0=1.25 e/nm2[56]。Plank等[57]研究早期水泥水化相的Zeta电位对高效减水剂吸附的影响时,发现钙矾石较高的正Zeta电位会对减水剂产生强烈吸附。Ferrari等[58]指出聚羧酸减水剂会吸附在钙矾石晶体结构表面提供负电荷。减水剂分子上的负电荷基团能通过静电作用快速吸附到带正电荷的钙矾石晶体结构表面,产生静电排斥力破坏溶液中的絮凝结构,这些吸附引起的静电和空间排斥力会阻碍钙矾石颗粒沉淀到水泥熟料表面[59-60]。
(2)减水剂对钙矾石晶体生长的影响
①减水剂类型的影响

图5 钙矾石晶体结构[52,54]Fig.5 Crystal structure of ettringite[52,54]
减水剂支链的类型也会对钙矾石晶体生长造成影响。Meier等[61]发现在相似阴离子电荷量条件下,甲基丙烯酸酯(MPEG-PCE)比烯丙基醚(APEG-PCE)和异戊二烯基醚(IPEG-PCE)对钙矾石晶体尺寸的影响更明显。
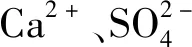
②减水剂阴离子电荷量对钙矾石晶体生长的影响
减水剂阴离子电荷量越多,对钙矾石的吸附作用越强。Ferrari等[58]在实验中观察到阴离子电荷密度高的PC-a比PC-c型减水剂对钙矾石的吸附力强。Meier等[61-62]发现,在同类型聚羧酸减水剂,含有相同侧链长度的条件下,阴离子电荷量越高,钙矾石晶体尺寸(直径和长度)越小。减水剂的阴离子电荷量越高,对钙矾石晶体表面的亲和力越高,会以更密集的方式占据钙矾石的晶体表面,对钙矾石晶体生长的抑制作用越强,得到的钙矾石晶体尺寸就越小。
③减水剂浓度对钙矾石晶体生长的影响


减水剂的特定官能团、阴离子电荷数量、浓度等都会影响钙矾石晶体形貌、尺寸大小和数量。钙矾石晶体的形貌对水泥体系的早期和后期强度至关重要,如果能系统地研究减水剂中特定官能团、支链、电荷量和浓度对钙矾石晶体特定晶面的吸附能力,就可以通过改变减水剂掺量和类型来控制钙矾石形貌、尺寸和数量,进而有效控制水泥胶凝材料的流变性能和强度发展。
3.3.2 氯离子的影响
海水、除冰盐或含盐环境的土壤都存在Cl-,在侵蚀混凝土的过程中,Cl-会影响钙矾石、单硫酸盐等水泥水化产物的形成与生长。通常采用实验观测和分子模拟手段研究Cl-对钙矾石晶体结构的影响。




通过分子模拟和实验方法研究Cl-对钙矾石晶体的影响还存在许多需要深入研究的地方。一方面,根据钙矾石带正电荷的性质,Cl-更容易吸附到晶体表面,影响晶体结构;另一方面,由于Cl-与钙矾石形成的离子键并不稳定,Cl-对钙矾石晶体结构不会造成显著的影响。国内外研究针对Cl-对钙矾石晶体结构是否有较大的影响还存在分歧。目前通过实验发现低浓度Cl-不会侵蚀钙矾石,只有在高浓度Cl-样品中才观察到钙矾石转化为Friedel盐。但钙矾石转化为Friedel盐的机制还没有明确,是钙矾石在生成过程中受到Cl-侵蚀转化为Friedel盐,还是当钙矾石转变为单硫酸盐后受到Cl-侵蚀转化为Friedel盐,有待进一步明确。此外,对钙矾石和Friedel盐转化的量化研究也较少,Friedel盐究竟能固定多少Cl-目前仍未可知。
3.4 晶种的影响
钙矾石晶体以c轴方向作为主生长面,晶体多为针棒状[23,67],也有一些钙矾石晶体呈扁平的斜方状、管状、球状等形貌(图6)[51,59,68]。

图6 针状、管状、球状钙矾石晶体[69-71]Fig.6 Needle-shaped,tubular and spherical ettringite crystals[69-71]
目前关于钙矾石的形成机理还存在一些争议,主要有固相反应和液相反应两种理论。在这两种理论作用的环境体系中若存在晶种,钙矾石晶体会呈放射状集合体形貌。


图7 钙矾石在富铝相表面呈放射状生长[21,71]Fig.7 Ettringite grows radially on surface of aluminum-rich phase[21,71]


图8 钙矾石形貌特征。(a)大气环境中混合1 d后,生长的钙矾石晶体;(b)钙矾石放射集合体核心部分的物质的FE-SEM照片[72]Fig.8 Morphological characteristic of ettringite.(a) Ettringite crystals grown after mixing in atmospheric environment for 1 d;(b) FE-SEM image of substance in core part of ettringite radiation aggregate[72]
3.5 搅拌型式的影响
此外,合成钙矾石的搅拌过程中,搅拌桨的形状、数量、桨叶直径[76]、安装高度[75]和容器中的流体高度[77]都会对搅拌流场产生影响,进而影响所合成钙矾石的形貌和尺寸。搅拌桨桨叶可以根据形状、运动方向与桨叶表面的角度分类,最常见的分类是根据流场结构分为轴向式、径向式和切向式搅拌桨[75-76,78]。
轴向式搅拌桨具有均匀温和的剪切转速,循环量大,混合迅速,对剪切敏感的钙矾石结晶过程十分有利。在温和的剪切力条件下,有利于形成大粒径的钙矾石晶体[79-80]。径向式搅拌桨剪切力强但混合效率不高,钙矾石晶体容易破碎,易得到细小的钙矾石晶体[78-81]。切向式搅拌浆不适用于钙矾石晶体的合成[75]。
根据溶解结晶研究成果,可以推测搅拌桨叶直径也会影响合成钙矾石晶体形貌与尺寸。通常增加桨叶直径,可以显著提升混合效率,促进晶体成核与生长。但桨叶直径过大则会在桨叶下方靠近轴心区域形成反向回流区;过小桨叶作用不能扩展到整个槽体,会在槽上方区域形成次循环。桨叶直径与槽直径的比值(D/T)如何影响钙矾石晶体的形貌目前还是本领域的研究空白。
4 结论与展望
厘清环境影响因素对钙矾石晶体的研究,需要基于对钙矾石晶体结构的充分认识。钙矾石晶体中的化学键有配位共价键、离子—共价键、范德华力、氢键四种类型,钙矾石晶体共有四类结构水:沟槽水、钙多面体副配位水、钙多面体主配位水、铝OH-。这些化学键和水分子对钙矾石晶体结构的稳定性起到重要作用。
反应物离子的过饱和度是钙矾石晶体成核和生长的驱动力,当离子过饱和度较低时,钙矾石晶体生长占主导,晶体以(0001)面(c轴方向)为主生长面,晶体呈细长针状,长度随着过饱和度的增加逐渐增长;当过饱和度提高致使成核作用占主导时,主生长面的生长速率和其他晶面差距减小,钙矾石晶体呈短棱柱状。钙矾石晶体形貌在常温、中温、高温阶段时分别为短棒状、细针状、长杆状,晶体结构长度先减小后增加。温度升高至一定程度会导致钙矾石晶体结构中的水和部分离子会逐步脱离,表现为a轴方向的拉伸,c轴出现收缩现象。

在钙矾石形成过程中,如果有晶核存在,钙矾石晶体会以放射状集合体出现。
在实际应用中,可以通过改变反应物离子过饱和度、温度、减水剂掺量和类型、晶种等外部因素来控制钙矾石晶体形貌、尺寸和数量,进而控制其膨胀量和强度发展。
外部因素对钙矾石晶体结构和形貌的影响仍有许多未知之处或缺乏深入研究的领域,未来的研究可以从以下几个方面着手:(1)除氢键外其他化学键对钙矾石晶体结构形成的作用;(2)探索温度对钙矾石各个晶面生长速度的影响;(3)对比冷却结晶和常温/加热结晶条件下钙矾石晶体结构和形貌的异同;(4)系统研究减水剂类型、官能团、阴离子电荷密度等对钙矾石晶体结构的影响,解析关键影响因素;(5)厘清钙矾石与Friedel盐的转化机制,并对Friedel盐进行量化研究,探索Friedel盐固化氯离子的可行性;(6)系统研究搅拌型式对钙矾石晶体形貌、粒径分布的影响。

