基于TCGA 及Oncomine 数据库挖掘TMEM164 在肝细胞癌中的表达及临床意义
冯 豆,张 洪,宋 玲,谭佳杰,向玉玲
近年来,恶性肿瘤的发病率和死亡率在全球持续 上升,其中肝细胞癌(hepatocellular carcinoma,HCC)是威胁人类生命的重要疾病之一, 在全球范围内HCC 的发病率位居第6 位, 而死亡率更是位居第3位。据全球癌症统计报告显示,2020 年全球有90.6 万例新增HCC 患者,83.0 万例死亡患者,且男性的发病率显著高于女性[1]。 HCC 的发病因素较为复杂,具有发病隐匿、病程短、易转移复发的特点,临床上多采用手术切除联合放射疗法、化学疗法、介入疗法等手段综合治疗,近年来逐渐兴起的分子靶向疗法和免疫疗法也为HCC 的治疗提供了新的选择[2],但由于多数HCC 患者被诊断时便处于晚期,预后效果仍然不佳。因此寻找新的影响HCC 分子诊断和预后相关的标志物,进一步阐明HCC 发生、发展的分子机制具有重大意义。
跨膜蛋白(transmembrane protein,TMEM)是一类横跨整个脂质双分子层的蛋白家族, 许多TMEM 允许特定物质通过生物膜运输而发挥通道的作用,但由于提纯的困难性,该家族大部分蛋白的生物学功能仍然是未知的[3]。最近越来越多的研究表明,TMEM 在多种肿瘤组织中表达异常,可能作为原癌基因或抑癌基因参与多种肿瘤的发生、发展,并进一步提出TMEM蛋白可作为不同类型癌症的预后标志物及潜在治疗靶点[4]。 如TMEM16A 在头颈部鳞状细胞癌[5]、乳腺癌[6]、胰腺癌[7]、结直肠癌[8]等肿瘤中高表达,与患者的总生存率(overall survival rate,OSR)显著相关。 TMEM17在乳腺癌组织和细胞系中表达上调,可通过激活丝氨酸/苏氨酸蛋白激酶 (protein kinase B,Akt)/糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3)信号通路促进乳腺癌细胞恶性进展[9]。 TMEM100 在非小细胞肺癌中发挥抑癌基因作用,是其潜在的预后生物标志物[10]。
TMEM164 作为TMEM 家族的一员,与HCC 的关系仍然未知,故笔者基于肿瘤基因组图谱(The Cancer Genome Atlas,TCGA) 和Oncomine 数据库首次探讨TMEM164 在HCC 中的表达情况,并分析TMEM164 表达与临床病理特征及预后效果之间的相关性, 以期为HCC 预后评估及治疗靶点提供新的思路。
1 材料与方法
1.1 实验材料
TCGA 数据库是目前世界上最大的癌症基因信息数据库。 实验研究从GDC Data Portal 网站(https://portal.gdc.cancer.gov/)下载424 例HCC 的RNA 表达谱和临床病理特征资料。其中HCC 组织374 例,癌旁正常组织50 例。
Oncomine (https://www.oncomine.org/resource/login.html) 是一个大型基因芯片集合的数据在线分析平台。 实验研究借助Oncomine 数据库进一步扩大样本量。
1.2 方法
1.2.1 TMEM164 在肝细胞癌组织和癌旁正常组织表达分析
对TCGA 数据库中HCC 组织和癌旁正常组织TMEM164 mRNA 表达量, 分析不同组织的差异性和临床病理参数相关性。
借助Oncomine 数据库验证TCGA 数据库分析结果是否正确。 设置筛选条件为:①Gene TMEM164;②Analysis Type,cancer vs normal analysis; ③Cancer Type,liver cancer;④Data Type,mRNA;⑤临界值设定为P <10-4,fold change >2,gene rank=top 10%。 最后共计纳入5 项研究,875 个样本[11~14]。
1.2.2 TMEM164 与肝细胞癌预后相关性分析
采用Kaplan-Meier 法分析TCGA 数据库中TMEM164 表达与HCC 患者OSR 的关系, 并对影响HCC 患者预后效果的多种因素进行评估。
1.2.3 预测TMEM164 的潜在分子机制
为了探究TMEM164 表达对HCC 影响的潜在机制,采用基因集富集分析(gene set enrichment analysis,GSEA)4.0.2 软件, 先根据所有基因与TMEM164表达的相关性生成一个有序的基因列表, 接着对TMEM164 高、低表达组进行GSEA,计算各基因集的富集分数(enrichment score,ES),并对基因集的ES 值进行多重假设检验进行校正,每个分析进行1 000 次检验,最后依据名义P 值(nominal P-value,NOM P)<0.05、错误发现率(false discovery rate,FDR)<0.25 筛选出显著富集的基因集。
1.3 统计学方法
所有的统计分析均使用Perl 和R 3.5.1 软件进行。 以TMEM164 mRNA 表达的中位值为界,将患者分为高、低表达两组,采用两独立样本t 检验比较癌组织与癌旁正常组织中TMEM164 表达量的差异;利用R 中“Survival”包含有的Log-rank 检验计算TMEM164的表达与HCC 患者OSR 关系的P 值; 采用单因素Cox 回归分析影响HCC 患者预后的因素,多因素Cox回归分析TMEM164 是否可以作为HCC 患者预后的独立指标。 P <0.05 表示差异有统计学意义。
2 结果
2.1 TMEM164 在肝细胞癌组织和癌旁正常组织表达比较
通过对TCGA 数据库中HCC 组织和癌旁正常组织中TMEM164 mRNA 水平进行分析,发现TMEM164在HCC 中表达量显著升高(P<0.001。 图1A);此外,对同一患者癌组织与癌旁正常组织中TMEM164 表达水平进行配对差异分析,可以看出每个样本的癌组织和癌旁正常组织间的配对关系, 进一步说明HCC组织中TMEM164 表达水平显著高于癌旁正常组织(P<0.001。 图1B)。

图1 TCGA 数据库中TMEM164 在HCC 组织和癌旁正常组织中表达水平比较Fig.1 Comparison of TMEM164 expression in HCC tissues and adjacent normal tissues in TCGA database
通过挖掘Oncomine 数据库涉及的5 项研究(分别 发 表 于Molecular Biology of the Cell、Cancer Research、Hepatology 和Molecular Medicine), 扩大研究样本量进行Meta 分析。结果表明,TMEM164 基因(即为TMEM164)在所有差异表达基因中的中位数值排名为666.0,P=4.63×10-6(图2), 且在不同数据库中,HCC 组织中TMEM164 表达水平均高于正常肝组织(P<0.001。 图3),与TCGA 数据库分析结果一致。

图2 Oncomine 数据库中TMEM164 在HCC 中高表达的Meta 分析结果Fig.2 Meta-analysis of TMEM164 high expression in HCC in the Oncomine database

图3 Oncomine 数据库中TMEM164 在5 项不同HCC 研究数据集中的表达Fig.3 Expression of Oncomine database TMEM164 in 5 different HCC research datasets
2.2 TMEM164 的表达与肝细胞癌患者临床病理特征的关系
从TCGA 数据库中下载了424 例HCC 患者的临床资料, 排除临床病理参数和生存信息缺失的病例后,最后得到含有完整临床病理参数和生存信息的病例377 例(表1)。对TMEM164 表达与HCC 患者临床病理参数的关系进行分析,发现TMEM164 表达水平与HCC 患者的年龄、性别、组织学分级、N 分期、M 分期不相关(P>0.05),与患者Stage 分期(P=0.028)、T分期(P=0.036)相关(图4)。
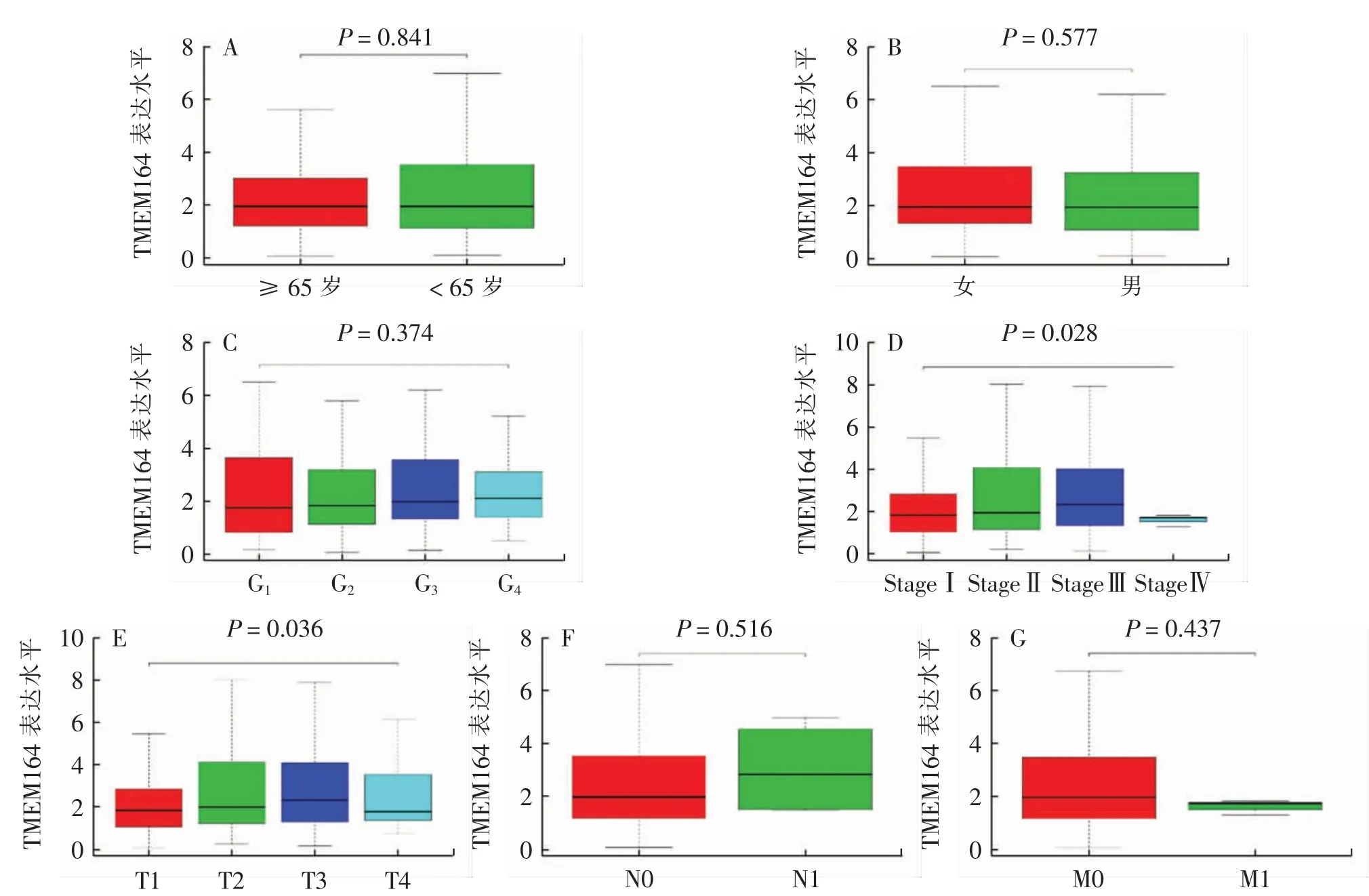
图4 TMEM164 表达水平与HCC 患者临床病理参数的关系Fig.4 Relationship between TMEM164 expression and clinicopathologic characteristics of HCC patient

表1 TCGA 数据库中HCC 患者的临床病理参数Tab.1 Clinicopathological parameters of HCC patients in TCGA database
2.3 TMEM164 表达与肝细胞癌患者预后关系
Kaplan-Meier 生存曲线分析结果表明,TMEM164表达水平与HCC 患者OSR 显著相关(P<0.01。图5),TMEM164 高表达的患者OSR 显著低于低表达患者,提示TMEM164 高表达与HCC 患者较差的预后效果存在相关性。此外,单因素Cox 回归分析结果表明(表2),Stage 分期[风险比(hazard ratio,HR) = 1.67,P <0.001]、T 分期(HR=1.65,P<0.001)、TMEM164 表达水平(HR=1.15,P<0.001)与HCC 患者预后显著相关; 而多因素Cox 回归分析结果显示(表2、 图6),TMEM164 表达水平可能成为影响HCC 患者预后效果的独立指标。

图6 多因素Cox 回归分析的森林图Fig.6 Forest plot of multivariate Cox regression analysis
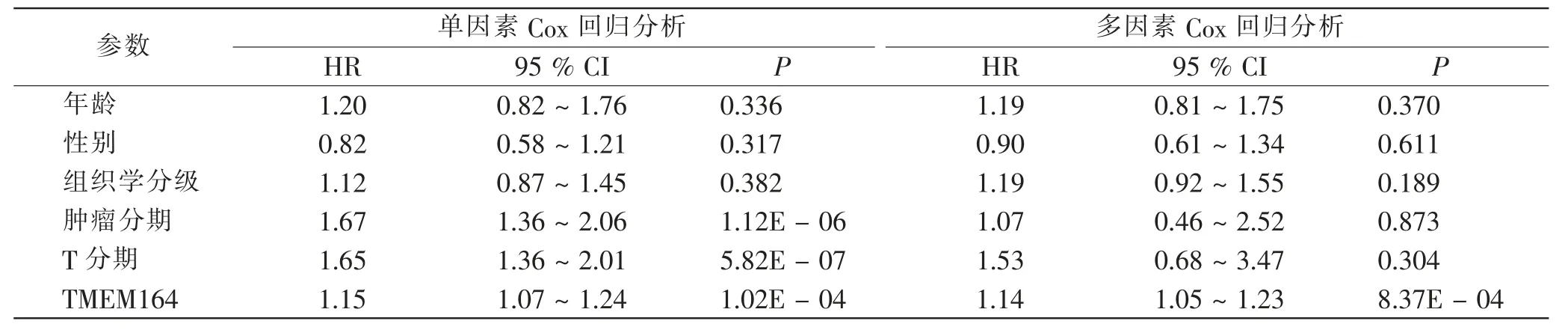
表2 单因素和多因素Cox 回归分析TMEM164 表达水平与预后的关系Tab.2 Univariate and multivariate Cox regression analysis of relationship between TMEM164 expression and prognosis

图5 不同TMEM164 表达水平的HCC 患者OS 曲线Fig.5 OS curves of HCC patients with different TMEM164 expression levels
2.4 与TMEM164 高表达相关的信号通路基因富集分析
在TMEM164 高、 低表达的数据集之间进行了GSEA, 根据它们的归一化富集评分(normalized enrichment score,NES)选择TMEM164 高表达表型中最显著富集的信号通路(NOM P<0.05,FDR<0.25)。富集结果所示,在TMEM164 高表达表型中磷脂酰肌醇信号通路、癌症相关通路、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路、细胞周期、T 细胞受体信号通路、ERBB (erythroblastic oncogene B)信号通路、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路、凋亡、NOTCH信号通路、自噬调控、RNA 降解及B 细胞受体信号通路差异性富集。 见表3 和图7。

图7 GSEA 富集图谱Fig.7 Enrichment plots of GSEA
3 讨论
TMEM 蛋白家族是近年来发现的一类与免疫及肿瘤等疾病密切相关的跨膜蛋白,参与了构成质膜的离子通道、信号转导、介导细胞增殖、凋亡、自噬等多种生理过程[15~17]。最近的一些研究表明TMEM 蛋白可发挥癌基因或抑癌基因作用,与多种类型癌症的恶性进展及化学治疗耐药性显著相关,是潜在的肿瘤预后标志物及治疗靶点。 由于TMEM 蛋白家族成员的特征和定位存在较大差异, 因此不同TMEM 蛋白在肿瘤的作用值得深入探究[18]。
TMEM164 蛋白是TMEM 蛋白家族的一员,其编码基因位于Xq23 染色体上,含有14 个外显子。 目前TMEM164 发挥的功能报道较少, 仅有一项研究表明TMEM164 通过维持自噬体的形成在促进自噬依赖性铁死亡中起关键作用[19],TMEM164 的其他分子功能有待进一步挖掘。笔者所在课题组借助生信分析手段首次发现TMEM164 mRNA 在HCC 患者的肿瘤组织中显著高表达, 且TMEM164 表达水平与HCC 患者的Stage 分期和T 分期均显著相关(P<0.05),Kaplan-Meier 生存分析结果显示TMEM164 高表达的患者OSR 显著低于低表达患者, 随后进行的单因素及多因素Cox 回归分析结果表明TMEM164 高表达可能作为影响HCC 患者预后的独立指标。
从GSEA 富集结果可以看出,在HCC 中TMEM164很可能通过调控磷脂酰肌醇信号通路、mTOR 通路、ERBB 通路、VEGF 通路和NOTCH 通路等几种常见的癌症信号通路参与肿瘤的进程,TMEM164 可能还参与了细胞周期、凋亡、自噬及RNA 降解等生理过程的调控。此外TMEM164 可能作用于T 细胞和B 细胞受体信号通路,与免疫相关疾病有关。 以上结果为探索TMEM164 调控HCC 发展的分子机制提供了线索。
综上, 笔者研究基于TCGA 和Oncomine 数据库进行大样本分析,提示TMEM164 在HCC 中高表达,且与患者的预后效果密切相关, 有可能成为HCC 患者预后的独立指标; 为进一步开发HCC 早期诊断的生物标志物、术前评估患者的风险状况及预后价值提供了新思路, 同时TMEM164 有望成为HCC 的潜在治疗靶点,为临床药物的研发指明了方向。

