miR-18a对于成肌细胞胶原蛋白表达的影响
刘戈辉, 杨玉凤, 刘佳夷, 姜志艳, 刘春城*
(1.内蒙古科技大学生命科学与技术学院, 包头 014010; 2.内蒙古自治区功能基因组生物信息学重点实验室, 包头 014010)
骨骼肌是运动和新陈代谢相关的重要器官,其对于维持运动平衡、调节蛋白质代谢以及能量代谢意义重大。在剧烈运动、神经异常等状况下都可能出现骨骼肌的损伤,因此肌肉的损伤分为直接创伤(例如撕裂伤,拉伤和挫伤)和间接损伤(与局部缺血和神经功能障碍有关)[1]。损伤的症状包括了肿胀、疼痛、肌肉紧张、痉挛、僵硬、硬结,甚至会出现皮下淤青;肌肉损伤时按压疼痛明显加重,肌肉活动、拉伸时则会出现疼痛加剧、受限等现象[2]。肌肉的反复损伤则会导致骨骼肌纤维化甚至形成瘢痕组织,严重影响骨骼肌的功能,对患者日后的运动能力与生活质量产生严重的负面影响[3]。
肌纤维(肌肉细胞)和卫星细胞(肌肉干细胞)都存在于骨骼肌的微环境中,微环境对于肌纤维生长和卫星细胞静息态维持、激活以及分化具有重要的影响[4]。细胞外基质(extracellular matrix, ECM)是骨骼肌微环境的重要组成,其由蛋白质、多糖、RNA等组成[4-7]。细胞外基质相关蛋白质主要包括3种,即胶原蛋白、非胶原蛋白和蛋白多糖,其中胶原蛋白是骨骼肌细胞外基质最主要的组成部分;在小鼠骨骼肌中,至少有3种类型的细胞可以产生和分泌胶原蛋白,即成纤维细胞、纤维/脂肪前体细胞和卫星细胞[8]。所以对于骨骼肌中细胞外基质相关基因表达变化的研究至关重要。
成肌细胞通过转分化也可能是骨损伤修复的重要细胞来源,在这一个过程中,也与成肌细胞细胞外基质的表达密切相关。细胞外基质相关蛋白即是转分化的调节因子,又是转分化完成的标志基因[9]。
miRNA是一类长21~24个核苷酸的微小RNA分子,最早在线虫中发现,即 lin-4和let-7。这2种miRNA 通过部分序列互补结合到靶标基因mRNA的3′端非编码区,从而调控了线虫的发育过程[10]。随着研究的深入,miRNA在多种生理病理过程中的调节功能被不断揭示,miRNA通过调节基因的表达,包括细胞增殖[11]、细胞分化[12]、程序性细胞凋亡[13]、代谢以及组织器官的形态建成[14],并且在肿瘤的发生发展过程中miRNA同样具有重要的调节作用[15]。 miRNA在肌肉发生、发育、萎缩、损伤修复等过程中的调控作用也逐渐被发现[16]。
miR-18a属于miR-17-92簇,该miRNA簇在人类中是由13号染色体的6个miRNA组成,这些miRNA被转录成单个多顺反子单位[17]。miR-17-92簇的多个miRNA与肿瘤的发生发展密切相关,其中miR-18a的表达改变不仅与细胞增殖、凋亡相关,也与上皮-间充质转化(epithelial-mesenchymal transition,EMT)、肿瘤侵袭和转移相关[18]。而上皮-间充质转化、肿瘤侵袭和转移与细胞外基质相关蛋白的表达有关。鉴于细胞外基质相关蛋白对于骨骼肌的重要性,本文研究旨在关注miR-18a对于骨骼肌细胞外基质相关基因表达的影响及相应的miR-18a的生理病理功能。
已有研究表明多种miRNA参与调控细胞外基质相关基因的表达从而影响细胞的衰老、增殖、迁移、凋亡、炎症和分化等过程的调控[19]。其中miR-29b的过表达可以减少人角膜内皮细胞ECM蛋白的产生[20]。miR-203在肝纤维化过程中可以抑制Col1a1、Col3a1等细胞外基质成分的合成和沉积[21]。miR-483的过表达通过Wnt通路调节髓核细胞增殖和细胞外基质重塑[22]。
目前关于miR-18a在骨骼肌中有关细胞外基质中相关基因表达影响的研究较少,本课题组前期对miR-18a在骨骼肌发育过程中的功能进行了研究,结果表明miR-18a对于成肌细胞的增殖[23]及骨骼肌萎缩[24]具有重要的调节作用。因此,关于miR-18a对于骨骼肌中细胞外基质的相关基因表达变化的研究至关重要,现对miR-18a在细胞外基质中的功能进行研究,为骨骼肌损伤为主要病症的相关疾病的研究提供借鉴意义与理论基础。
1 材料与方法
1.1 材料
(1)实验动物:SPF级的C57BL/6雄鼠购买自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010;小鼠购进后适应性喂养一周,然后将小鼠随机分为5组,PBS注射3 d对照组,PBS注射10 d对照组,BaCl2注射3 d实验组,BaCl2注射5 d实验组,BaCl2注射10 d实验组。注射量为100 μL,注射位置为胫骨前肌。
(2)细胞系:成肌细胞C2C12购买于中国科学院协和细胞库。
(3)miRNA模拟物:miR-18a模拟物(锐博生物科技,中国)基于mmu-miR-18a-5p序列而设计。
1.2 实验方法
1.2.1 苏木精-伊红染色法(HE染色)
取经PBS注射的对照组和BaCl2注射的实验组小鼠肌肉组织浸泡在4%的多聚甲醛固定液中24 h后进行脱水、石蜡包埋、切片操作,然后按照碧云天HE染色步骤进行染色操作,将染好色的切片放到光学显微镜下观察,采集图像。
1.2.2 细胞培养及处理
成肌细胞C2C12用含有10%胎牛血清的DMEM培养液(Gibco,美国)在37 ℃、5% CO2的培养箱中,同时培养基中还添加了1%青霉素和链霉素(Gibco,美国)。当细胞汇合度达到约70%以上时,用胰蛋白酶消化、传代。
转染采用的是脂质体介导转染法。转染前24 h,把浓度为0.5×105/mL的成肌细胞C2C12均匀铺至6孔板的相应孔中,每孔加入2 mL培养液。在转染时细胞汇合度可达70%。根据Lipo6000TM(碧云天,中国)推荐剂量进行转染。骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)(碧云天,中国)可以刺激成肌细胞C2C12分化为成骨细胞系中的细胞,从而诱导成肌细胞向骨的转分化[25]。
1.2.3 RNA提取和反转录
运用Trizol试剂(北京庄盟国际生物,中国)提取总RNA,通过A260/280比值检测总RNA的纯度以及浓度。根据吸光值将RNA浓度调整一致,利用M-MLV Reverse Transcriptase(Promega,美国),参照说明书步骤将RNA反转录成cDNA;miRNA基于茎环法进行检测[26],所用引物相关信息如表1所示;反转录产物放置于-20 ℃冰箱中储存备用。
1.2.4 实时荧光定量PCR(RT-qPCR)
使用Primer3.0(version 4.1.0)软件设计相关引物,所用引物相关信息如表1所示。采用SYBR Green PCR Mix(北京庄盟国际生物,中国)试剂盒,在实时荧光定量仪上进行相对定量分析。详细的步骤参照试剂盒说明书,以20 μL的体系进行检测。GAPDH或U6作为内参基因,配制20 μL PCR反应体系,反应步骤:94 ℃ 3 min,(94 ℃ 15 s,60 ℃ 40 s,40个循环)。应用2-ΔΔCT法计算Col1a1、Col4a1、Col4a2基因以及miR-18a的相对表达量。

表1 引物名称和序列Table 1 Primer name and sequences
1.2.5 划痕实验
适宜汇合度的培养于6孔板中的成肌细胞C2C12在转染后继续培养24 h。通过塑料吸头尖端穿过单层细胞制造划痕,产生划痕的时间即为0 h,持续监测创面闭合时间至6 h。划痕宽度由ImageJ软件分析。
1.2.6 统计分析
使用SPSS 16.0进行统计学分析。实验结果均以平均值±标准误(mean±SEM)来展示,并通过t-检验分析计算,p<0.05则具有统计学意义。*表示差异显著(p<0.05),**表示差异极显著(p<0.01)。
2 结果与分析
2.1 建立小鼠骨骼肌损伤修复模型
骨骼肌内BaCl2注射是常用的化学诱导骨骼肌损伤的方法,本研究基于在小鼠的胫骨前肌内注射BaCl2构建了骨骼肌损伤修复模型,并通过骨骼肌组织切片HE染色对模型进行了分析。结果如图1所示,BaCl2注射3 d的实验组炎性细胞聚集、部分肌纤维发生断裂,新的肌纤维尚未形成;以上结果表明BaCl2注射后对骨骼肌造成了严重损伤。BaCl2注射5 d的实验组中可见新形成的肌纤维直径较小、细胞核居中,并且肌纤维间仍存在炎性细胞;以上结果表明BaCl2注射5 d后损伤的骨骼肌已经开始修复。而BaCl2注射10 d的实验组中,肌纤维直径逐渐恢复正常水平,细胞核居中,炎性细胞明显减少。对照组肌纤维排列整齐,形态结构完整,肌细胞位于肌细胞边缘。结果表明成功建立了小鼠骨骼肌损伤修复模型。

图1 肌肉组织HE染色结果分析Fig.1 Analysis of HE(hematoxylin-eosin) staining results of muscle tissue
2.2 骨骼肌损伤修复过程中,miR-18a及细胞外基质相关基因的表达变化
进一步利用RT-qPCR方法对小鼠的胫骨前肌内注射BaCl2构建的骨骼肌损伤修复模型及对照小鼠肌肉组织中miR-18a的表达进行了检测。结果表明miR-18a的表达水平在肌肉受损后出现明显上调;而随着骨骼肌的修复进程,miR-18a的表达水平逐步下调,如图2(a)所示。根据这一结果推测miR-18a可能参与了骨骼肌损伤修复的调控。

**表示p<0.01图2 BaCl2诱导的骨骼肌损伤修复过程中细胞外基质相关基因的表达变化Fig.2 Expression of extracellular matrix related genes during BaCl2induced skeletal muscle injury
在骨骼肌损伤修复过程中,细胞外基质相关基因的表达量也会发生改变,同时本文研究通过RT-qPCR检测了Col1a1、Col4a1以及Col4a2基因在这一过程中的表达变化。如图2(b)~图2(d)所示,以上被检测的基因均在损伤后表达量升高,但在损伤修复的进程中的表达量的变化并不相同。其中Col1a1基因在损伤时变化的倍数较大,而修复过程中变化倍数迅速缩小;而Col4a1和Col4a2则在损伤3~10 d变化不显著。
2.3 在成肌细胞C2C12中过表达miR-18a能够影响细胞外基质相关基因的表达
在小鼠损伤模型中miR-18a与细胞外基质基因有相似的表达模式,那么在肌肉损伤过程中miR-18a是否调控细胞外基质相关基因的表达,本文研究在成肌细胞C2C12中对miR-18a的模拟物进行了转染,利用RT-qPCR 检测 miR-18a模拟物(miR-18a mimics)或对照(NC)转染24 h后的成肌细胞C2C12中Col1a1、Col4a1以及Col4a2的表达变化。结果显示与对照组相比,在转染了miR-18a模拟物的成肌细胞中,细胞外基质相关基因Col1a1、Col4a1以及Col4a2表达显著下调,如图3所示。表明miR-18a在成肌细胞C2C12中抑制细胞外基质相关基因的表达。
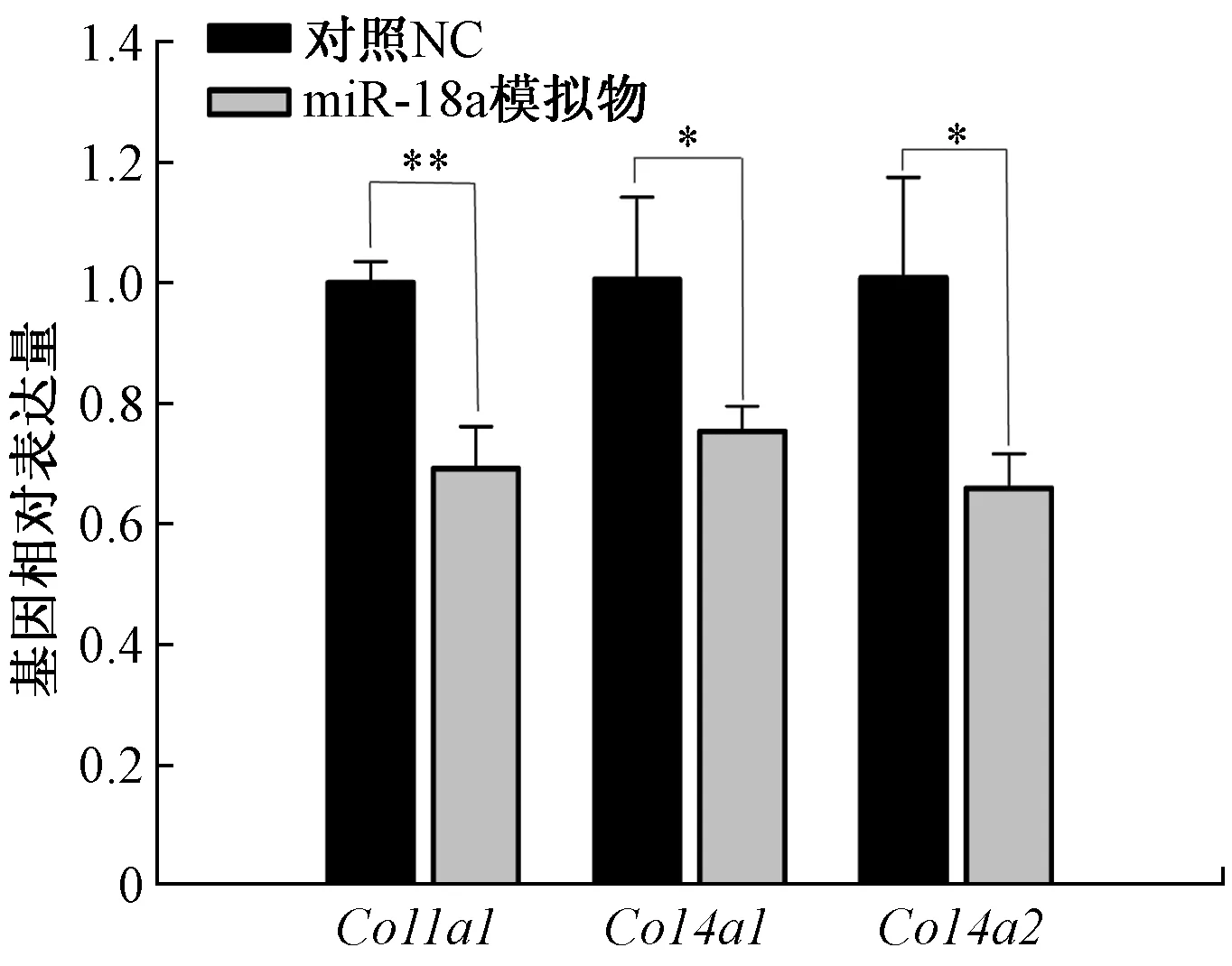
*表示p<0.05;**表示p<0.01图3 miR-18a抑制了成肌细胞C2C12中细胞外基质相关基因的表达Fig.3 miR-18a inhibited the expression of extracellular matrix related genes in myoblast C2C12
2.4 miR-18a对成肌细胞C2C12迁移的影响
细胞外基质与成肌细胞的迁移密切相关,因此本文研究利用划痕实验检测了转染miR-18a模拟物对于成肌细胞C2C12迁移的影响。结果表明,与转染了NC的成肌细胞相比,转染miR-18a模拟物后成肌细胞迁移的比例有变化,但并无生物统计学意义,如图4(a)和图4(b)所示。因此,miR-18a的过表达并不影响成肌细胞C2C12的迁移。
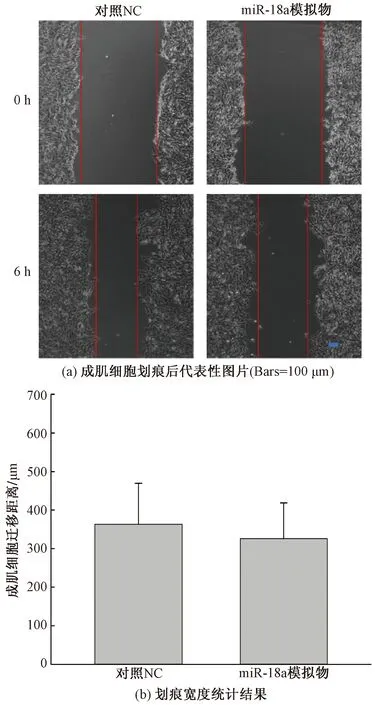
图4 miR-18a过表达对成肌细胞C2C12迁移的影响Fig.4 Effect of miR-18a overexpression on migration of myoblasts C2C12
2.5 miR-18a对于成肌细胞C2C12向骨转分化的影响
细胞外基质中相关胶原蛋白的表达与成肌细胞向骨的转分化密切相关,因此本文研究检测了miR-18a是否影响成肌细胞C2C12向骨的转分化过程。如图5(a)和图5(b)所示,BMP-2诱导了成肌细胞中Runx2基因和Alpl基因表达量显著升高,Runx2基因和Alpl基因是成肌细胞C2C12向骨转分化的重要标志基因[25, 27]。基于以上模型,首先检测了miR-18a转染后未诱导的成肌细胞中Runx2基因和Alpl基因的表达量变化。实时荧光定量结果表明Runx2基因和Alpl基因虽然表达量没有显著下调,但均具有下调的趋势[图5(c)]。接下来本文研究检测了miR-18a转染后BMP-2诱导的成肌细胞中Runx2基因和Alpl基因的表达量变化。实时荧光定量检测结果表明,miR-18a转染后再利用BMP-2诱导转分化,Runx2基因和Alpl基因虽然也有下调的趋势[图5(d)],但在NC与miR-18a转染的细胞间仍不存在显著的差异。以上结果说明miR-18a对于成肌细胞向骨的转分化并无显著影响。
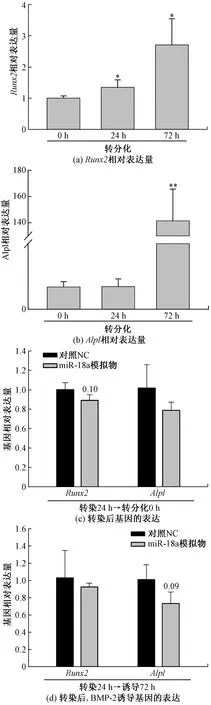
*表示p<0.05;**表示p<0.01图5 miR-18a对成肌细胞C2C12向骨转分化的影响Fig.5 Effect of miR-18a on osteogenic transdifferentiation of myoblast C2C12
3 讨论
MicroRNA在调控细胞外基质相关基因的表达上具有重要作用。本文研究发现miR-18a的过表达抑制了成肌细胞细胞外基质相关基因的表达,但划痕实验结果表明其过表达并未显著影响成肌细胞的迁移。已有研究表明,miR-18a会抑制成肌细胞的增殖[23]。因此虽然miR-18a影响了成肌细胞的细胞外基质相关基因的表达,但在对于增殖以及其他因素的影响下,miR-18a的过表达并不会引起划痕实验中细胞的迁移率发生显著改变。
MiRNA在细胞转分化过程中具有重要调节作用。有研究表明miRNA-206与Runx1转录本结合影响Runx1的翻译,可以抑制纤维成脂祖细胞的成脂分化[28]。其中在miR-18a在成肌细胞向脂肪转分化过程中表达量也发生了改变。因此本研究基于miR-18a过表达对于成肌细胞细胞外基质蛋白具有调控作用,因此检测了miR-18a过表达对于成肌细胞向成骨细胞转分化的影响。但在成骨转分化的实验结果表明其过表达并未显著影响成肌细胞向成骨细胞的转分化[29]。
miR-18a被报道抑制了smad2[30]、PTEN[31]以及NOTCH2[32]等基因的表达,这些基因可以抑制骨的转分化过程[33-35];同时也有研究表明miR-18a抑制了ERα[36]、sox6[37]等基因的表达,而这些基因则是骨或者软骨发育所必需的[38-39]。本研究在成肌细胞中过表达miR-18a的研究结果表明,虽然miR-18a影响了成肌细胞的细胞外基质相关基因的表达,但miR-18a对于转分化过程并无显著的影响。
细胞外基质与骨骼肌干细胞也就是卫星细胞的干性维持密切相关。前期的研究中发现,在成肌细胞中,miR-18a可以抑制Fgf1的表达[23];在成纤维细胞中,miR-18a可以抑制Notch2的表达[40];以上基因又都与卫星细胞的干性维持密切相关[41-42],这些结果都提示了miR-18a可能参与了卫星细胞的干性维持与激活。所以以上研究内容将是miR-18a后续的重要的研究方向。
细胞外基质相关基因对于骨骼肌损伤修复具有重要的意义。细胞外基质不足以满足骨骼肌重建,肌细胞和卫星细胞都会受到影响[43],而细胞外基质相关基因的过量表达,则会导致骨骼肌的纤维化[44]。有研究表明,miR-214-5p下调通过靶向Col4a1促进成骨细胞细胞外基质的形成[45]。miR-30a可以通过下调Sox9的表达促进关节软骨细胞外基质的降解[46]。miR-26a表达下调可能参与软骨疾病中细胞外基质的改变[47]。因此miR-18a对于细胞外基质相关基因的研究,可以为骨骼肌损伤修复的治疗提供理论依据。
4 结论
对于miR-18a的作用机制进行研究中发现,miR-18a在小鼠骨骼肌损伤时表达量升高,该过程中细胞外基质相关基因的表达也是升高的。在成肌细胞C2C12中的研究发现,miR-18a的过表达抑制了Col1a1、Col4a1以及Col4a2基因的表达。但在成肌细胞中对miR-18a的功能进行进一步挖掘时发现,虽然miR-18a影响了细胞外基质相关基因的表达,但miR-18a并不影响成肌细胞的迁移与成肌细胞向骨的转分化。由此可推测miR-18a在骨骼肌损伤的自我更新过程中有着非常重要的功能,但具体的作用机制及作用靶基因仍需进一步的研究。本文研究对miR-18a在细胞外基质中相关基因的研究,为骨骼肌损伤修复的治疗机制进一步的研究提供了理论参考与借鉴意义。

