木麻黄根乙酸乙酯部位化学成分研究
高阮玲, 罗喻才, 马咏仪, 王国凯, 周忠玉,3*
木麻黄根乙酸乙酯部位化学成分研究
高阮玲1,2, 罗喻才2,3, 马咏仪2,3, 王国凯1*, 周忠玉1,2,3*
(1. 安徽中医药大学药学院中药研究与开发安徽省重点实验室,合肥 230012;2. 中国科学院华南农业植物分子分析与遗传改良重点实验室, 广东省应用植物学重点实验室, 中国科学院华南植物园,广州 510650;3. 华南国家植物园,广州 510650)
为阐明木麻黄()的化学成分,采用有机溶剂提取、萃取及多种分离技术,从其根中分离得到14个化合物。经光波谱分析,其结构分别鉴定为5-hydroxy-3-methoxyphenyl-6--syringoyl--d-glucopyranoside (1), 高良姜苷A (2), heterophylloside C (3)、6¢--vanilloylisotachioside (4)、3,4,5-trimethoxyphenyl-6--syringoyl--d-glucopyranoside (5)、香草醛(6)、丁香醛(7)、3,4-二羟基苯甲醛(8)、齐墩果酸(9)、桦木酸(10)、胡萝卜苷(11)、胡萝卜苷亚油酸酯(12)、(±)-lyoniresinol 2---rhamnoside (13)和(-)-9-acetyl-isolariciresinol 9¢---l-rhamnopyranoside (14),其中化合物14为新的木脂素。
木麻黄;化学成分;木脂素
木麻黄()为木麻黄科(Casuarinaceae)木麻黄属植物,原产于澳大利亚及太平洋岛屿,越南、泰国、缅甸、菲律宾、马来西亚、印度尼西亚、巴布亚新几内亚也有分布,广东、广西、福建、台湾沿海一带普遍种植[1]。木麻黄具有重要的药用价值,树皮、枝、叶、种子都可入药[2]。据《中华本草》记载,木麻黄具有宣肺止咳、行气止痛,温中止泻,利湿的功效[2]。现代天然药物化学对木麻黄植物的研究发现,该植物具有丰富多样的生物活性,包括抗氧化[3]、抗菌[4]、抗痘[5]、肾保护[6]、神经保护[7]、镇痛[8]等多种生物活性。国内外关于木麻黄叶、皮、根瘤、凋落物的次级代谢产物都有研究报道[9],然而关于木麻黄根的次级代谢产物相对空白。前期我们从木麻黄根中分离鉴定了4个新的和6个已知的大环二芳基庚烷类化学成分[10]。本研究继续报道木麻黄根的化学成分,分离鉴定了1个新的木脂素,(-)-9-acetyl-isolariciresinol9¢--- l-rhamnopyranoside (14),以及13个已知化合物。
1 材料和方法
1.1 材料
试验材料由中国林业科学院热带林业研究所仲崇禄教授和张勇教授于2020年6月采自于广东省吴川市。
柱层析硅胶(80~100、200~300目)、薄层硅胶层析板HSGF254 (烟台江友硅胶开发公司);葡聚糖凝胶Sephadex LH-20 (瑞典Amersham Biosciences)。
1.2 仪器与试剂
分析用HPLC (日本Shimadzu公司),配备SPD- M20A二极管阵列检测器、LC-20AT溶剂输送泵和SIL-20A自动进样器; 色谱柱为安捷伦ZORBAX SB- Aq (5m, 4.6 mm´250 mm)。半制备/制备用HPLC (日本Shimadzu公司),配备CBM-20A系统控制器、SPD-20A紫外-可见光检测器和LC-6AD溶剂输送泵, 色谱柱为Cosmosil公司的5C18-MS-Ⅱ (10ID´250 mm)。制备用MPLC为北京创新通恒科技有限公司的LC3000液相色谱仪。
分析纯石油醚、二氯甲烷、乙酸乙酯、甲醇等(天津市百世化工有限公司和天津富宇试剂公司);分析纯氯仿、丙酮和硫酸(广州化学试剂厂);色谱级甲醇和乙腈(天津市康科德科技有限公司);氘代氯仿、甲醇、吡啶、二甲基亚砜(美国剑桥同位素实验室(CIL)公司);l-鼠李糖标准品(阿达玛斯试剂有限公司)。
1.3 提取和分离
木麻黄根晒干粉碎(7.26 kg),用90 %乙醇浸提3次,合并提取液,减压浓缩得提取物浸膏698.36 g。提取物浸膏用水溶解,倒入分液漏斗依次用石油醚、乙酸乙酯、正丁醇分别萃取3次,合并各部分萃取液,减压浓缩得到石油醚萃取物10.05 g、乙酸乙酯萃取物35.62 g、正丁醇萃取物24.89 g。本研究对木麻黄根乙酸乙酯萃取物进行分离与鉴定,其石油醚与正丁醇萃取物暂未研究。
乙酸乙酯萃取物经硅胶柱色谱分离,以二氯甲烷-甲醇洗脱剂(100:0~0:100)梯度洗脱,收集流份, 每份1 L,经过薄层色谱分析,合并得到15个组分F1~F15。F2 (2461.4 mg)经硅胶柱层析, 以石油醚-乙酸乙酯(250:1~0:100)洗脱,得到亚组分F2-1~F2- 10。F2-10经硅胶柱层析, 以石油醚-乙酸乙酯(100:1~0:100)洗脱,得到亚组分F2-10-1~F2-10-8。F2-10-7经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F2-10-7-1~F2-10-7-6。F2-10-7-6经HPLC纯化,以乙腈-水(19:81)为流动相,流速2 mL/min, 得化合物6 (R=27.5 min, 7.8 mg)。F2-10-8经HPLC纯化,以乙腈-水(13:87)为流动相,流速2 mL/min, 得化合物7 (R=57.6 min, 10 mg)。F3 (815.1 mg)经硅胶柱层析, 以石油醚-乙酸乙酯(250:1~0:100)洗脱,得到亚组分F3-1~F3-10。F3-7经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F3-7-1~F3-7-4。F3-7-4经HPLC纯化,以乙腈-水(89:11)为流动相,流速2 mL/min,得化合物10 (R=37.6 min, 2.1 mg)。F3-9经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F3-9-1~F3-9-3, F3-9-2经HPLC纯化,以乙腈-水(89:11)为流动相,流速2 mL/min,得化合物9 (R=42.6 min, 4.1 mg)。F6 (2126.5 mg)经硅胶柱层析, 以石油醚-乙酸乙酯(250:1~0:100)洗脱,得到亚组分F6-1~F6-5。F6-1经葡聚糖凝胶柱层析, 二氯甲烷/甲醇(1:1)洗脱,得到亚组分F6-1-1~F6-1-4。F6-1-4经HPLC纯化,以乙腈-水(27:73)为流动相, 流速2 mL/min,R=10.9 min,得流份F6-1-4-1。F6-1-4-1经硅胶柱层析, 以二氯甲烷-甲醇(500:1)洗脱,得化合物8 (3.0 mg)。F7 (3517.7 mg)经硅胶柱层析, 以石油醚-乙酸乙酯(250:1~0:100)洗脱,得化合物12(301.0 mg)。F8 (7421.4 mg)经中压液相色谱,以甲醇-水(20:80~100:0)洗脱,得到亚组分F8-1~F8-19。F8-4经硅胶柱层析,以二氯甲烷-甲醇(150:1~0:100)洗脱,得到亚组分F8-4-1~F8-4-3。F8-4-3经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F8-4-3-1~F8-4- 3-2。F8-4-3-1经HPLC纯化,以甲醇-水(45:55)为流动相,流速2 mL/min, 得化合物13 (R= 0.9 min, 7.5 mg)。F8-5经硅胶柱层析,以二氯甲烷-甲醇(100:1~0:100)洗脱,得到亚组分F8-5-1~F8-5-4。F8-5-3经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F8-5-3-1~F8-5-3-3。F8-5-3-1经HPLC纯化,以甲醇-水(35:65)为流动相,流速2 mL/min, 得化合物1 (R= 27.3 min, 12.5 mg)和2 (R=29.8 min, 9.3 mg)。F8-5- 3-3经HPLC纯化,以甲醇-水(30:70)为流动相,流速2 mL/min,得化合物3 (R=34.6 min, 3.3 mg)和4 (R=38.1 min, 2.6 mg)。F8-8经硅胶柱层析,以二氯甲烷-甲醇(100:1~0:100)洗脱,得到亚组分F8-8-1~F8-8-6。F8-8-4经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F8-8-4-1~F8-8- 4-4。F8-8-4-1经HPLC纯化,以甲醇-水(42:58)为流动相,流速2 mL/min,得化合物5 (R=14.5 min, 9.0 mg)。F8-11-4经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱,得到亚组分F8-11-4-1~F8-11-4-3。F8-11-4-2经HPLC纯化,以甲醇-水(27:73)为流动相, 流速2 mL/min, 得化合物14 (R=46.3 min, 3.5 mg)。F8-17经葡聚糖凝胶柱层析,二氯甲烷/甲醇(1:1)洗脱, 得化合物11 (11.1 mg)。化合物1~14的结构见图1。
(-)-9-acetyl-isolariciresinol 9¢---l-rhamnopy-ranoside (14) 分子式C28H36O11,灰色无定形固体, 易溶于氯仿;[]D20-59.0 (0.2, MeOH); UV (MeOH)max(log) nm 256 (0.53), 283 (1.65); ESI- MS: 571 [M + Na]+;HR-ESI-MS: 549.2326 [M + H]+(计算值:549.2330);氢谱和碳谱数据见表1。
1.4 化合物14的酸水解及衍生化反应
参考Gou等[11]的方法,取2.5 mg化合物14溶于5 mL 2 mol/L的盐酸中,100 ℃回流4 h,减压浓缩至干,加入5 mL蒸馏水溶解,用乙酸乙酯萃取3次,每次5 mL。乙酸乙酯部分为化合物14的苷元,苷元溶解于甲醇,测试旋光值[α]D20=-11.0 (0.1, MeOH)。水部分减压浓缩至干,加入1 mL浓度为1 mg/mL的l-半胱氨酸甲酯盐酸盐吡啶溶液,60 ℃反应1 h,加入2L邻甲苯异硫氰酸酯,再反应1 h,减压浓缩至干,加入1 mL甲醇溶液溶解,滤液经高效液相分析,以乙腈/水/乙酸(21:79:0.1)为流动相,流速为1 mL/min。l-鼠李糖以同样方法进行衍生化反应,并使用高效液相分析,与化合物14水解、衍生化产物进行比对。
2 结果与讨论
化合物14为灰色无定形固体,易溶于氯仿, ESI质谱显示明显的准分子离子峰571 [M + Na]+, 表明分子量为548。通过HR-ESI-MS的准分子离子峰549.2326 [M + H]+推出分子式为C28H36O11(计算值:549.2330)。1H NMR中,低场区有5个芳香质子信号H6.85 (1H, d,= 8.0 Hz), 6.63 (1H, dd,= 8.0, 1.9 Hz), 6.59 (1H, d,= 1.9 Hz), 6.59 (1H, s)和6.28 (1H, s),通过耦合常数分析,可知H6.85、6.63、6.59为一组1,3,4三取代的苯环质子信号,H6.59和H6.28为一组1,3,4,6四取代的苯环质子信号;H4.66 (1H, d,= 1.7 Hz)和1.23 (3H, d,= 6.2 Hz)为鼠李糖的特征质子信号。13C NMR谱中显示了28个碳信号,结合HSQC,结构中包括12个芳基碳,鼠李糖基6个碳,乙酰基2个碳(C171.7, 21.2), 2个甲氧基碳,3个亚甲基,3个次甲基。减去乙酰基、甲氧基、鼠李糖基,经分析剩余的分子母核为木脂素。通过检索文献,化合物14与文献[12]报道的aviculin很相似,差异之处在于化合物14比aviculin多了1个乙酰基。HMBC谱中,H2-9 (H4.35, 3.94)与乙酰基中的羰基(C171.7)有明显相关信号, 表明乙酰基连接在C-9位(图2: A)。H2-9的化学位移H4.35, 3.94比aviculin对应的氢信号(H3.63, 3.71)向低场移动,进一步证明乙酰基连接在C-9位。1H-1H COSY谱图中,观察到H2-7与H-8、H-8与H2-9和H-8¢、H-8¢与H-7¢和H2-9¢有明显相关信号,证明了如图2: A中的H2-7/H-8/H2-9,H-8/H-8¢,和H-7¢/ H-8¢/H2-9¢自旋耦合体系。
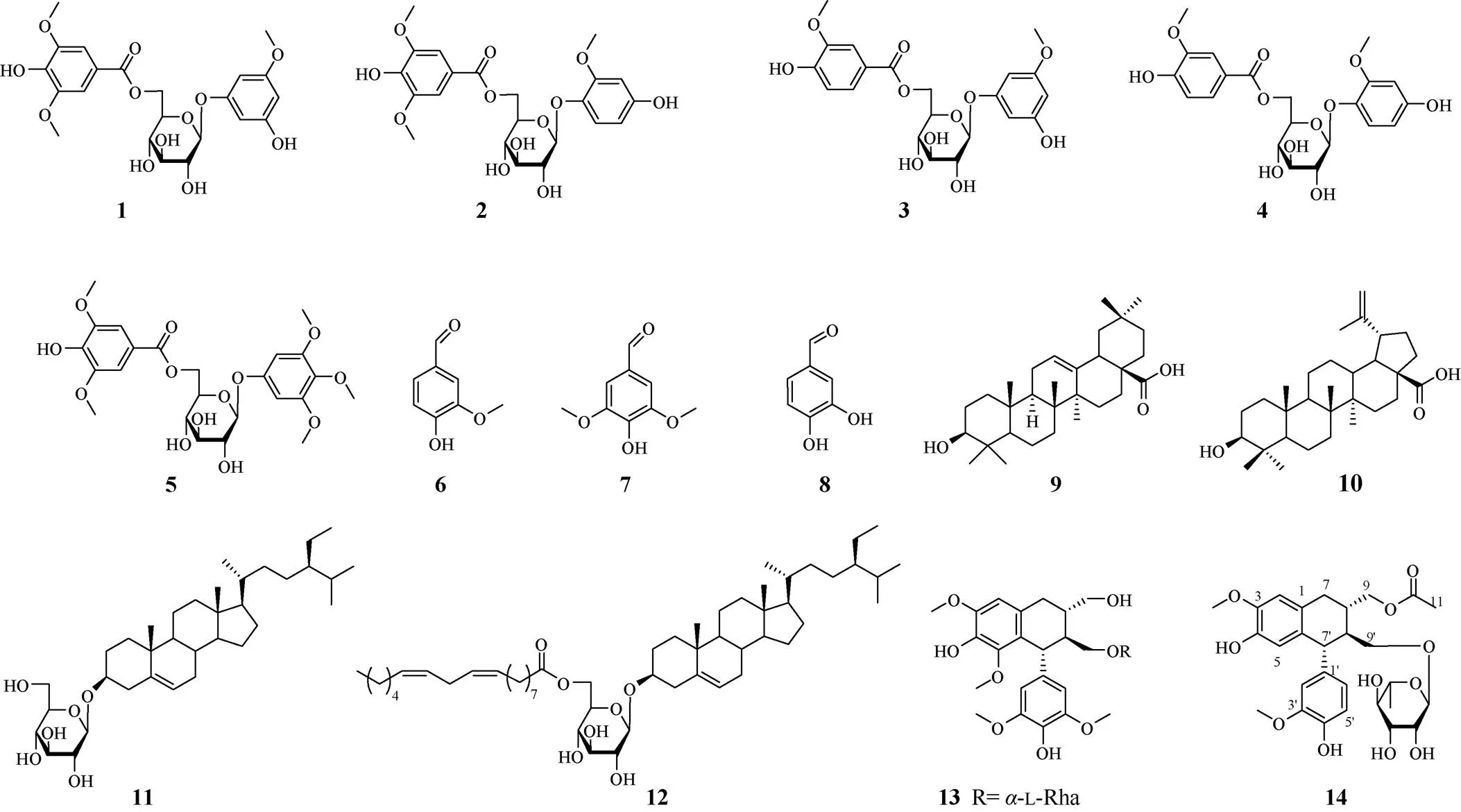
图1 化合物1~14的结构

表1 化合物14的核磁共振氢谱(500 MHz)和碳谱数据(125 MHz)
对比-鼠李糖[13]和-鼠李糖[14]的碳谱数据,化合物14中鼠李糖的碳谱数据与-鼠李糖的一致,表明化合物14中连接的鼠李糖为-构型。化合物14经酸水解、衍生化、HPLC分析,保留时间为22.4 min,l-鼠李糖标品的保留时间为22.5 min, 表明化合物14中的鼠李糖为l构型。
1H NMR中,H-7¢的偶合常数较大,为11.1 Hz,表明H-7¢和H-8¢处于直立键-直立键的相对位置。H2-7的2个质子信号H2.86 (dd, 15.8, 5.0)和2.77 (dd, 15.8, 10.0),其中耦合常数15.8 Hz为H2-7中2个氢之间的2耦合,5.0和10.0 Hz为H2-7中2个氢分别与H-8的3耦合,5.0 Hz表明H-7和H-8处于平伏键-直立键的关系,10.0 Hz表明H-7和H-8处于直立键-直立键的相对位置(图2: B)。化合物14经酸水解后所得苷元部分[]D20=-11.0 (0.1, MeOH), 对比化合物(-)-isolariciresinol的[]D25=-30.0 (12.0, MeOH)[15], 化合物(+)-isolariciresinol的[]D25=+68 (1.0, CHCl3)[16], 表明化合物14苷元部分的立体构型与(-)-isolariciresinol一致。因此,化合物14的鉴定为(-)-9-acetyl-isolariciresinol9¢---l-rhamnopyra- noside (图1)。
通过对比核磁共振波谱和质谱数据,13个已知化合物分别鉴定为5-hydroxy-3-methoxy-phenyl-6-- syringoyl--d-glucopyranoside (1)[17]、高良姜苷A (2)[18]、heterophylloside C[19]、6¢--vanilloy-lisotachio- side (4)[20]、3,4,5-trimethoxyphenyl-6--syringoyl--d- glucopyranoside (5)[21]、香草醛(6)[22]、丁香醛(7)[23]、3,4-二羟基苯甲醛(8)[24]、齐墩果酸(9)[25]、桦木酸(10)[26]、胡萝卜苷(11)[27]、胡萝卜苷亚油酸酯(12)[28]和(±)-lyoniresinol 2---rhamnoside (13)[29]。

图2 化合物14的COSY和关键HMBC (A)及六元环的椅式构象(B)
[1] Deletis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Edita. Florae Reipublicae Popularis Sinicae, Tomus 20 [M]. Beijing: Science Press, 1982. [中国科学院中国植物志编辑委员会. 中国植物志, 第20卷 [M]. 北京: 科学出版社, 1982.]
[2] State Administration of Traditional Chinese Medicine. Chinese Materia Medica, Tomus 5 [M]. Shanghai: Shanghai Science and Technology Publishers, 1999: 365. [国家中医药管理局《中华本草》编委会. 中华本草, 第5卷 [M]. 上海: 上海科学技术出版社, 1999: 365.]
[3] KE J L. Activity of extracts from Casuarinas Barks to scavenge hydroxyl free radicals [J]. Chem Ind For Prod, 2009, 29(4): 97–100. [柯金炼. 木麻黄树皮提取物的清除羟自由基活性 [J]. 林产化学与工业, 2009, 29(4): 97–100. doi: 10.3321/j.issn:0253-2417.2009.04.020.]
[4] LIU H L, ZHANG Y, ZHENG X L, et al. Research ofanti- bacterial activity ofand[J]. J Agric Univ Hebei, 2014, 37(5): 110–113. [刘海隆, 张艳, 郑心力, 等. 木麻黄和地胆草体外抑菌试验研究 [J]. 河北农业大学学报, 2014, 37(5): 110–113. doi: 10.13320/j.cnki.jauh.2014.0123.]
[5] SHAFIQ Y, NAQVI B S, RIZWANI G H, et al. Anti-acne activity ofbark extract: A randomized clinical trial [J]. Bangladesh J Pharmacol, 2014, 9(3): 337–341. doi: 10.3329/bjp.v9i3. 19342.
[6] EL-TANTAWY W H, MOHAMED S A H, HALEEM E N A A. Evaluation of biochemical effects ofextract on gentamicin-induced nephrotoxicity and oxidative stress in rats: Phytochemical analysis [J]. J Clin Biochem Nutr, 2013, 53(3): 158–165. doi: 10.3164/jcbn.13-19.
[7] CHEN C M, CHEN I C, CHEN Y L, et al. Medicinal herbs(Blume) DC.,L. and(L.) Moench protect human cells from MPP+damage via inducingexpression [J]. Phytomedicine, 2016, 23(12): 1422–1433. doi: 10.1016/j.phymed.2016.08.004.
[8] AHER A N, PAL S C, PATIL U K, et al. Evaluation of anthistaminic activity offrost (Casuarinaceae) [J]. Pharmaco- logyonline, 2009, 1: 1144–1149.
[9] JIN Y, XU Y T, HUANG Z W, et al. Metabolite pattern in root nodules of the actinorhizal plant[J]. Phytochemistry, 2021, 186: 112724. doi: 10.1016/j.phytochem.2021.112724.
[10] XU X Y, CHEN L R, LUO Y C, et al. Discovery of cyclic diarylhe- ptanoids as inhibitors against influenza A virus from the roots of[J]. J Nat Prod, 2022, 85(9): 2142–2148. doi: 10.1021/acs.jnatprod.2c00335.
[11] GOU P, XIAO Y Y, LV L, et al. Hydroquinone and terpene glucosides fromand their lipase inhibitory activity [J]. Fitoterapia, 2018, 130: 89–93. doi: 10.1016/j.fitote.2018.08.010.
[12] KIM H J, WOO E R, PARK H. A novel lignan and flavonoids from[J]. J Nat Prod, 1994, 57(5): 581–586. doi: 10. 1021/np50107a003.
[13] KITE G C, STONEHAM C A, VEITCH N C. Flavonol tetraglycosides and other constituents from leaves of(Legu- minosae) and related taxa [J]. Phytochemistry, 2007, 68(10): 1407– 1416. doi: 10.1016/j.phytochem.2007.03.004.
[14] ABEYGUNAWARDANA C, BUSH C A, CISAR J O. Complete structure of the polysaccharide fromJ22 [J]. Biochemistry, 1990, 29(1): 234–248.
[15] CUTILLO F, D’ABROSCA B, DELLAGRECA M, et al. Lignans and neolignans from: Effects on seed germination and plant growth [J]. J Agric Food Chem, 2003, 51(21): 6165−6172. doi: 10.1021/jf034644c.
[16] FONSECA S F, DE PAIVA CAMPELLO J, BARATA L E S, et al.13C NMR spectral analysis of lignans from[J]. Phytochemistry, 1978, 17(3): 499–502. doi: 10.1016/S0031-9422(00) 89347-4.
[17] KHIEV P, CHIN Y W, CAI X F, et al. A new phenolic glycoside from[J]. J Korean Soc Appl Biol Chem, 2010, 53(2): 253–255. doi: 10.3839/jksabc.2010.040.
[18] AN N, LIN J, YANG S L, et al. A new glycoside from[J]. Acta Pharm Sin, 2006, 41(3): 233–235. [安宁, 林佳, 杨世林, 等. 高良姜根茎中的一个新糖苷 [J]. 药学学报, 2006, 41(3): 233–235. doi: 10.3321/j.issn:0513-4870.2006.03.009.]
[19] LI D X, YIN Y P, LI J, et al. Bibenzyl and phenolic glycosides from[J]. Phytochem Lett, 2015, 11: 220–223. doi: 10.1016/j.phytol.2015.01.003.
[20] YANG X W, WANG J S, MA Y L, et al. Bioactive phenols from the leaves of[J]. Planta Med, 2007, 73(13): 1415– 1417. doi: 10.1055/s-2007-990235.
[21] PAN H F, LUNDGREN L N. Rhododendrol glycosides and phenyl glucoside esters from inner bark of[J]. Phyto- chemistry, 1994, 36(1): 79–83. doi: 10.1016/S0031-9422(00)97017-1.
[22] ZHOU Y J, WANG J H, XUE Y F, et al. Study on chemical consti- tuents from active ethyl acetate fraction of[J]. Chin Trad Herb Drugs, 2021, 52(17): 5218–5225. [周宇娟, 王俊豪, 薛亚甫, 等. 铁皮石斛醋酸乙酯部位化学成分研究 [J]. 中草药, 2021, 52: 5218–5225. doi: 10.7501/j.issn.0253-2670.2021.17.013.]
[23] YU R, ZHANG Y, ZHENG D D, et al. Isolation and identification of phenolic components fromPursh [J]. Chin J Med Chem, 2021, 31(3): 203–208. [于芮, 张颖, 郑丹丹, 等. 赶黄草中酚类成分的分离与鉴定 [J]. 中国药物化学杂志, 2021, 31(3): 203–208. doi: 10.14142/j.cnki.cn21-1313/r.2021.03.005.]
[24] CHEN Y F, LIU S J, WANG F. Sesquiterpenoids of[J]. China J Chin Mat Med, 2012, 37(7): 946–950. [陈云飞, 刘守金, 王飞. 阔带凤丫蕨倍半萜类化学成分研究 [J]. 中国中药杂志, 2012, 37(7): 946–950. doi: 10.4268/cjcmm20120717.]
[25] SEVINDIK H G, OZGEN U, ATILA A, et al. Phtytochemical studies and quantitative HPLC analysis of rosmarinic acid and luteolin 5--d-glucopyranoside onsubspvar[J]. Chem Pharm Bull, 2015, 63(9): 720–725. doi: 10.1248/ cpb.c14-00877.
[26] KHALIQ S, VOLK F J, FRAHM A W. Phytochemical investigation of[J]. Planta Med, 2007, 73(1): 77–83. doi: 10. 1055/s-2006-951766.
[27] FAIZI S, ALI M, SALEEM R, et al. Complete1H and13C NMR assignments of stigma-5-en-3---glucoside and its acetyl derivative [J]. Magn Reson Chem, 2001, 39(7): 399–405. doi: 10.1002/mrc.855.
[28] LONG Z M, WU L J, JIANG B Y, et al. Chemical constituents from the seeds ofBlume (Ⅲ) [J]. J Shenyang Pharm Univ, 2008, 25(11): 883–885. [龙志敏, 吴立军, 江冰娅, 等. 板栗种仁的化学成分(Ⅲ) [J]. 沈阳药科大学学报, 2008, 25(11): 883–885.]
[29] KANEDA N, KINGHORN A D, FARNSWORTH N R, et al. Two diarylheptanoids and a lignan from[J]. Phytochemistry, 1990, 29(10): 3366–3368. doi: 10.1016/0031-9422(90) 80220-B.
Chemical Constituents of Ethyl Acetate Extract ofRoots
GAO Ruanling1,2, LUO Yucai2,3, MA Yongyi2,3, WANG Guokai1*, ZHOU Zhongyu1,2,3*
(1. School of Pharmacy, Anhui University of Chinese Medicine, Anhui Province Key Laboratory of Research & Development of Chinese Medicine, Hefei 230012, China; 2. Key Laboratory of South China Agricultural Plant Molecular Analysis and Genetic Improvement & Guangdong Provincial Key Laboratory of Applied Botany, South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 3. South China National Botanical Garden, Guangzhou 510650, China)
To clarify the chemical constituents in, fourteen compounds were isolated by organic solvent extraction, fractionation, and a variety of chromatographic separation techniques. Based on spectroscopic data, their structures were identified as 5-hydroxy-3-methoxyphenyl-6--syringoyl--d-glucopy- ranoside (1), alpinoside A (2), heterophylloside C (3), 6²--vanilloylisotachioside (4), 3,4,5-trimethoxyphenyl- 6--syringoyl--d-glucopyranoside (5), vanillin (6), syringaldehyde (7), 3,4-dihydroxybenzaldehyde (8), oleanolic acid (9), betulinic acid (10),-sitosterol glucoside (11), daucosterol-6¢-linoleate (12), (±)-lyoniresinol 2---rham- noside (13), and (-)-9-acetyl-isolariciresinol9¢---l-rhamnopyranoside (14). Among them, compound 14 is a new lignan derivative.
; Chemical component; Lignan
10.11926/jtsb.4747
2022-11-10
2022-12-30
国家自然科学基金项目(31970376);国家重点研发项目(2021YFC3100401)资助
This work was supported by the National Natural Science Foundation of China (Grant No. 31970376), the National Key Research and Development Program of China (Grant No. 2021YFC3100401).
高阮玲(1997年生),女,硕士研究生,研究方向天然药物化学。E-mail: 2829420594@qq.com
通讯作者Corresponding author.E-mail: zhouzhongyu@scbg.ac.cn; wanggk@ahtcm.edu.cn

