基于心电特征改良和可变输入卷积神经网络的生物识别
王 轩, 蔡文杰, 朱卫彬
(上海理工大学 健康科学与工程学院, 上海 200093)
0 引 言
生物识别是一种基于生理或行为特征来识别个体的重要手段,如今,通过生物识别实现用户认证的技术受到了研究人员的广泛关注。 最常用的生物特征有指纹、掌纹、声音、虹膜、脑电和人脸识别等,而心电图(Electrocardiogram,ECG)作为一种安全且隐私的生物信号,由于不同个体在心脏电生理、几何特征上存在差异,也可应用于生物识别领域。 同时,考虑到心脏处于身体内部,难以篡改、模拟或者复制,且只能从活着的个体中捕获[1],另外据研究可知,脑电需要从人体头皮上采集,通常会受到头发的干扰,而心电通过手指就能够采集,比较容易采集到,这也是心电信号生物识别的重要优势。
心电生物识别过程一般为预处理、特征提取和分类。 在采集心电的过程中由于受到环境以及人体活动的影响,心电中通常会包含噪声,如基线漂移、工频干扰、肌电干扰和运动伪迹等。 预处理主要是为了将噪声去除,特征提取主要是提取信息,而这些信息的多样性对最终的识别精度有很大的影响。Biel 等学者是最早将心电图应用于人体识别的团队之一[2],在2001 年从12 导联心电图记录中选取了360 个基准特征对20 名受试者进行分类。 Anthony等学者对基于心电的生物特征识别系统中的心电信号预处理、特征提取、特征选择和特征转换进行了综述和讨论[3],还介绍了不同的技术和在多模态生物识别系统中信息融合的最新方法。 在心电识别的文献中,大量地使用了各种各样的机器学习和模式识别技术。 包括基于传统方法改进的一维LDP[4]和二阶差分图[5],分别实现了93.33%和95.12%的准确率。 机器学习算法中,Chu 等学者[6]提出了一种并行多尺度一维残差网络,实现了98.24%的准确率。 其他文献[7-9]提出了基于支持向量机(SVM)、循环神经网络(RNN)、长短时记忆网络(LSTM)的方法。
1 方法与模型
1.1 方法概述
ECG 是一种连续的、半周期的信号,由一系列反复出现的P 波、QRS 波和T 波组成,对于生物识别,需要心电信号的不变段。 图1 展示了USST-ID数据库中3 个不同人的以R 峰为重合点的40 s 心拍集合图。 图1 中,绿色和红色分别为静息状态和运动后的20 s 心拍集合图。 可以看到,QRS 波周围的信号基本保持不变,并且个体之间有明显的差异。每个心拍的P 波和T 波相对于R 波的位置会有小幅度的偏移,但形状相似,因此对于基于心拍的身份识别来说,P 波、QRS 波、T 波是最重要的特征。
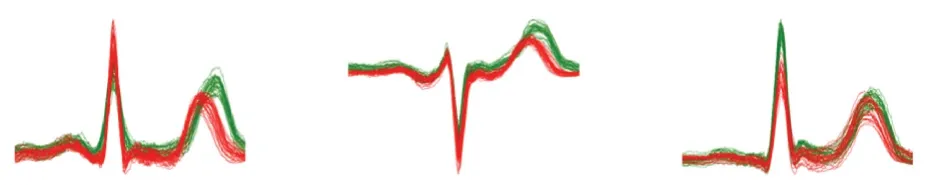
图1 USST-ID 运动前后心拍集合图Fig. 1 USST-ID set of heart beats before and after exercise
在基于心拍的生物识别方法中,R 峰最容易定位[10],提出的方法基于R 峰进行心电分割。 目前基于卷积神经网络的生物识别有一个限制,输入必须具有相同的维度,因此常用的方法有:
(1)以R 峰为中心向两边取固定长度的心电记录。
(2)根据心电特征截取一个完整的心拍,由于每次心拍的长度并不相同,选择一个合适的长度进行截断或填充。
(3)截取一个完整的心拍,将心拍重采样到相同长度。
本文提出了一种新颖的方法,根据心电特征设计了一种专用于心电图的卷积神经网络(ECGNet),通过改变网络中池化层的池化策略来解决心拍长度不一致的问题,避免了固定长度、截断和填充以及重采样带来的心电段缺失或变形问题。 4 种方法的实验对比过程如图2 所示。 对于一段初始心电,首先通过小波变换去除噪声,再采用不同的分割方法,接着将处理好的心电信号输入到神经网络中,最后实现生物识别。 本文将在1.2 节中讨论基于小波变换的心电信号去噪,在1.3 节中介绍心电信号的分割,在1.4 节讨论4 种方法的实现。
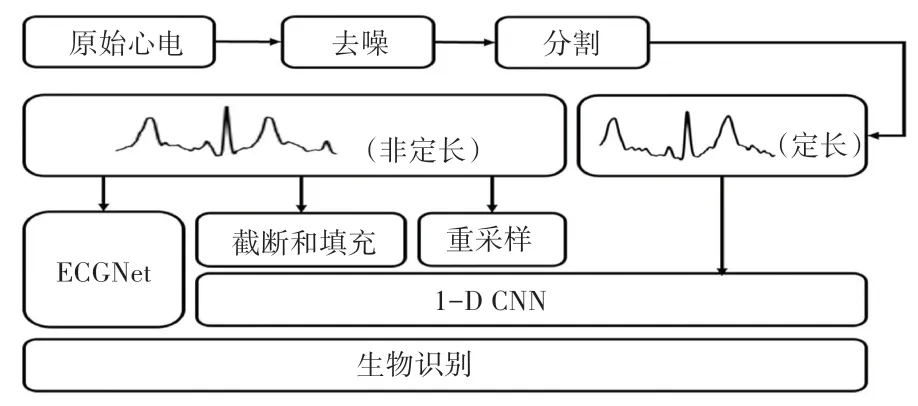
图2 实验流程图Fig. 2 Experimental flow chart
1.2 小波变换预处理
小波变换能有效地进行信号的分解与重构[11]。噪声主要集中在高频信号中,而基线漂移在低频信号中,使用小波变换将原始心电信号进行10 层分解,将相应的高频信号和低频信号置为0,接着再重构信号,即可得到干净的心电信号。 原信号和处理后的信号的对比如图3 所示。
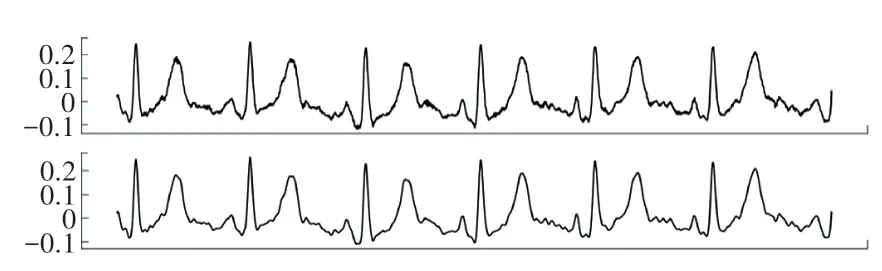
图3 小波变换去噪前后对比图Fig. 3 Comparison of wavelet transform before and after denoising
1.3 心电信号分割
不定长的分割方法以R 峰为中心,取不定时间长度为T的心电信号。T为当前R 峰的上一个R 峰到当前R 峰的下一个R 峰的时间长度减去一个QRS 波的时间长度,一个QRS 波的平均时间长度为100 ms,T值、及取得的心电信号区间的数学定义表达式分别如下:
其中,R为当前R 峰的坐标;R1为当前R 峰的上一个R 峰的坐标;R2为当前R 峰的下一个R 峰的坐标;f为心电信号的采样率。
定长的分割方法需要选取固定时间长度T。 心电信号分割如图4 所示。 研究可知,QRS 波群的持续时间为80~120 ms。 PR 间期为120 ~200 ms,QT间期为300~430 ms。 因此,P 波开始点距离R 峰的时间长度TPR为160~260 ms,T波结束点距离R 峰的时间长度TRT为240~390 ms。 假设研究中PR 间期和QT 间期都取最大值,同时使R 峰在中心,则取T为780 ms即可涵盖了一个完整的P、QRS、T 波。不定长和定长分割结果,如图5 所示。 时间Tmin值可由如下公式计算求出:

图4 心电信号分割Fig. 4 ECG signal segmentation
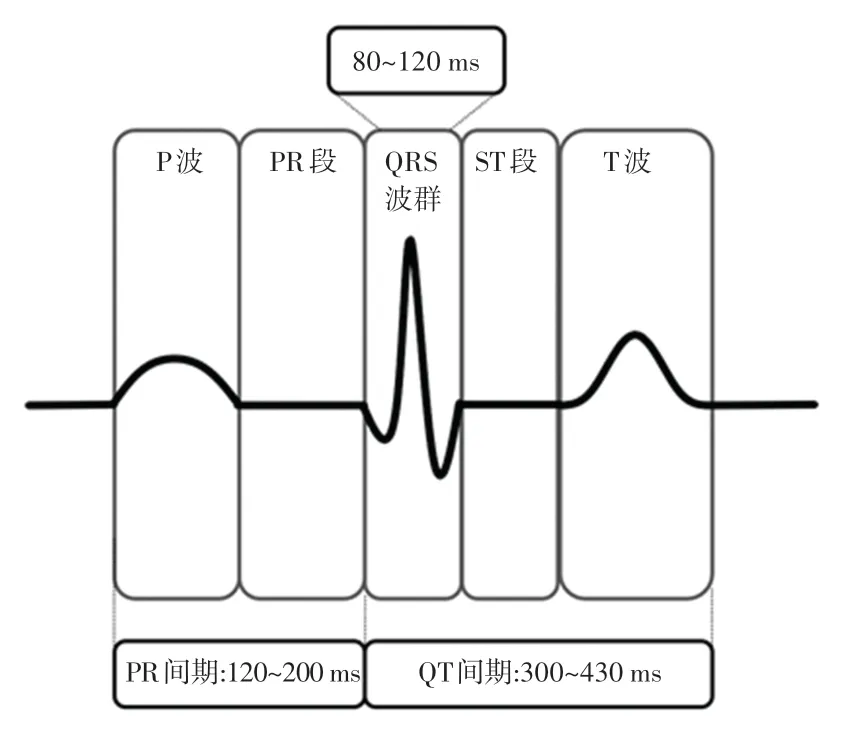
图5 心电图图解Fig. 5 Electrocardiogram diagram
1.4 网络结构
提出的ECGNet 主要是将卷积神经网络的最后一层池化层改为ECGPool。 非定长分割信号输入的卷积层和池化层并没有要求输入维度必须相同,但全连接层要求输入具有相同维度。 这里是将提取的不定长特征输入ECGPool 层,就可以保证固定长度的输入。 实现原理如图6 所示。
由图6 可以见到,首先将原始心电图分成3 段,在心电图中,取PR 间期的平均时间为160 ms,取QRS 波的持续平均时间为100 ms,取QT 间期的平均时间为360 ms,因此P 波到R 峰的平均时间为210 ms,T 波到R 峰的平均时间为310 ms,所以中间段的时间长度T2为520 ms,设左边剩余时间段为T1,右边剩余时间段为T3,则:

图6 ECGNet 模型的原理Fig. 6 Principles of the ECGNet model
其中,T2段包含了最重要的P 波、QRS 波、T波,T1段和T3段包含了心电图的剩余特征。 将分段后的心电信号使用相同的卷积核、池化核、步长以及填充大小进行卷积池化,则输出的特征在最后一个维度依旧保持比例关系,设最后一个维度的大小为D1,D2,D3, 卷积池化对心电长度的缩小比例为ρ,则:
T2段的时间是固定的520 ms,因此D2是定长的,特征D2采用最大池化策略。 而T1段、T3段的时间是不定长的,因此D1和D3也是不定长的。 提出了一种分段最大池化(SMP)方法可以将不定长的特征池化为定长,原理如图7 所示。 由图7 可知,对于长度为n的输入,若要使输出长度为m, 则首先将n进行填充至m的整数倍,然后平均分成m份,对每一份进行全局最大池化,得到m个数据,即无论输入的长度是多少,最后的输出维度取决于m的数值。 这里,填充长度(padding) 、 池化核的大小(kernel_size)、以及将这3 部分池化结果进行拼接的数学计算公式依次列示如下:

图7 SMP 模块的实现Fig. 7 Implementation of SMP module
2 实验
2.1 数据库
使用ECG-ID 数据库[12]和USST-ID 数据库,ECG-ID 包含了90 个人的共310 条心电记录,每条记录20 s,采样率为500 Hz。 USST-ID 是本文研究团队自行构建的数据库,来自117 名在校本科生,采集了每个人静息状态下和运动后(20 个深蹲)的心电记录,共234 条记录,每条20 s,采样频率为500 Hz。
2.2 实验方法
为了突出本文方法相比于传统卷积神经网络的优势,前几层的参数保持一致,将网络最后一层池化层替换为提出的ECGPool。 在整个训练过程中,数据库的80%用于训练网络参数,10%用于验证,若验证的准确率在3 次epoch中都没有提升,则保存准确率最高的那次模型及参数,最后10%用于测试模型的鲁棒性。 采用均方误差作为损失函数,使用Adam算法进行参数优化,学习率设为0.001,使用网格搜索进行参数优化。 由于ECG-ID 数据不均衡,使用平均准确率作为评价指标,计算方法见式(11):
其中,acci表示每个类别的准确率。
2.3 实验结果和分析
表1 是固定长度的结果,超参数为固定时间的长度,这个时间段内的心电信号涵盖了一个完整的P 波、QRS 波及T 波,但由于没有考虑心率对心拍长度的影响导致在USST-ID 上表现不佳。
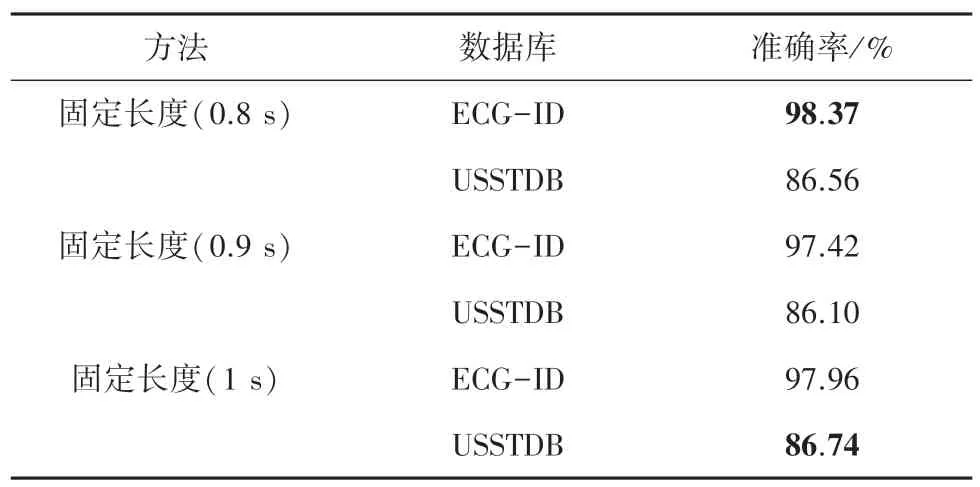
表1 固定长度Tab. 1 Fix length
表2 是重采样的结果,超参数为重采样后的样本点数。 相比其他3 种方法效果不理想,究其原因主要在于重采样会使P 波、QRS 波、T 波这些重要的特征产生形变。
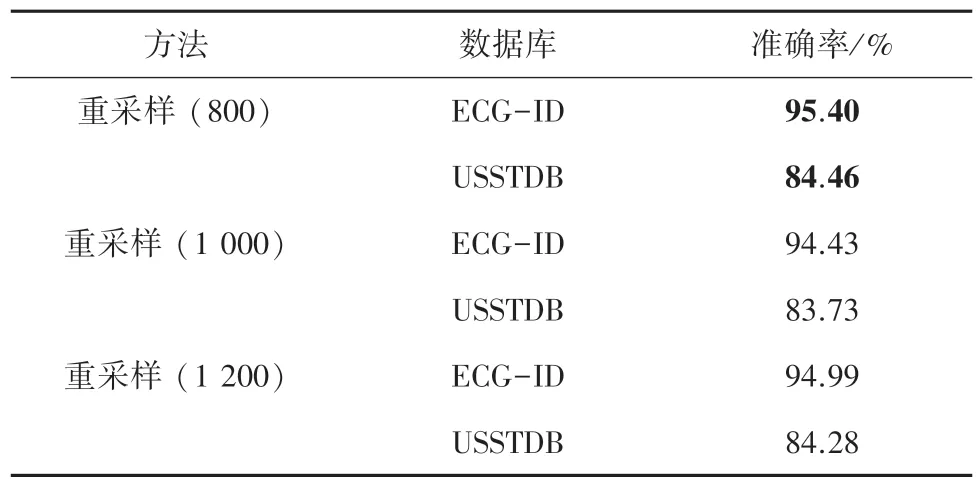
表2 重采样Tab. 2 Resampling
表3 是截断和填充的结果,超参数为截断和填充后的样本点数。 截断的思想和定长一样,但是定长的心电信号两端的特征受心率影响较大,填充减少了这种影响,因此在USST-ID 中的效果高于定长方法。

表3 截断和填充Tab. 3 Crop and padding
表4 是ECGNet 的结果,超参数为SMP 池化后的神经元个数,可以看到4 个神经元时,在ECG-ID上的准确率达到了98.75%,高于其他3 种方法,也高于目前论文[4-6]提出的方法。 8 个神经元时,在USST-ID 上的准确率达到了90.47%,远高于另外3种方法,表明ECGNet 对运动及静息状态下的心电生物识别有更好的适应性。 因为ECGNet 中的ECGPool 层完整提取了心电信号中重要的P 波、QRS 波和T 波特征,同时将其它特征提取成固定数量的神经元,平衡了心电不同段的重要程度。
表5 是4 种方法的最优超参数的结果的汇总。由表5 可以看到,提出的方法在2 种数据库上的表现都是最好的,尤其在同时具有静息和运动心电信号的USST-ID数据中有巨大的优势。
3 结束语
本文根据心电图的独有特征提出了一种接受可变输入的卷积神经网络的心电生物识别方法,对比了其他3 种目前主流的心电预处理加传统卷积神经网络的方法,并在ECG-ID 数据库和自行构建的USST-ID 数据库中进行验证,准确率分别达到了98.75%和90.47%。 结果表明,提出的基于心电特征改良的方法相比目前的卷积神经网络具有一定的优势,并且在静息和运动心电信号中这一优势尤显突出。 同时,在心电生物识别领域也可以将这种方法用于改良其他网络结构。 但是,提出的方法只验证了在健康人群中的有效性,还需要进一步验证在心律失常人群中的鲁棒性。

