CT 肝细胞外基质体积分数评估慢性丙型肝炎患者持续病毒学应答前后的肝纤维化变化
梁占东 刘燕霞 谢晋 邹殿俊 刘兰 崔书君
随着针对慢性丙型肝炎(chronic hepatitis C,CHC)直接抗病毒药物的应用,其能达到90%以上的获得持续病毒学应答(sustained virological response,SVR)。有研究证实根除肝损伤根本病因可以使肝纤维化甚至早期肝硬化得到逆转[1,2]。目前,肝脏组织学活检虽然作为肝纤维化或肝硬化诊断的“金标准”,但因其创伤性及局限性限制了对肝纤维化逆转监测的应用,从而突显了非创伤性评估手段的必要性[3]。有研究[4]已证实利用传统增强CT 平衡期图像所获得心肌细胞外基质体积分数(extracellular volume fraction,ECV)与心肌纤维化组织学标准相关性很好,为探索其在评估肝脏弥漫性间质扩张起关键作用的疾病中的应用提供基础。国外有研究[5]证实平衡CT 成像测量的肝细胞外基质体积分数(hepatic extracellular volume fraction,HECV)与活检来源的胶原纤维面积比例及血清增强纤维化评分密切相关,表明HECV 可以量化慢性肝病的肝纤维化。国内学者亦利用CT 获取的HECV 与血清血Forns 指数的相关性分析,指出HECV 与肝纤维化程度存在正相关关系[6]。总之,HECV 已被认为是可精准评估肝纤维化程度的重要指标[7]。目前,针对CHC 患者在抗病毒治疗前后HECV 变化的相关报道甚少。为此,本研究基于CHC 患者经抗病毒药物初治获得SVR 后随访队列,分析HECV 与CHC 患者在抗病毒治疗前后肝纤维化变化的关系。
资料与方法
1.研究对象
所有患者来源于CHC 初治临床随访队列(病例收集:2019 年12 月~2022 年12 月)。本研究经河北北方学院附属第一医院医学伦理委员会批准(批号:W2022024)。所有纳入研究患者均签署书面知情同意书。入选标准:(1)年龄18~70 岁;(2)慢性丙型肝炎诊断符合《丙型肝炎防治指南(2019年版)》[8],抗病毒治疗后实现SVR[(按照治疗方案完成治疗12 或24 周后,血液中检测不到丙型肝炎病毒(hepatitis virus C,HCV)RNA];(3)能完成基线及获得SVR 后随访期腹部增强CT、肝穿刺病理检查及血液检测。增强CT 检查日早晨空腹抽血化验血常规,后1~2 周内完成肝脏穿刺。排除标准:(1)合并其他病毒性肝炎、药物性、自身免疫性肝病等慢性肝病;(2)肝脏巨大占位性病变影响影像学测量;(3)CT 图像质量无法满足测量要求者;(4)肝硬化失代偿期;(5)妊娠、哺乳期女性;(6)既往肝脏外伤史或手术史。
2.腹部增强CT 检查
完成基线时和获得SVR 后腹部增强CT 检查,间隔时间6~18 个月。扫描前禁食、禁水8 h。使用Canon Aquilion ONE 320 排容积CT 进行肝脏平扫和三期增强扫描。患者足先进、仰卧位,扫描范围为膈顶至肝脾下缘,每一期屏气1 次完成扫描。使用高压注射器经肘前静脉注射对比剂碘克沙醇(320 mg I/ml)约50~80 ml,流率为3.5 ml/s,后以相同流率注入生理盐水30 ml。扫描参数:管电压100 kV,管电流为自动毫安秒,重组层厚0.5 mm,重组技术为自适应迭代降噪算法(adaptive iterative dose reduction,AIDR),层间距0.25 mm,视野32 cm×32 cm,矩阵512×512,机架旋转速度0.35 s/r;增强扫描时间为动脉期25 s、门静脉期60 s、延迟期180 s。
3.HECV 测量方法
采用Couinaud 肝段划分法将肝脏分为8 段,在每个肝段选择约直径为1.0 cm 兴趣区(region of interest,ROI),分别在平扫及平衡期测量肝脏8 段CT 值(选择ROI 时避开血管、胆管及占位性病变),另外分别测量平扫及平衡期主动脉CT 值(ROI 在避开血管壁的情况下尽量大)(图1~3)。上述测量进行3 次,取平均值,并分别将平衡期CT值与平扫期CT 值相减,得到肝实质(Eliver)及主动脉(Eaorta)绝对强化值。在平衡状态下,可以通过肝实质、主动脉绝对强化值及全血红细胞压积(Hct)可以计算出HECV,计算公式:
4.肝脏组织学评价
根据治疗前和获得SVR 后肝穿刺组织病理学诊断结果评价慢性丙型肝炎肝纤维化变化的结局。所有肝穿刺活检标本均采用Metavir 评分系统评估肝纤维化分期[11]。根据治疗前后Metavir 评分变化分为3 组:逆转组(Metavir 评分下降≥1)、稳定组(Metavir 评分无变化)和进展组(Metavir 评分升高≥1)。
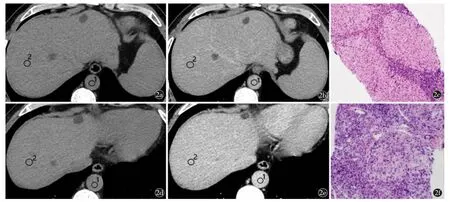
图2 女,53 岁,慢性丙型肝炎患者SVR 后肝纤维化程度进展。a)治疗前肝脏平扫CT 值44 HU(ROI 1),同层面主动脉平扫CT 值56 HU(ROI 2);b)平衡期肝脏Ⅷ段CT 值86 HU(ROI 1),同层面主动脉CT 值84 HU(ROI 2);c)HE 染色(×40),汇管区扩大,纤维组织增生,纤维间隔易见;d)治疗后肝脏平扫CT 值41 HU(ROI 1),同层面主动脉平扫CT 值63 HU(ROI 2);e)平衡期肝脏Ⅷ段CT 值94 HU(ROI 1),同层面主动脉CT 值89 HU(ROI 2);f)HE 染色(×40),汇管区扩大,纤维间隔形成
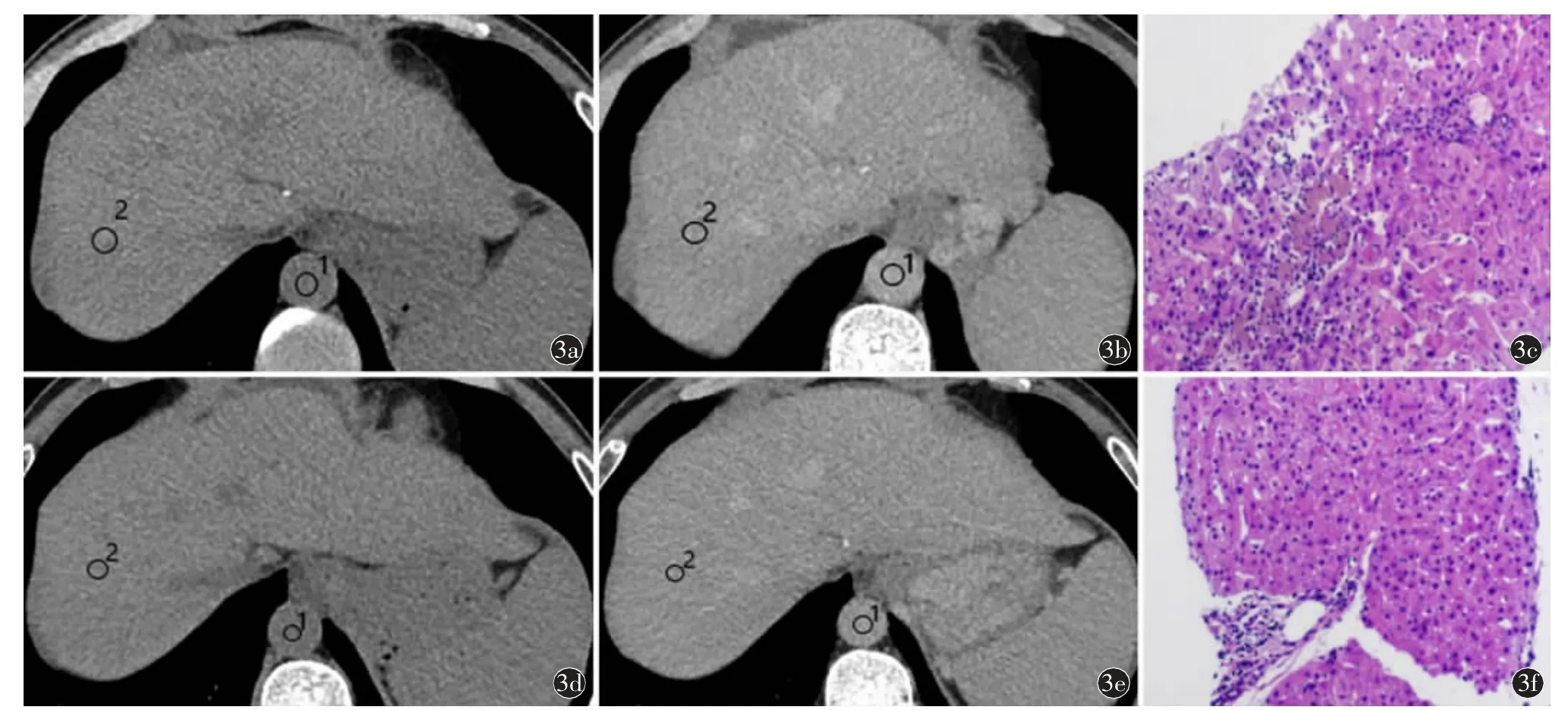
图3 男,65 岁,慢性丙型肝炎患者SVR 后肝纤维化程度稳定。a)治疗前肝脏平扫CT 值56 HU(ROI 1),同层面主动脉平扫CT 值59 HU(ROI 2);b)平衡期肝脏Ⅷ段CT 值104 HU(ROI 1),同层面主动脉CT 值91 HU(ROI 2);c)HE 染色(×40),汇管区不明显扩大,纤维组织轻度增生,少数炎细胞浸润;d)治疗后肝脏平扫CT 值59 HU(ROI 1),同层面主动脉平扫CT 值87 HU(ROI 2);e)平衡期肝脏Ⅷ段CT 值110 HU(ROI 1),同层面主动脉CT 值89 HU(ROI 2);f)HE 染色(×40),汇管区稍扩大,少量炎细胞浸润
5.统计学方法
统计学分析采用SPSS 20.0 及MedCalc 软件。符合正态分布的计量资料用(x±s)表示,非正态分布的计量资料以M(IQR)表示;多组间比较采用Oneway ANOVA(方差齐)检验或Kruskal-wallis H检验(方差不齐)。治疗前与获得SVR 后肝脏HECV 值的比较采用Wilcoxon 配对秩和检验。治疗前及获得SVR 后的HECV 值与Metavir 评分的相关性分析釆用Pearson 或Spearman 相关分析。利用受试者工作(receiver operating characteristic,ROC)曲线分析HECV 预测效能,并采用独立ROC曲线下面积对比Z 检验分析HECV 在治疗前与获得SVR 后诊断预测进展期肝纤维化/肝硬化的差异。P<0.05 为差异有统计学意义。
结果
1.不同肝纤维化结局CHC 患者基线特征
本研究共收集94 例有治疗前、后两次肝穿刺和腹部增强CT 检查且获得SVR 的CHC 患者。患者基线特征见表1。根据病理学逆转标准,CHC 获得SVR 后8 例(8.50%)患者被判断为纤维化逆转,71 例(75.53%)为 稳 定,15 例(15.97%)为 进展。丙氨酸转氨酶(alanine aminotransferase,ALT)水平在进展组较高,且差异有统计学意义;稳定组与进展组患者的HECV 均高于逆转组,但稳定组与进展组之间HECV 差异无统计学意义。其他基线特征三组间差异无统计学意义。
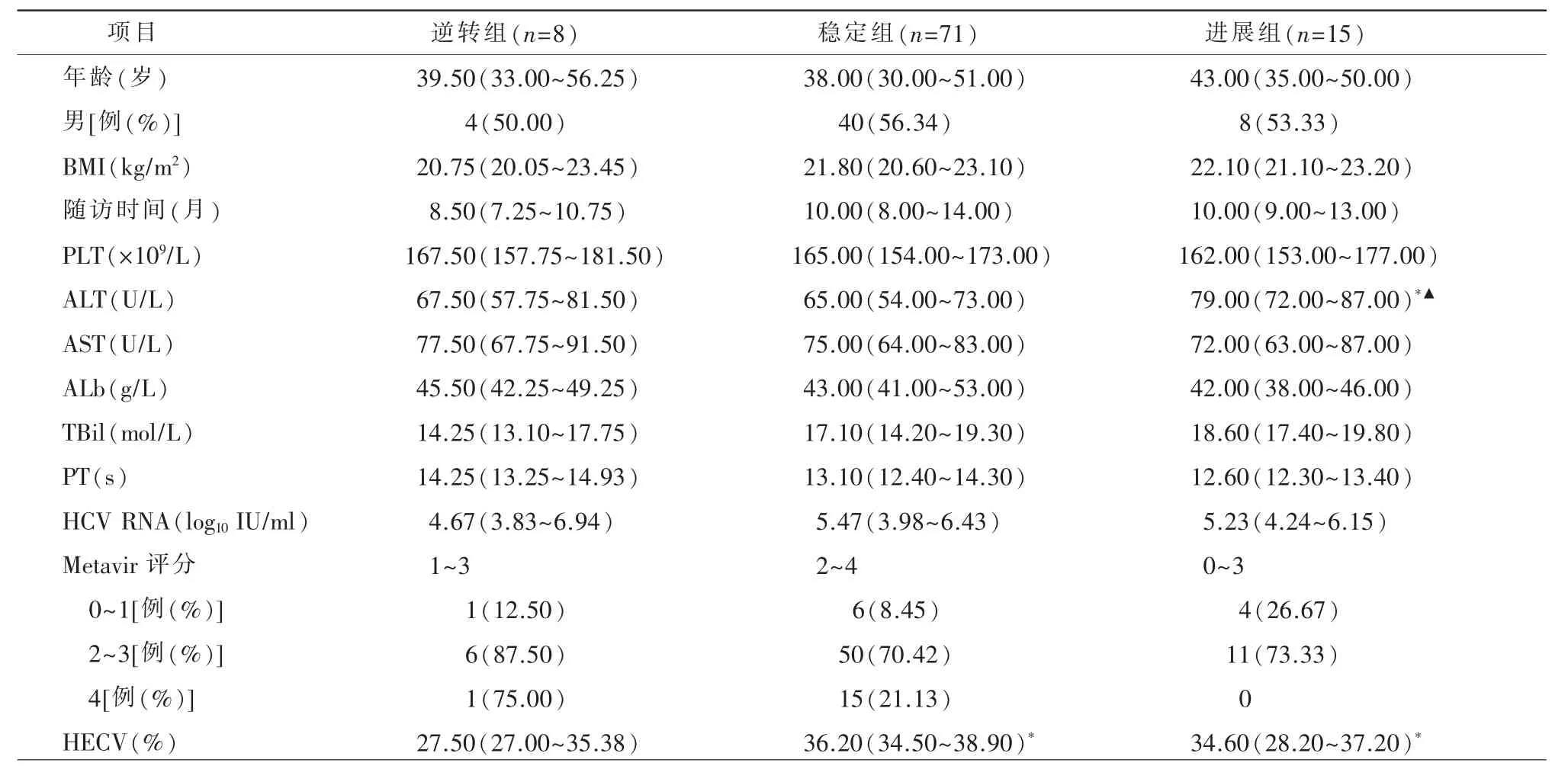
表1 不同肝纤维化变化结局的慢性丙型肝炎患者基线资料比较
2.不同肝纤维化结局CHC 患者HECV 的变化
逆转组在获得SVR 后HECV 值较治疗前有所下降,并且进展组患者获得SVR 后的HECV 值要明显高于治疗前,且有统计学意义。稳定组患者治疗前与获得SVR 后的HECV 值的差异无统计学意义(表2)。
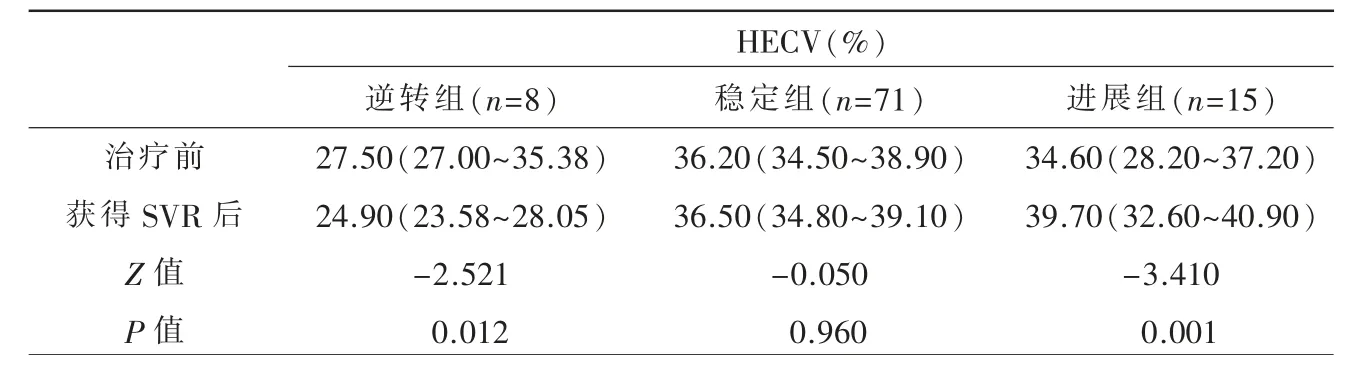
表2 不同肝纤维化变化结局的慢性丙型肝炎患者HECV 的变化
3.CHC 患者治疗前及获得SVR 后的HECV 值与Metavir 评分的关系
CHC 患者治疗前的HECV 值与肝脏Metavir评分呈显著正相关(r=0.719,P<0.05);获得SVR后的HECV 值与肝脏Metavir 评分仍呈显著正相关(r=0.750,P<0.05)。
4.HECV 值诊断治疗前及获得SVR 后进展期肝纤维化、肝硬化的效能比较
CHC 患者获得SVR 后HECV 值诊断预测进展期肝纤维化的AUC [0.761(95%CI:0.664~0.858)]与治疗前AUC [0.711(95%CI:0.606~0.816)]差异无统计学意义(Z=-0.686,P>0.05)。获得SVR后HECV 值诊断预测肝硬化的AUC [0.940(95%CI:0.877~1.000)]与治疗前AUC [0.930(95%CI:0.874~0.986)]差异无统计学意义(Z=0.232,P>0.05)(表3、图4~7)。
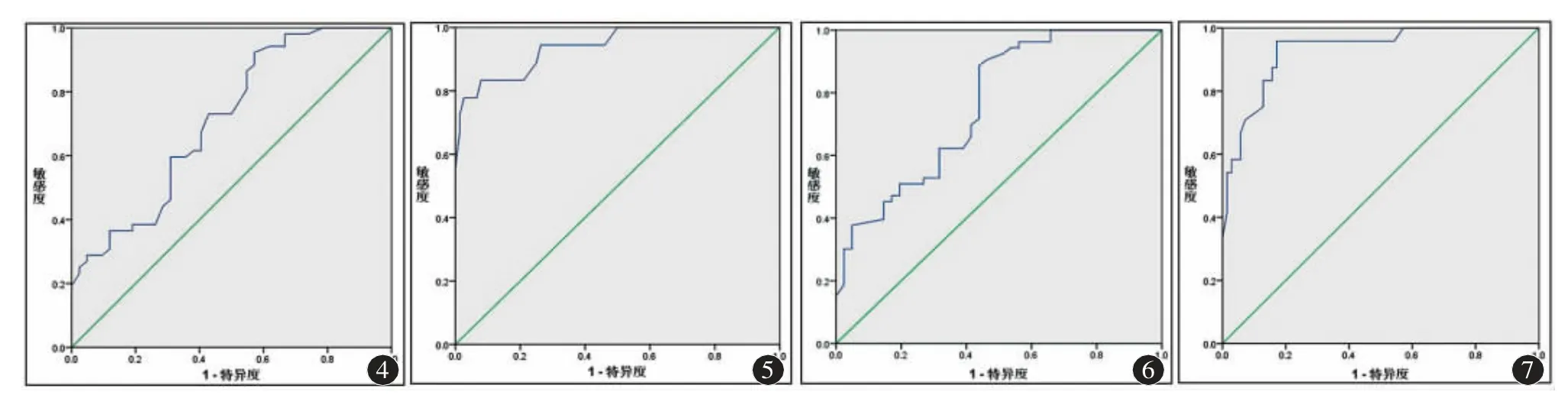
图4 CHC 患者治疗前HECV 诊断进展期肝纤维化的ROC 曲线 图5 CHC 患者治疗前HECV 诊断肝硬化的ROC 曲线 图6 CHC患者获得SVR 后HECV 诊断进展期肝纤维化的ROC 曲线 图7 CHC 患者获得SVR 后HECV 诊断肝硬化的ROC 曲线
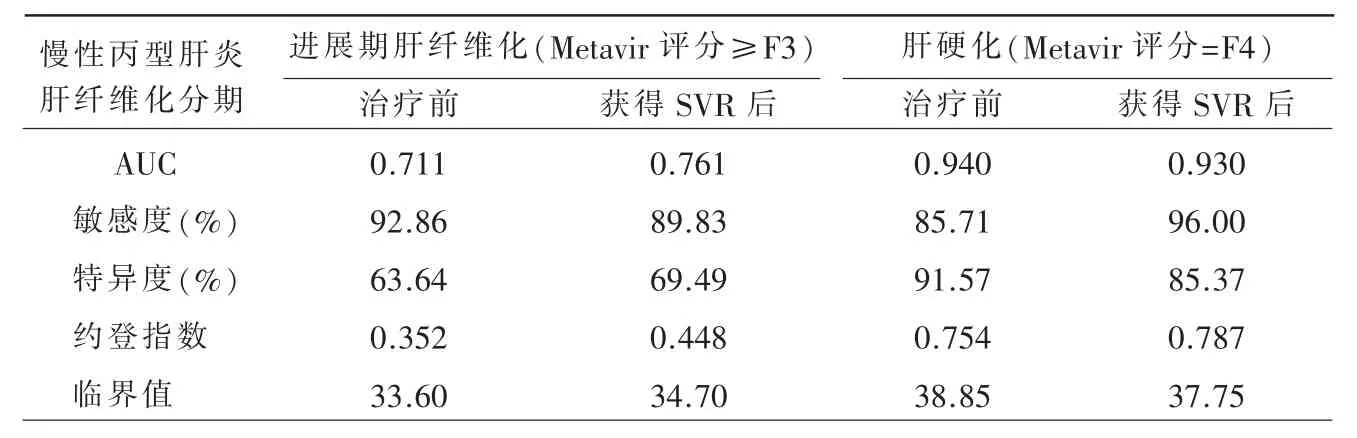
表3 HECV 值诊断治疗前及获得SVR 后进展期肝纤维化、肝硬化的效能
讨 论
CHC 患者通过治疗获得SVR 后,并不是一劳永逸的,这种无病毒状态下,理论上机体发生肝纤维化、肝硬化及肝细胞癌变的风险降低,但仍存在部分患者即使获得了SVR,也可发展为肝纤维化、肝衰竭、肝癌甚至死亡的可能。无病毒状态下肝组织的变化严重影响着患者的预后和长期生存质量[12]。因此,SVR 后肝病终点事件如何发展成了关注的焦点。目前,肝纤维化/肝硬化逆转的金标准是肝组织活检,但不适用于进行动态观察。临床上急需应用简便的无创性评估手段来动态观察肝纤维化/肝硬化的逆转情况。本研究基于CT 平衡期获取的HECV 来衡量CHC患者获得SVR 后肝纤维化程度是否发生逆转。
1.HECV 评估CHC 患者治疗前、治疗后的肝纤维化程度的价值
本研究结果显示CHC 患者治疗前HECV 与肝脏Metavir 评分呈显著正相关(r=0.719,P<0.05),与既往研究[6,20]结果相符。说明在CHC 患者治疗前,HECV 值会随着肝纤维化程度的进展而升高。在治疗获得SVR 后,HECV 与肝脏Metavir 评分仍呈显著正相关(r=0.750,P<0.05)。有研究[13]也表明CHC 患者经抗病毒治疗获得SVR后随着肝纤维化程度改善,HECV 值亦有一定程度的下降。增强CT 所用的碘化对比剂是一种大分子细胞外显像剂[14],在组织血流、毛细血管通透性、扩散速率及血管外容积等空间动力学因素作用下自由出入血管内和血管外细胞外,当达到平衡时,可以把相对固定的血管腔内间隙与血管外细胞外间隙视为整体即肝脏细胞外间隙,允许在不了解组织灌注或血管通透性的情况下量化细胞外基质体积[9,15]。换句话说,HECV 间接代表肝细胞外基质的多少,从而反映了肝纤维化程度。
本研究通过随访,在肝组织学病理印证的基础上,发现CHC 获得SVR 后HECV 仍能很好预测进展期肝纤维化/肝硬化,且治疗前和获得SVR后在诊断预测显著肝纤维化/肝硬化的AUC 差异无统计学意义。治疗前和获得SVR 后HECV 诊断进展期肝纤维化/肝硬化临界值、敏感度及特异度均未发生显著变化,笔者分析可能由于HECV 与肝细胞外基质沉积密切相关,而与炎症反映不密切有关。国内有研究[16]也表明肝细胞外基质与纤维化分级呈显著正相关,其与炎症活动度仅存在弱相关性,且与炎症活动度相比,纤维化分级是决定肝细胞外基质的独立影响因素。
2.CHC 患者治疗前后HECV 值变化的意义
本研究发现,当CHC 患者在获得SVR 后肝纤维化Metavir 评分逆转患者的HECV 值也下降,肝纤维化Metavir 评分进展患者的HECV 值要明显高于治疗前,肝纤维化Metavir 评分不变患者治疗前、后的HECV 值无明显变化。说明CHC 患者治疗前、后HECV 值变化情况与肝纤维化程度的变化一致。因此,笔者认为可以用HECV 值的变化情况来判断肝纤维化好转或进展。当CHC 患者获得SVR,解除肝细胞损害因素后,如果产生细胞外基质的活化细胞凋亡或自噬,减少了细胞外基质产生,增加了其降解酶的分泌,理论上HECV 会减小[13],那么代表肝纤维化实现了逆转。但当肝细胞外基质合成大于降解时,就会过度沉积于肝脏细胞外间隙,HECV 增加,代表肝纤维化程度进展。另外,本研究结果显示治疗前稳定组与进展组患者的HECV 值均高于逆转组,也就是说治疗前HECV 值越低肝纤维化越容易发生逆转,反映了肝纤维化逆转主要发生在肝纤维化的早期阶段,这与文献报道一致[17]。在肝脏结构尚可逆转时,及时治疗可阻止肝纤维化的进展。另外,CHC 在获得SVR 后实现肝组织学稳定和逆转者达84.03%(8.50%+75.53%),略低于文献报道[18]的88%(77/88),提示CHC 患者在获得SVR 后肝组织学能在很大程度上得到改善,也就是说当病毒水平受抑制,肝细胞受损因素解除,肝纤维化能得到很大的改善[19,20],这与文献[21]的观点 一致。
3.获取HECV 值的CT 扫描平衡期时间设定的可行性分析
由于既往很多关于HECV 的研究[5,9]中平衡期设定的时间为10 min 甚至更晚,所以对于本研究方案中平衡期时间设定为3 min,可能会存在一些争议。最近一项关于心肌ECV 的研究[22]中提到,在延迟时间3、5 及7 min 时,心肌ECV 之间没有明显差异。理论上,肝脏具有双重血供,碘化对比剂自由均衡分布到血浆及细胞外空间的时间要短于心脏。在早期关于碘对比剂药物动力学研究[23]中提出肝脏CT 平衡期可以提早到120 s 开始。虽然,目前还没有针对肝脏CT 多个不同平衡期时间肝脏ECV 是否具有差异的研究,但有研究[6,24]在肝脏CT 平衡期时间设定为3 min 或4 min 时获得的HECV 与肝纤维化之间也有良好的相关性。出于对提高工作效率和提高患者接受度的考虑,笔者认为3 min 作为肝脏平衡期的时间窗是可行的。
4.本研究的优势及局限性
本研究所用的增强CT 在评价CHC 获得SVR后肝纤维化/肝硬化有以下优势:首先,在检查患者是否发生肝癌及丙肝相关并发症(如腹腔积液、门静脉高压等)的同时,还可以进一步对肝纤维化进行半定量分析,无需额外增加患者的辐射剂量及经济负担。其次,相对于MRI 及超声等检查,虽然CT 与电离辐射剂量有关,但其潜在优势包括:可用于有超声及MRI 禁忌证的患者(肥胖、腹腔积液及幽闭恐惧症),以及亚毫米分辨率的潜力。本研究的局限性:单中心研究且病例数较少;缺少分析炎症因素改善对其影响的程度;没有针对获取HECV 值的最佳平衡期扫描时间进一步优化比较,将在后续研究中进一步完善,结果可能会随着优化而改善。
基于增强CT 获取的HECV 值作为一种无创性肝纤维化评估手段,与慢性丙型肝炎患者SVR后肝纤维化的变化关系密切,有望在评价慢性丙型肝炎患者获得持续病毒学应答后是否发生肝纤维化逆转中发挥重要作用。