日本罕见病用医疗器械上市激励政策研究及启示*
韩朦, 赵艳蛟, 陈永法
(中国药科大学国际医药商学院,江苏 南京 211198)
罕见病又称“孤儿病”,我国罕见病患者群体大约为2 000万人。虽然药品对于罕见病的治疗可以起到关键性的作用,但不可否认的是,医疗器械在罕见病的辅助检查和诊断上也扮演了极其重要的角色。近年来,在国家陆续出台的“罕见病”相关政策中,对医疗器械领域的关注在逐步增加。2016年,原国家食药总局出台了《医疗器械优先审批程序》,赋予了诊断或治疗罕见病医疗器械优先审评的权利。2017年10月,国务院印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出要支持罕见病治疗药品和医疗器械研发[1]。2018年,《用于罕见病防治医疗器械注册审查指导原则》出台,对罕见病防治用医疗器械产品的注册申报、临床实验和审评审批进行规范。2022年“两会”期间,有专家提出要关注“罕用医疗器械”。从已有政策来看,我国较为关注罕见病用医疗器械的优先审评审批和临床试验数据豁免上,尚未出台系统的激励措施来支持罕见病用医疗器械的发展[2]。从现有研究来看,众多学者已经对罕见病药物进行了详尽分析。陈敏[3]、袁妮[4]、孙思萌[5]等从国内外经验对比、药品全生命周期及产业政策等多角度分析了国内外罕见病用药品的政策现状及不足;朱晓红[6]、王雪[7]分别梳理了罕见病药品资格认定和上市激励的国际经验。对于罕见病用医疗器械而言,杨殿政[8]总结了美国、日本和欧盟罕见病用药械的法律界定标准;胡凯[9]在介绍美国医疗器械注册审批程序时,提到了罕见病器械适用的人道主义器械豁免政策。通过梳理已有文献可以发现,罕见病用医疗器械领域尚有大量研究空白亟需填补。因此,如何有效推动罕见病用医疗器械的发展,激发企业研发上市活力,进一步满足罕见病群体的医疗需求,值得我国学者深入思考。
放眼全球,日本对罕见病用医疗器械关注较早,已形成了一系列完整紧密的上市激励政策体系,且激发罕见病用医疗器械研发上市成效显著,其经验值得深入研究。本文通过分析日本罕见病用医疗器械的上市激励政策,梳理我国罕见病用医疗器械发展现状,通过对比两国政策要点,提出完善我国罕见病用医疗器械上市激励相关建议,为后续研究者提供参考。
1 日本罕见病用医疗器械认定制度概述
1.1 罕见病用医疗器械的概念界定
日本于1993年建立公共支援制度,专门用于“孤儿药”或“孤儿医疗器械”的项目实验研究。2013年,“药事法的部分修订案”(2013年第84号法)在《药品和医疗器械法》的基础上对“罕见病”进行了定义,即国内患病人数不超过5万人的疾病。2014年,日本政府颁布了《关于确保医药品、医疗器械等产品的品质、效果以及安全性的相关法律》,将医疗器械定义为“用于诊断、治疗、预防人或动物的疾病,或对人或动物身体功能产生影响的设备和仪器”。2019年6月日本厚生劳动省发布《药品、医疗器械、再生和细胞治疗产品的质量、有效性和安全保障法》,其中第77-2条规定,将患者人数少于50 000人且有很高的医疗需求的器械认定为“孤儿医疗器械”,即罕见病用医疗器械。由于罕见病领域的特殊性,罕见病用医疗器械多为III类和IV类医疗器械。
1.2 罕见病用医疗器械的认定程序
1.2.1 提交申请资料
根据日本《药事法执行部长条例》第250条规定,申请人需向厚生劳动省提交完整的罕见病用医疗器械认定申请表,内容包括申请人信息、产品详细描述及其科学依据、实用价值等。如表1所示,除填写表格外,还需要以附件形式提交使用该产品的患者人数、医疗需求和开发可能性等客观统计数据作为支撑材料。日本允许申请人在提交资料时使用海外临床试验数据,明确海外临床试验中罕见病人群的定义、纳入临床试验的受试者的体型,以及各国临床指南、政策的差异即可。值得注意的是,不同于我国,日本对于在国际学术期刊发表过的产品相关论文,其论文数据也可以作为审批环节的参考依据。

表1 罕见病用医疗器械的认定申请资料要求
1.2.2 审评审批程序
如图1所示,在罕见病用医疗器械认定程序中,主要涉及日本厚生劳动省(MHLW)、国家生物医学创新研究所(NIBIO)、药品和医疗器械局(PMDA)三个职能部门。日本厚生劳动省负责罕见病用医疗器械的认定前咨询、资格认定、审评审批和支付NIBIO的运营成本;PMDA为申请人提供罕见病用医疗器械上市许可临床试验和资料的咨询;NIBIO的主要任务是向申请人支付补贴,对申请人的研究费用进行审核,以及向申请人提供指导和咨询。认定程序包括咨询、形式审查、资料审评与授权认定4个阶段。在咨询环节,申请人应向厚生劳动省药品食品安全部提交咨询申请,咨询时长在30分钟,咨询人数不限。

图1 日本罕见病用医疗器械资格认定流程图
在审评审批过程中,申请人可以在提交罕见病用医疗器械上市申请前的任何时间点向厚生劳动省提交资格认定的申请资料。收到申请后,厚生劳动大臣将根据药事与食品卫生委员会(PAFSC)的讨论确定认定资格,将同时满足以下条件的医疗器械认定为罕见病用医疗器械:(1)申请时可能使用该器械的患者人数少于50 000人;(2)该器械没有合适的替代器械治疗,或者与现有产品相比,有望获得更高的疗效或安全性;(3)对目标疾病使用该器械应有理论依据,研发计划应适当[10]。其中第(3)点是日本区别于其他国家罕见病用产品认定制度的亮点。由此可知,日本对罕见病用医疗器械的资格认定主要聚焦于产品针对的患者人数、医疗上的需求和产品开发的可能性。
1.3 罕见病用医疗器械资格认定的撤销程序
随着疾病的发展,可能会出现患病人数的动态变化,导致产品不再满足资格认定的条件。因此,申请人必须以书面形式,在预期中止前至少1年通知厚生劳动大臣其打算中止产品的研究、生产或销售。厚生劳动省药品食品安全局评价许可科收到废止通知后,须向PAFSC报告,同时在数据库中予以产品状态更新。
在一些情况下,厚生劳动省也可针对申请资料不实、提供虚假陈述、无正当理由不研发或销售医疗器械、违反其他法律或条例等情况,撤销已经授权的资格认定。资格认定的撤销,不会影响该产品已获得的上市许可,但NIBIO会暂停或撤销补贴。
2 日本罕见病用医疗器械上市激励政策及实施效果
2.1 激励政策
为了鼓励罕见病用医疗器械研发,减轻企业的研发和生产负担,日本不仅建立了一套从申请、资格认定到撤销罕见病用医疗器械上市的完整程序,也形成了有效的补贴激励机制。2013年,日本《药事法》第84号法和《药品医疗器械法》第77-2条,规定创立了罕见病用药品和医疗器械研发支援政策。企业通过申报可以直接获得资金补贴、税收减免等多方面的激励来推动罕见病用医疗器械的研究和开发活动。
2.1.1 资金激励
(1)补贴支付。在日本,这种补贴支付方式被称为“助成金制度”,即罕见病用医疗器械申请方每年有两次机会,可以通过NIBIO获得补贴,包括差旅费、设备费、耗材费、印刷装订费、通讯运输费、租金损失费、会议费、杂项服务费、寄售费等。NIBIO收到申请后,对研究的内容、目的、费用、试验计划等进行调查,然后发放补助金,以支付研究所需的费用。资助期限从申请认定到获得上市许可批准的那一年年底,最长为三年,补助金额高达测试和研究费用的50%,以减轻企业研发罕见病用医疗器械产品的经济负担。
(2)税收优惠。罕见病用医疗器械的研发费用总额,在NIBIO资助期间进行的研发活动,其产生的相关测试和研究费用总额的20%(不包括上述NIBIO给予的补贴支付部分)可作为税收抵免申报。
2.1.2 监管激励
(1)指导和咨询。对于研发活动中可能存在的问题,罕见病用医疗器械申请人可以通过主要监管部门提供的相关指导和咨询中获得解决方案。如图2所示,从2016年6月16日开始,PMDA利用视频会议系统,对罕见病用医疗器械产品申报提供了一个优先面对面和RS战略咨询服务,对2020年3月31日之前开展的咨询服务进行费用减免。同时,厚生劳动省药品医疗器械厅也对罕见病用医疗器械的研究和开发提供指导建议。结合日本学者对109家医疗器械企业的调查结果来看,88.9%的企业认为PMDA的指导和建议对产品研发有很帮助,从侧面体现了政府有关部门的指导和咨询对企业研发的激励作用[11]。
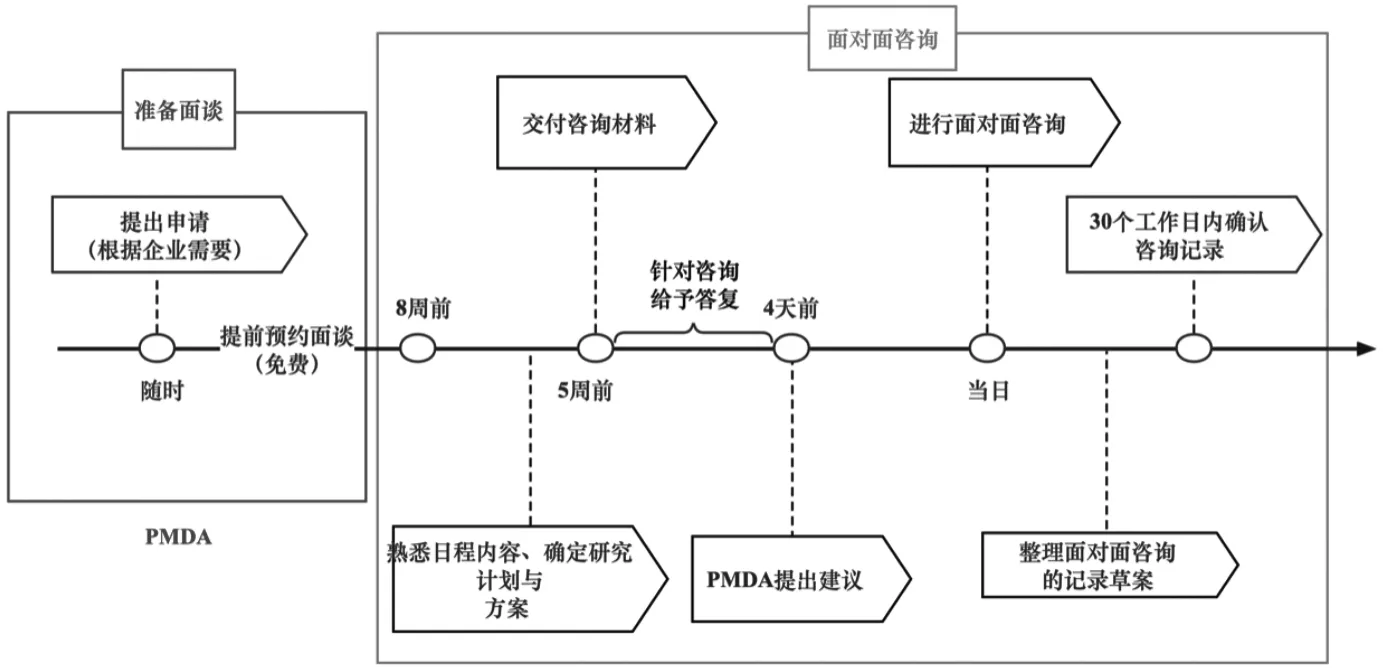
图2 优先面对面咨询流程
(2)优先审查。由于不具备按照普通器械审评标准提供各类数据的条件,为了实现罕见病用医疗器械的尽快上市,日本实行优先审查制度,其内容主要包括审查顺序的提前和药品综合审评期的缩短。一方面,在审查顺序上,指定的罕见病用医疗器械将接受上市许可的优先审查,以确保它们尽早提供给临床环境。根据厚生劳动省的数据显示,罕见病用医疗器械的审评为10个月,其他类型的医疗器械平均审查时间为14个月[12]。另一方面,产品的上市许可审批费用可以获得减免。通过这两方面的政策激励,企业的研发成本进一步下降,对罕见病用医疗器械的申报积极性大大提高。
2.1.3 市场独占激励
相较于一般医疗器械而言,对于符合制度认定标准的罕见病用医疗器械,日本采取延长专利期的方式激励其上市。罕见病用医疗器械的专利独占期普遍可延长至7年;已认定批准的再生医学产品(包含罕见病再生医学产品),专利独占期最长可延长至10年。由此可知,我国虽然出台了罕见病用医疗器械的专项条例,但与日本相比还未对罕见病用医疗器械设立补贴、税收等激励政策[13]。
2.2 激励政策实施效果
经过近30年的发展,日本罕见病用医疗器械激励政策落实到位,成效显著。如表2所示,截止到2022年6月,日本NIBIO共批准资助了32个罕见病用医疗器械项目,其中批准资助22件,撤销6件,2个被认定为罕见病再生医学产品。从产品类型上看,44%的被资助产品为植入性医疗器械,其次为接触式人工器官;从产品适用的疾病领域来看,其中56%的产品用于治疗罕见恶性肿瘤和心脏疾病[14]。根据《疑难病患者医疗法》第五条第一项规定,日本疑难病清单(即罕见病目录)共经历了5次修订,目前共收录了15类338种疾病,其中原发性轻链型淀粉样变、克罗恩病、多发性硬化、特发性心肌病、特发性肺纤维化等15种罕见病对应的医疗器械产品已被NIBIO批准资助[15]。
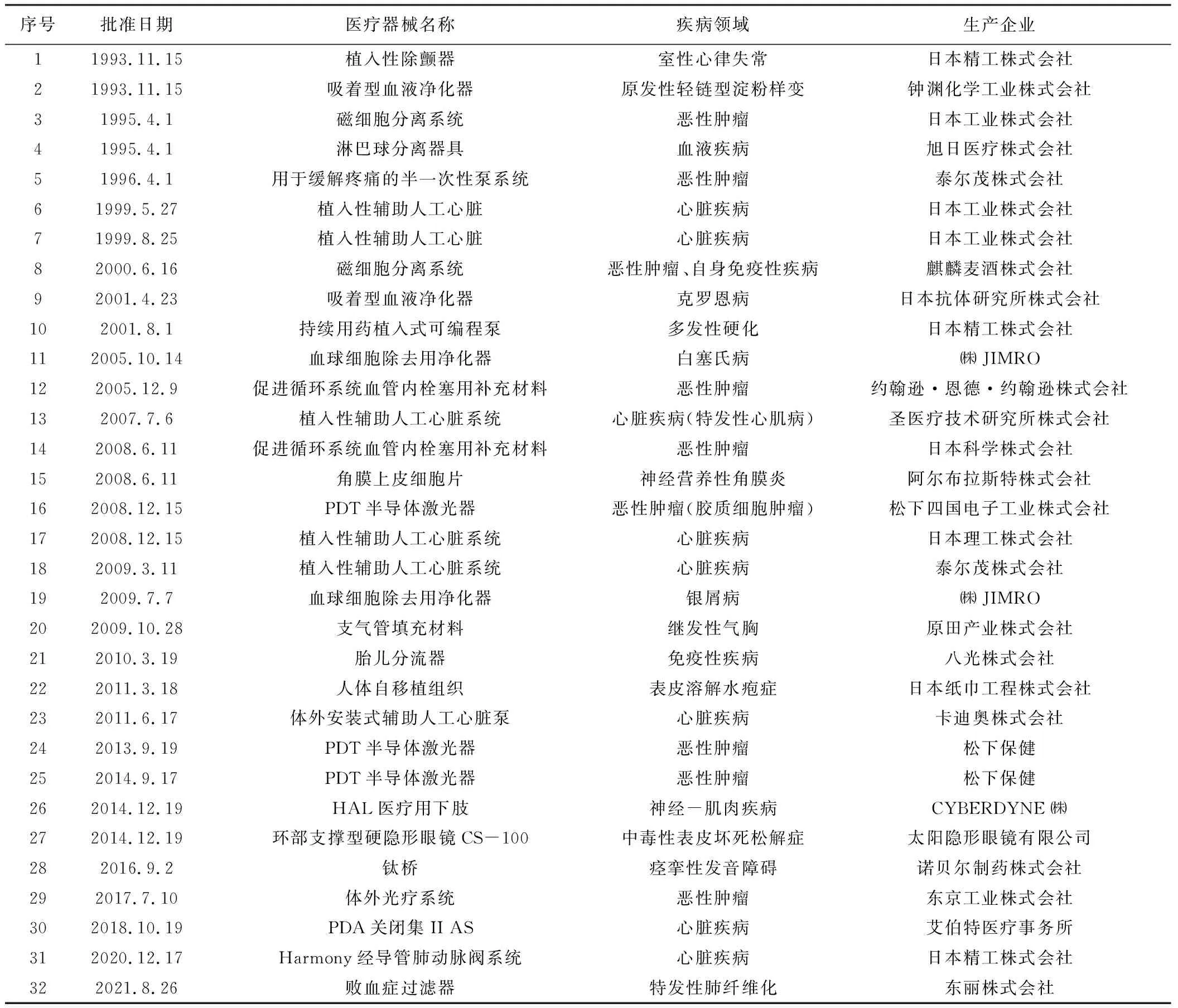
表2 日本NIBIO批准的罕见病用医疗器械清单
3 我国罕见病用医疗器械的发展现状与不足
3.1 发展现状
目前,我国用于防治罕见病的医疗器械数量较少。市场上虽然有可用于检查罕见病的仪器,如CT、MRI和内窥镜等,但这类设备的精确度要求较高,国产还需进一步完善,目前仍以进口为主。据国家药监局数据显示,截至2022年1月,只有2件用于检测罕见病的产品通过了优先审评审批,约占总数的1.14%(详见表3)。2017、2018年都没有优先审批通过罕见病相关器械产品[16]。全国34个省市中,没有医疗器械优先审批产品的占67.6%,有优先审批产品但不包含罕见病产品的占26.5%,剩下的5.9%有罕见病优先审批产品。近年来只有湖北、江苏两省有罕见病优先审批产品,且这两省的产品申请的是国家医疗器械优先审批通道。此外,海南省的“罕见病特许药械病友服务站”虽然会引进国际先进器械,定期开展罕见病医疗创新药械交流研讨会,但由于创立时间较晚,尚不能满足国内罕见病患者群体对治疗器械的需求。
3.2 存在的问题
深入研究日本支持罕见病用医疗器械发展的政策及实施效果后,笔者发现我国现存制度存在以下问题。
3.2.1 未形成罕见病用医疗器械的相关政策体系
纵观日本罕见病用医疗器械的发展,不难发现法律在其中扮演了重要的推动作用。罕见病的定义、罕见病用医疗器械的认定标准以及激励措施均有明确的的法律法规。我国罕见病用医疗器械的鼓励政策发布时间较晚,对罕见病用医疗器械的定义尚不明确,也未启动罕见病用医疗器械认定标准的制定工作,更未出台专项法律法规。在政策体系方面,现有政策呈碎片化分布,政策内容较为宽泛,制度建设缺乏系统性。
3.2.2 罕见病用医疗器械的激励机制不够完善
日本对罕见病用医疗器械的激励包含了上市快速通道、市场独占期和提供咨询等具体措施,这极大推动了罕见病用医疗器械的研发上市进程。相比之下,我国的罕见病用医疗器械激励措施还不够全面,目前并未对产品上市的审核周期、研发专利的保护等内容进行明确规定。对于现有政策而言,尽管我国已从政策层面上明确了罕见病用医疗器械申报的“绿色通道”机制,但对优先审评审批、海外临床数据的使用等内容的阐述上过于笼统,缺少具体的量化指标,可操作性不强。
3.2.3 缺少对罕见病用医疗器械上市的资金支持
日本罕见病用医疗器械的发展,与其在资金补贴上的投入密不可分,但目前我国在税收抵免、研发补贴等资金鼓励方面则较为欠缺,这极大阻碍了国内企业的研发热情。从政府的角度来看,解决企业研发资金短缺的问题,加大减税降费优惠政策支持,为企业的研发活动提供坚实的保障,是推动罕见病用医疗器械行业发展的最大内生动力。从企业角度来看,合理使用政府的研发补助资金,加大自身研发投入,加速产品上市,才能有效推动罕见病用医疗器械行业的发展。因此,政府的资金支持是激励罕见病用医疗器械上市的重要举措。
4 对我国罕见病用医疗器械发展的启示及建议
4.1 逐步建立罕见病用医疗器械认定体系
为了鼓励罕见病用医疗器械的研发,一方面,应对已出台的罕见病用医疗器械审评审批政策内容进行细化,优化罕见病用医疗器械审评审批的“绿色通道”,更好的保障认定程序政策的落地实施。另一方面,建议通过制定专项法律明确各方责任,在罕见病界定标准的基础上,为罕见病用医疗器械的发展提供制度保障。明确罕见病定义,据此引入罕见病用医疗器械的认定标准、流程和医疗器械上市激励制度等,形成罕见病用医疗器械认定体系,实现罕见病用医疗器械激励工作的有法可依。
4.2 完善罕见病用医疗器械上市激励细则
第一,在临床研究中,企业需根据目标疾病的详细数据,推断现有数据的可行性、风险关联性以及其他信息。在使用海外数据时,鼓励企业使用与申报产品相关的其他海外数据作为审批依据,明确海外临床试验中罕见病人群的定义、纳入临床试验的受试者的体型,以及各国临床指南、政策的差异。对于在国际学术期刊发表过相关论文,能够证明申报产品科学性的论文数据,也可以作为审批过程的重要证据。此举可以有效降低企业的生产成本,增强其创新积极性。第二,为已通过审批上市的罕见病用医疗器械设立市场独占期,形成充分的市场竞争保护。第三,建立针对罕见病用医疗器械注册申报关键环节的辅导沟通机制,开设医疗器械检查管理课程,定期向研发企业提供咨询服务。
4.3 以财政激励为抓手鼓励企业研发上市
对于处在起步阶段的我国而言,需要逐步探索罕见病用医疗器械研发补贴政策。首先,以罕见病用医疗器械研发企业为对象进行问卷调查,及时了解罕见病用医疗器械研发企业未被满足的需求,对需要帮助的中小型企业提供额外的激励措施,如,授权企业某些研发成本的税收抵免、为罕见病用医疗器械生产商提供研究补贴、对创新性医疗器械的专利设计颁发鼓励奖金等。其次,虽然目前已建立的海南罕见病特许药械病友服务站向全国罕见病患者开放,但是受限于距离和经济条件,还是有很多患者不能受益,因此建议成立“华东地区版”罕见病特许药械服务站,进一步提升罕见病用医疗器械的可及性,真正惠及广大患者。最后,鼓励第三方为罕见病用医疗器械的研发提供财政援助,解决研发者的后顾之忧,为创新产品的发展助力。
——一个鲜为人知的厚生会计学校

