莴笋链格孢叶斑病病原鉴定及室内生防菌剂筛选
朱启寒,何剑鹏,张晓阳,2,李庚花,刘 冰,熊桂红,蒋军喜*
(1.江西农业大学 农学院,江西 南昌 330045;2.江西省九江市农业技术推广中心,江西 九江 332000)
【研究意义】莴笋(Lactuca sativavar.angustataIrish),即茎用莴苣,为菊科一或二年生草本植物,其茎叶均可食用,既可补充维生素、蛋白质,也可预防疾病、润肠通便[1]。莴笋栽培较易,经济效益好,但在种植过程中易发生病害[2-3]。2022 年4 月,在江西省南昌市郊蔬菜种植地发现一种少见的叶斑病,经镜检初步确定其病原为链格孢属(AlternariaNees)真菌,但种类未明确。本研究主要开展此病菌种类鉴定及室内生防菌剂筛选,对该病害的后续研究和绿色防控具有重要的理论和实际意义。【前人研究进展】国外尚未见莴笋链格孢叶斑病病原菌鉴定的报道,但发现近10 种链格孢属真菌能引起莴笋的近缘变种生菜即叶用莴苣的叶斑病[4-9];我国则报道了芸薹链格孢A.brassicae和茄链格孢A.solani可引起河北省和内蒙古自治区的莴笋叶斑病[10],同时,发现交链格孢A.alternata可引起广昌县白莲叶斑病[11]。目前,国内外尚未开展莴苣链格孢叶斑病的生物防治研究。【本研究切入点】本研究拟从田间采集莴笋链格孢叶斑病样品,对其进行病菌分离,对分离获得的菌株进行形态学和分子生物学鉴定,并做致病性测定,同时,从市场上挑选主要用于作物真菌病害的生防制剂进行室内生防菌剂筛选。【拟解决的关键问题】本研究旨在明确南昌市郊莴笋链格孢叶斑病病原菌种类,并筛选到对该病菌具有显著抑制作用的生防菌剂。
1 材料与方法
1.1 样品采集
2022 年4 月在江西省南昌市郊3 个蔬菜种植地随机采集25 份莴笋链格孢叶斑病病叶,迅速带回实验室进行病菌分离。
1.2 病菌分离纯化
采用常规组织分离法进行病菌分离。选择典型病斑,在病健交界处剪取边长约3 mm 的小块组织,在超净工作台上先用体积分数75%酒精消毒10 s,再在1 g/L 升汞溶液中消毒15 s,随后用无菌水漂洗3 次,每次2 min,最后将小块组织在灭菌滤纸上吸干残留水分后移入PDA 平板上[12],然后置于26 ℃恒温箱中培养,待菌落长出后,挑取菌落边缘菌丝体进行纯化,获得纯培养菌株。
1.3 病菌致病性测定
取新鲜莴笋健康叶片,先用体积分数75%的酒精作表面消毒,再用无菌针头在以主脉为分界的两半叶片各轻刺两个伤口。将培养10 d的菌落用无菌水洗下孢子,经纱布过滤得到孢子悬浮液,再用无菌水将孢子悬浮液稀释至106CFU/mL。对左半叶两伤口,各接种10 µL 孢子悬浮液,对右半叶两伤口则各接种等量无菌水作对照。将接种及对照叶片置于26 ℃恒温培养箱中培养,逐日观察结果,试验设置3 次重复[13-14]。
1.4 病菌培养性状及形态观察
将供试菌株接种于PDA 平板中央,26 ℃培养,逐日观察菌落形态及产孢情况,用十字交叉法测量菌落直径,计算菌落生长速度。利用李朋华[15]的方法观察分生孢子链,即将滤纸剪成同载玻片大小形状,并在中间剪出1 cm×2 cm的小孔,灭菌后,在超净工作台中,加入适量无菌水,使滤纸紧贴载玻片,挑取菌丝放在滤纸孔旁,26 ℃培养24 小时观察分生孢子链形态。取菌落上分生孢子梗及分生孢子制片镜检,观察其形态特征并测量大小[16]。根据观察结果,参照文献[17-18],初步确定病原菌种类。
1.5 病菌分子生物学鉴定
1.5.1 菌株基因组DNA 提取 取适量菌丝于2 mL 圆底离心管中,加入灭菌的钢珠,用液氮研磨打样成粉状。采用Ezup柱式真菌基因组DNA 提取试剂盒提取菌株基因组DNA,用10 g/L 琼脂糖凝胶电泳检测DNA提取质量。
1.5.2rDNA-ITS和Alt a1基因扩增及序列测定 采用引物对ITS1(5′-TCCGTAGGTGA ACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[19]和Alt-F(5′-ATGCAGTTC ACCACCATCGC-3′)/Alt-R(5′-ACGAGGGTGAYGTAGGCGTC-3′)[20]分别对rDNA-ITS和Alt a1基因进行PCR 扩增。PCR 扩增反应总体系25 µL,包含ddH2O 8.5 µL、2×TaqPCR Master Mix 12.5 µL、正反向引物各1 µL(10 µmol/L)和模板DNA 2 µL。PCR 反应程序为:94 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1min,共35 个循环;72 ℃延伸10 min。PCR产物经10 g/L琼脂糖凝胶电泳检测后,将目的片段送至生工生物工程(上海)有限公司进行序列测定。
1.5.3 序列比对及系统发育树构建 获得的原始序列用DNA Star分析软件进行拼接,用BLAST比对后,将获得的准确序列递交至GenBank 获得登录号。根据序列同源性大小,在GenBank 数据库中下载相关序列(表1),利用MEGA 7.0软件中的邻位加入法(neighbor-joining,NJ)构建系统发育树[21]。

表1 用于构建链格孢属系统发育树的基因序列信息Tab.1 Gene sequence information for the construction of phylogenetic tree of Alternaria spp.
1.6 室内生防菌剂筛选
将市售的8 种生防菌剂(表2)按照各自的芽孢含量稀释成1×108CFU/mL 菌悬液备用。采用平板对峙法[22]测定其对莴笋叶斑病菌的抑菌作用。在PDA 平板正中央接种直径为5 mm 的病原菌菌饼,以病原菌菌饼位置为中心,在正四方各2.5 cm 处用长牙签蘸取适量生防菌菌悬液,对照组点滴适量无菌水,均以菌液无流动为适量,各处理均3 次重复。26 ℃培养箱中培养7 d 后用十字交叉法测量菌落直径,计算菌落平均直径以及各生防菌对病原菌的抑菌率,抑菌率公式[23]为:

表2 8种生防菌剂基本信息Tab.2 Basic information of 8 tested biological agents
1.7 数据分析
采用Excel 2010 和SPASS 20.0 软件进行数据统计与处理,使用Duncan’s 法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 病害田间症状与病原菌分离
2022年4月,在江西省南昌市郊种植的莴笋上发现一种新的叶斑病,病斑大多发生于植株中下部叶片,叶片病斑初期为褐色小点,后逐渐扩大成圆形或不规则形,有的受叶脉限制呈多角形,病健交界明显,天气潮湿时,病斑表面产生灰色霉层。重病叶片病斑累累,卷缩干枯脱落。对病叶(图1-A)进行组织分离纯化,共获得23株培养性状一致的链格孢属菌株,分离率100%。
2.2 致病性测定
用分离到的代表性菌株WS1进行孢子悬浮液接种,接种1 d后开始发病,病斑近圆形,灰褐色(图1-B),4 d后病斑扩大,周围褪绿变黄(图1-C),5 d后病斑继续扩大并裂开(图1-D),其症状与自然发病症状相同,对照组均不发病。对接种产生的病斑进行病菌再分离,获得的菌株与WS1的形态特征以及分子生物学测定结果一致。

图1 莴笋链格孢叶斑病症状以及病菌形态Fig.1 Symptoms of lettuce Alternaria leaf spot and the morphology of its pathogenic fungus
2.3 病菌培养性状及形态特征
供试菌株在PDA平板上26 ℃培养5 d,菌落圆形,菌丝体绒毛状,菌落正面中央灰褐色,边缘白色,菌落背面中央黄褐色,边缘白色;后期菌落正面中央颜色加深成暗青褐色,背面呈黑褐色(图1-E,图1-F);菌落平均生长速度为10.86 mm/d。分生孢子梗单生或丛生,直立或膝状弯曲,0~12个隔膜,少分支,淡褐色至褐色,大小(15.76~83.02)µm×(2.90~4.74)µm(图1-G);分生孢子以短链方式着生在分生孢子梗上,主链一般不超过10个孢子,分生孢子侧面或基部可萌生次生分生孢子梗形成支链而产孢,支链不超过5个孢子(图1-H)。分生孢子倒棍棒形或椭圆形,淡褐色至褐色,表面光滑或带微刺,具0~6 个横隔、0~3 个纵隔和0~2个斜隔,分隔处稍缢缩或不缢缩,孢身大小为(14.60~40.09)µm×(6.61~14.44)µm(图1-I);短喙柱状或锥形,淡褐色,大小(1.84~8.29)µm×(2.60~4.35)µm。根据菌株的菌落特征和病菌形态大小,将该菌株初步确定为交链格孢A.alternata。
2.4 分子生物学鉴定
用真菌DNA 通用引物对ITS1/ITS4和Alt-R/Alt-F 分别对rDNA-ITS和过敏原基因Alt a1进行PCR 扩增和测序,结果获得的DNA 片段长度分别为570 bp 和472 bp,其在GenBank 中的序列登录号分别为OP161641和OP185144。通过BLAST比对,发现此两序列与GenBank中交链格孢A.alternata对应序列均具有100%的同源性。在以rDNA-ITS和Alt a1基因串联序列构建的系统发育树中,菌株WS1 与A.alternata的菌株聚于同一分支,而其他种类的链格孢构成各自独立的分支(图2)。根据序列同源性大小和菌株亲缘发生关系,将菌株WS1鉴定为交链格孢A.alternata。

图2 基于rDNA-ITS和Alt a1基因序列构建的链格孢属的系统发育树Fig.2 Phylogenetic tree of Alternaria spp.based on the sequences of rDNA-ITS and Alt a1 genes
2.5 室内生防菌剂筛选
8种供试生防菌剂对交链格孢A.alternata均有较好的抑制效果(表3和图3),其中,地衣芽孢杆菌抑菌效果最好,抑菌率达75.42%,巨大芽孢杆菌抑菌效果最差,抑菌率为63.55%。
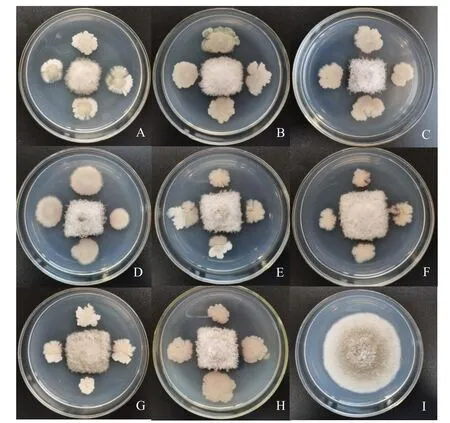
图3 8种生防菌剂与交链格孢菌的对峙培养Fig.3 Confrontation culture of 8 biocontrol agents and A.alternata

表3 8种生防菌剂对交链格孢菌的抑菌效果Tab.3 Inhibitory effects of 8 biocontrol agents on A.alternata
3 结论与讨论
本研究对江西省南昌市郊莴笋链格孢叶斑病进行病原菌分离,共获得23 株培养性状一致的链格孢属菌株,在通过接种明确其具有致病性的基础上,选择代表性菌株进行培养性状和形态特征观测,观测结果与文献中对交链格孢的描述一致,随后对代表性菌株的rDNA-ITS和Alt a1基因进行PCR扩增、测序和序列分析,结果所得序列与GenBank 中交链格孢对应序列具有100%的同源性,并在系统发育树上处于同一个分支且支持率为99%。综合上述结果,将发生于江西南昌市郊的莴笋链格孢叶斑病的病原鉴定为交链格孢。采用对峙培养法,测定8 种生防菌剂对交链格孢的抑制作用,结果8 种生防菌剂对交链格孢均具有较好的抑制作用,其中,地衣芽孢杆菌和荧光假单胞菌的抑菌效果突出,抑菌率分别达75.42%、72.74%,巨大芽孢杆菌抑菌效果相对较弱,抑菌率为63.55%。对该病害病原的明确和筛选出高效生防菌剂为该病害的后续研究和生物防治奠定了工作基础。
本研究报道的由交链格孢A.alternata引起的莴笋叶斑病与前人报道的由芸薹链格孢A.brassicae和茄链格孢A.solani引起的莴笋叶斑病除病原种类不同外,其症状表现也不同,前者的症状为病斑圆形或不规则形,褐色,无轮纹,后者的病斑虽然也为圆形或不规则形,但病斑为黑褐色,有轮纹。因此,在诊断这两种病害时,除依靠病菌形态差异外,还可以根据病害症状作出初步判断。同时,在田间诊断该病害时,还应注意与莴笋上另外两种半知菌叶斑病相区别。一种是由极长尾孢Cercospora longissima引起的莴笋叶斑病,其病斑边缘褐色,中心有灰白色小斑,病斑内外有颜色差异,另一种为微疣匐柄霉Stemphylium chisha为害引起的叶斑病,其病斑黄褐色并有明显的同心轮纹[24-25]。链格孢由于其孢子形态鲜明,很容易鉴定到属,但有些链格孢种间形态变异性大,难以确定到种。因此,在形态学鉴定的基础上,一些研究者还采用两个及两个以上基因联合构建系统发育树来进一步鉴定链格孢种类[26]。本研究基于rDNA-ITS和Alt a1基因的序列分析和系统发育树构建,则明确将莴笋链格孢叶斑病菌鉴定为交链格孢,且与形态鉴定结果相一致。在生防菌剂筛选试验中,虽然获得地衣芽孢杆菌、荧光假单胞菌等高效生防菌剂,但这仅说明其在室内单纯对病菌具有显著的抑菌效果,并不表示其在田间对莴笋叶斑病具有等同的防效[27]。后续笔者将对这些生防菌剂进行大田防效试验研究,为莴笋叶斑病的绿色防控提供更为可靠的依据。

