不同地点朝鲜淫羊藿根际土壤真菌群落多样性及其与活性成分的相关性
郭俊杰, 刘悍宁, 吴 媛, 庄 鑫, 陈佳雯, 胡 星, 刘玉翠, 肖井雷
(1.长春中医药大学,吉林长春 130117; 2.长春中医药大学附属医院,吉林长春 130021)
根际土壤真菌是土壤根际微生物的重要组成部分,其群落组成具有广泛性和多样性,在土壤中有机质的分解和养分的循环中发挥着关键的作用[1],与植物的生长和代谢密切相关[2-3]。同时随着植物的生长,根际代谢活动逐渐变化,尤其是分泌一些有机物质,对其根际土壤真菌的组成和分布也会产生相应的影响[4-5]。现有研究表明植物的种类[6]、产地[7]和生长阶段[8]的不同是影响根际土壤真菌结构的主要因素。
朝鲜淫羊藿(EpimediumkoreanumNakai)是小檗科淫羊藿属的多年生草本植物,其叶入药,主要用于抗衰老、降低血压、抑制肿瘤、增强免疫功能[5],淫羊藿中的功效成分主要为总黄酮及总黄酮醇苷,其中含总黄酮的含量以淫羊藿苷计,含总黄酮醇苷的含量以朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的总量计[6]。本研究首先采用第2代高通量测序技术对不同采集地、不同采集时期的朝鲜淫羊藿根际土壤真菌多样性进行分析,并采用HPLC法测定对应朝鲜淫羊藿活性成分的含量,进行相关性分析,以期为朝鲜淫羊藿仿野生种植土壤微生态的构建、有益微生物筛选提供科学依据。
1 仪器与材料
1.1 仪器
Pico-21台式离心机、Q32866 Qubit® 3.0荧光计(赛默飞世尔科技公司);Gl-88B漩涡混合器(海门市其林贝尔仪器制造有限公司);TND03-H-H混匀型干式恒温器(深圳拓能达科技有限公司);DYY-6C电泳仪电源、DYCZ-21电泳槽(北京市六一仪器厂);ETC811 PCR仪(北京东胜创新生物科技有限公司);Research plus 0.5-10 μL移液器(艾本德公司)。
1.2 材料
M5635-02磁珠土壤DNA小量提取试剂盒(美国OMEGA公司);Q10212 Qubit3.0 DNA检测试剂盒(Life Technologies Corporation);2×Hieff®凝胶电泳 PCR预混液、Hieff NGSTMDNA 分选磁珠[翌圣生物科技(上海)股份有限公司]。
采用抖落取样法在吉林省临江市区域采集朝鲜淫羊藿根际土壤,每个采集地选取3~5个采样点,采集信息见表1。

表1 样品信息
2 试验方法
2.1 高通量测序分析
2.1.1 DNA提取 根际土壤总DNA提取参照M5635-02磁珠土壤DNA小量提取试剂盒说明书进行,采用2%琼脂糖凝胶电泳检测DNA完整性,并利用Qubit 3.0 DNA检测试剂盒检测纯度和浓度。
2.1.2 PCR扩增 以根际土壤总DNA为模板,共进行2轮PCR扩增,第1轮:PCR反应体系30 μL:正反引物各1 μL、2×Hieff® 凝胶电泳 PCR预混液 15 μL、DNA模板 10~20 ng,补ddH2O至30 μL,ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。PCR反应条件为94 ℃ 3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,5个循环;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,20个循环;72 ℃ 5 min,10 ℃停止。第2轮:PCR反应体系30 μL:正反引物各1 μL、2×Hieff® Robust PCR Master Mix 15 μL、Template DNA 20~30 ng,补ddH2O至30 μL,ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。PCR反应条件:95 ℃ 3 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,5个循环;72 ℃ 5 min,10 ℃停止。扩增产物用2%琼脂糖凝胶电泳检测其片段大小,用DNA纯化磁珠对DNA进行纯化,纯化产物用Qubit 3.0荧光定量仪进行浓度测定,之后进行Miseq测序。测序部分由生工生物工程(上海)股份有限公司完成。
2.1.3 数据处理与分析 使用Usearch 11.0.667 软件对有效序列按照97%相似性将序列进行OTU聚类,再将每个OTU的代表序列与真菌UNITE数据库进行比对,获得代表性序列在各分类水平的物种注释信息,并利用R 3.6.0软件制作物种相对丰度柱状图和稀释曲线图,采用Mothur 1.43.0进行rarefaction分析和计算Ace指数、Chao1指数、香农(Shannon)指数和辛普森(Simpson)指数,用以进行微生物丰度和多样性分析。采用R 3.6.0软件进行PCoA主坐标分析和样本层级聚类分析和制图。多组间差异分析和制图则采用LefSe 1.1.0软件进行。2组间差异分析则采用STAMP 2.1.3软件进行分析和制图。使用Excel 2016和SPSS 21.0软件对试验数据进行统计,对样品组间的差异采用单因素方差检验分析。
2.2 根际土壤真菌黄酮类成分分析
2.2.1 对照品溶液制备 精确称取淫羊藿苷对照品适量,加甲醇制成0.104 mg/mL的溶液。
精确称取朝藿定A、朝藿定B、朝藿定C、淫羊藿苷对照品适量,加甲醇制成含朝藿定A 0.104 mg/mL、朝藿定B 0.104 mg/mL、朝藿定C 0.100 mg/mL、淫羊藿苷0.100 mg/mL的混合溶液。
2.2.2 供试品溶液制备 取不同产地朝鲜淫羊藿叶片,粉碎过3号筛,取约0.2 g,置具塞锥形瓶中,精确加入稀乙醇20 mL,称定质量,超声处理1 h,放冷,再称定质量,用稀乙醇补足减失的质量,摇匀,过滤,取续滤液。
2.2.3 总黄酮含量测定
2.2.3.1 标准曲线制备 精确量取淫羊藿苷对照品溶液0.2、0.4、0.8、1.0、1.6、2.0、2.4、2.8 mL,分别置于10 mL容量瓶中,加甲醇定容至刻度,摇匀。以相应试剂为空白,在270 nm波长处测定吸光度,以淫羊藿苷浓度C(μg/mL)为横坐标,吸光度(D)为纵坐标,绘制标准曲线,回归方程为y=0.004 7x-0.002 8,r=0.999 8,线性范围为2.08~29.12 μg/mL。
2.2.3.2 样品含量测定 参照2020年版《中国药典》淫羊藿项下总黄酮含量测定方法[9]。
2.2.4 总黄酮醇苷含量测定
2.2.4.1 色谱条件 色谱柱Inertsil® ODS-3(4.6 mm×250 mm,5 μm);流动相水(A)-乙腈(B);梯度洗脱0~37 min,24% 乙腈;37~47 min,24%~38% B,47~60 min,38%~24% B;检测波长为 270 nm;柱温为30 ℃;进样量为10 μL[10]。
2.2.4.2 标准曲线制备 精确吸取混合对照品溶液2、4、6、8、10 μL,按“2.2.4.1”节色谱条件进样分析,以进样量(μg)为横坐标,峰面积(A)为纵坐标,绘制标准曲线。朝藿定A、朝藿定B、朝藿定C、淫羊藿苷的回归方程分别为y=236 084x+124.1、y=352 428x+1 683.1、y=251 598x+668.6、y=329 973x-6 238.7,决定系数r2均为0.999 9,线性范围分别为0.208~1.040、0.208~1.040、0.200~1.000、0.200~1.000 μg。
2.2.4.3 样品含量测定 取供试品溶液过 0.22 μm 滤膜后进样分析。
3 结果与分析
3.1 OTU聚类和物种注释
3.1.1 T1类样品OTU聚类和物种注释 通过对T1类5组样品数据的质量进行质控过滤,共得到有效序列369 745条和4 170个OTU。由图1可知,BT5组OTU数目为1 386个、DT5组1 792个、ST5组2 009个和NT5样品1 705个,BT5组OTU数目为2 650个、DT5组2 777个、ST5组2 791个和NT5样品2 465个,4组样品共有OTU数目416个,占全部OTU数目的9.98%;BT1、DT1、ST1和NT1样品特有OTU数目分别为354、499、563、469个,分别占本组OTU总数的25.54%、27.85%、28.02%、27.51%;ST1样品OTU数目和特有OTU数目最多,BT1样品最少。从门到属对4组样品所获得的OTU进行物种注释,除去未分类的,共得到16门56纲153目325科855属真菌。
3.1.2 T5类样品OTU聚类和物种注释 通过对T5类样品数据的质量进行质控过滤,共得到有效序列399 939条和4 983个OTU。由图2可知,BT5组OUT数目为2 650个、DT5组2 777个、ST5组2 791个和NT5样品2 465个,4组间共有OTU数目1 228个,占全部OTU数目的24.64%;4组特有OTU数目分别为401、419、477、297个,分别占本组样品OTU数目的15.13%、15.09%、17.09%、12.05%。从门到属对4组样品所获得的OTU进行物种注释,除去未分类的,共得到15门58纲160目340科933属真菌。与T1类样品相比,T5类样品OTU数目均有所升高,注释得到的物种数目有所增加,表明7月朝鲜淫羊藿根际土壤真菌组成更为丰富。
3.2 α多样性分析
3.2.1 质量分析 以随机抽取一定数量的序列为横坐标,OTU数目为纵坐标建立稀释曲线(图3),各组样品在横轴上曲线逐渐趋于平缓,表明本次测序结果合理,数据量足够,能够反映各组样品的根际土壤真菌群落的真实情况。

3.2.2 T1类样品α多样性指数分析 由表2可知,4组样品文库覆盖率均高达99%以上,表明注释结果能够反映各组样品根际土壤真菌群落的真实情况。ST1样品Ace指数和Chao1指数较BT1样品显著升高107.80%和44.27%(P<0.05),结果表明ST1样品真菌物种数量最多,BT1样品最少。对4组样品的Shannon指数和Simpson指数进行比较,NT1样品Shannon指数最高,较BT1、DT1和ST1样品显著升高30.00%、20.25%和37.82%(P<0.05),Simpson指数较BT1和DT1样品显著降低80.00%和86.67%(P<0.05),结果表明NT1样品真菌群落多样性最大。

表2 T1类样品α多样性指数分析
3.2.3 T5类样品α多样性指数分析 由表3可知,BT5样品Ace指数最高,较ST5样品显著升高20.45%(P<0.05)。对4组样品的Shannon指数和Simpson指数进行比较,BT5样品的Shannon指数最高,Simpson指数最低,BT5样品Shannon指数较NT5显著升高45.48%(P<0.05),Simpson指数较DT5显著降低82.61%(P<0.05),结果表明,BT5样品真菌群落丰富度和多样性最大。与T1类样品相比,T5类样品Ace指数和Chao1指数均有不同程度的升高,说明7月4个采集地朝鲜淫羊藿根际土壤真菌数目有所增加。

表3 T5类样品α多样性指数分析
3.3 β多样性分析
3.3.1 T1类样品β多样性分析 采用R软件的vegan的package进行T1类样品的属水平PCoA主坐标分析(图4),横坐标(PCoA1)解释度为36.2%,纵坐标解释度(PCoA2)为25.34%,总解释度高达61.54%,表明该分析能较好地解释其4组样品的根际土壤真菌群落结构的关系;DT1和BT1样品根际土壤真菌群落结构相似,距离较近,ST1和NT1样品相对距离较远,与另外2组样品真菌群落结构差异较大;结合样本层级聚类分析(图5),结果进一步验证了PCoA主坐标分析结果,当距离为0.1时,DT1和BT1样品聚为1支,ST1和NT1单独各聚为1支。

3.3.2 T5类样品β多样性分析 在属水平分析T5类样品真菌群落结构差异,结果(图6)表明,横坐标(PCoA1)解释度为53.56%,纵坐标解释度(PCoA2)为24.14%,总解释度高达77.70%,表明该分析能较好地说明4组样品的真菌群落结构的关系,由主坐标分析图可知,DT5和NT5样品距离较近,2组样品的真菌群落结构较为相似。ST5和NT5样品独立聚集且与其他2组样品距离较远,说明与其他2组根际土壤真菌群落结构相似度较低;样本层级聚类分析结果(图7)表明,NT5组样品聚为1支,DT5、ST5和BT5单独各聚为1支,结果表明,各组样品组内差异较小,而组间差异明显。在PCoA主坐标分析中DT5样品和NT5组距离较近,但该分析中DT5样品独立聚为1支,说明在微生物群落结构差异分析时应结合多种方法进行分析以确保结果的准确性。且通过T1类样品和T5类样品β多样性分析结果综合来看,时期的不同对真菌群落结构也存在一定的影响。

3.4 物种组成分析
3.4.1 T1类样品门、属水平物种组成分析 T1类样品门水平上的物种组成和相对丰度(平均相对丰度>1%)见图8、表4,除去未分类和其他,T1类样品主要由担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、子囊菌门(Ascomycota)、罗兹菌门(Rozellomycota)组成。其中担子菌门、被孢霉门、子囊菌门相对丰度均>1%为核心菌门。5组样品门水平物种组成上具有一定的相似性,但相对丰度具有明显的差异,ST1和NT1样品中担子菌门为第一优势菌门,其次为子囊菌门、被孢霉门等。BT1和DT1样品中则被孢霉门为第一优势菌门,其次为担子菌门、子囊菌门等。




表4 T1类样品门水平主要真菌相对丰度
T1类样品属水平上的物种组成和相对丰度(平均相对丰度>1%)见图9、表5,除去未分类和其他,主要由被孢霉属(Mortierella)、蜡壳耳属(Sebacina)、Amphinema属和棉革菌属(Tomentella)等菌属组成。其中被孢霉属、蜡壳耳属和棉革菌属为4组样品的核心菌属。另外通过对平均相对丰度>1%的菌属在各组样品中的占比进行统计发现,3组样品真菌群落丰度差异明显, BT1、DT1和NT1样品中被孢霉属为第一优势菌属,相对丰度分别为23.24%、49.99%、6.88%,其次为蜡壳耳属和棉革菌属等。ST1样品中Amphinema属为第一优势菌属,相对丰度高达37.81%,其次为蜡壳耳属(14.25%)、棉革菌属(8.36%)、被孢霉属(8.10%)、丝膜菌属(5.16%)等。此外Amphinema属为ST1样品中特有优势菌属,Piloderma属和锁瑚菌属Clavulina为NT1样品中特有优势菌属。


表5 T1类样品属水平主要真菌相对丰度
3.4.2 T5类样品门、属水平物种组成分析 T5类样品门水平上的物种组成和相对丰度(平均相对丰度>1%)由图10和表6可知,除去其他,主要集中于担子菌门、子囊菌门、被孢霉门、罗兹菌门等真菌类群。其中担子菌门、子囊菌门、被孢霉门为核心菌门。4组样品第一优势菌门均为担子菌门,平均相对丰度高达73.62%,其次相对丰度较高的为子囊菌门。
T5类样品属水平上的物种组成和相对丰度(平均相对丰度>1%)见图11和表7, 在属水平上主要由蜡壳耳属、棉革菌属、红菇属、丝膜菌属、Archaeorhizomyces属、湿伞属、被孢霉属组成。核心菌属为蜡壳耳属和被孢霉属。且通过主要菌属的相对丰度进行整理发现,3组样品真菌群落相对丰度差异明显,NT5、DT5和BT5样品中蜡壳耳属为第一优势菌属,相对丰度分别为60.33%、50.96%、33.03%,其次为红菇属、Archaeorhizomyces属、湿伞属等。而ST5样品中棉革菌属为第一优势菌属,相对丰度为25.36%,其次为丝膜菌属、蜡壳耳属等。此外,红菇属为BT5样品中特有优势菌属。

表7 T5类样品属水平主要真菌相对丰度
3.5 组间差异分析
3.5.1 T1类样品组间差异分析 为找寻T1类样品中具有统计学差异的生物标记物,利用组间差异显著性分析LefSe对4组根际土壤真菌群落进行比较, 结果见图12。以LDA 评分>4为标准, 在BT1样品中与其他组具有显著差异的真菌群落主要为牛肝菌目(Boletales); DT1样品中则为被孢霉属、被孢霉科(Mortierellaceae)等;ST1样品中Amphinema属、伞菌纲(Agaricomycetes)、担子菌门等与其他组别差异明显;NT1样品中为Piloderma属、丝膜菌属、罗兹菌门等。
3.5.2 T5类样品组间差异分析 由图13可知,以LDA评分>4为标准。在BT5样品中与其他组具有显著差异的真菌群落主要为红菇属、红菇目(Russulales)、红菇科(Russulaceae)等;DT5样品中则为Archaeorhizomyces属、Archaeorhizomycetes纲等;ST5样品中棉革菌属、丝膜菌属、革菌目Thelephorales等与其他组别差异明显;NT5样品中为湿伞属、蜡伞科(Hygrophoraceae)、锤舌菌纲(Leotiomycetes)等。
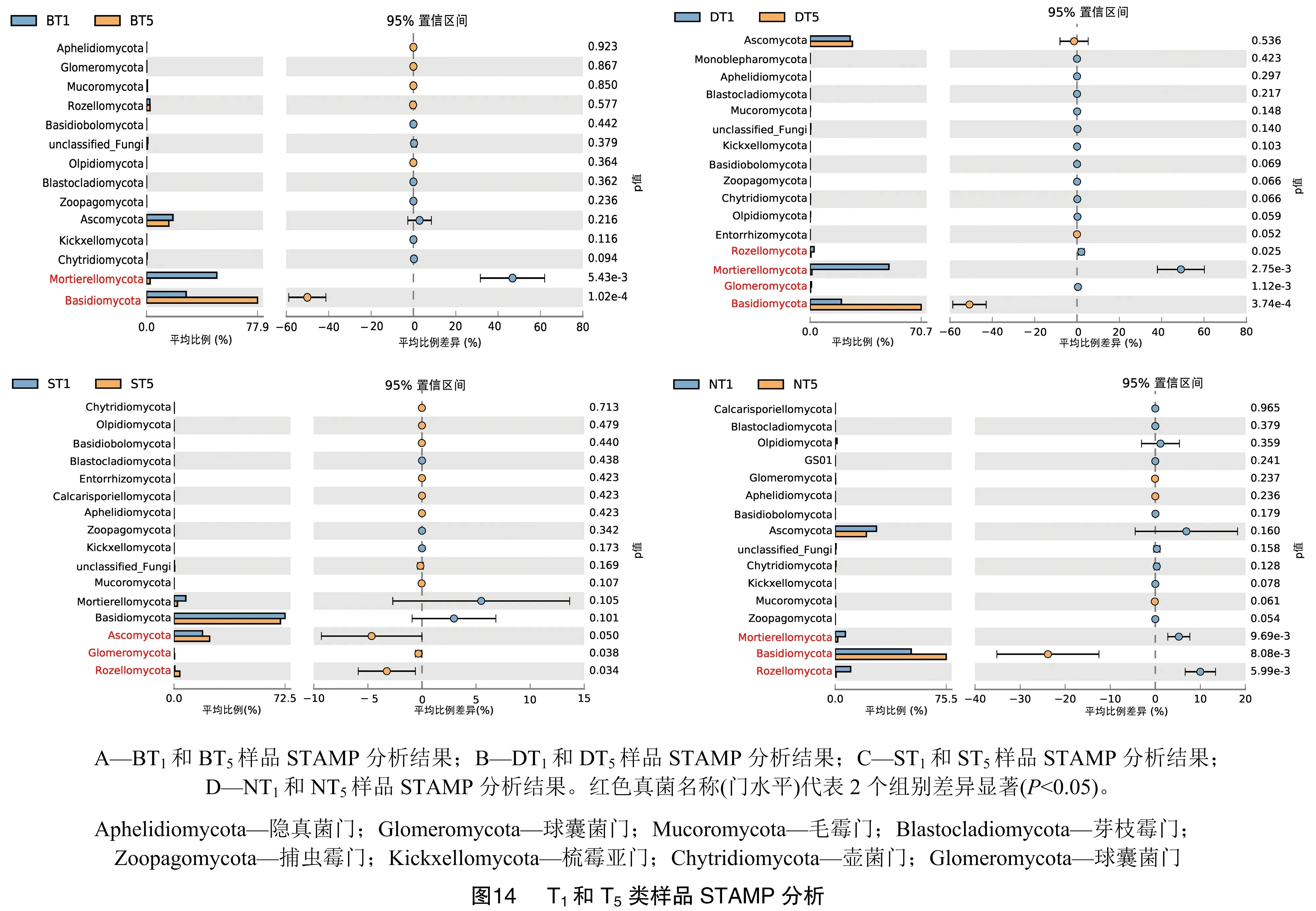
3.5.3 T1和T5类样品组间差异分析 由图14-A可知,BT1和BT5样品在门水平上相对丰度差异显著(P<0.05)的菌门为被孢霉门和担子菌门,BT1样品中被孢霉门占绝对优势,而BT5样品担子菌门相对丰度显著高于BT1;由图14-B可知DT1和DT5样品在门水平上相对丰度差异显著(P<0.05)的菌门为被孢霉门和担子菌门等,DT1样品中被孢霉门占绝对优势,而DT5样品担子菌门相对丰度显著高于DT1; 由图14-C可知,ST1和ST5样品在门水平上相对丰度差异显著(P<0.05)的菌门为子囊菌门和罗兹菌门等,ST5样品中子囊菌门相对丰度显著高于ST1;由图14-D可知,NT1和NT5样品在门水平上相对丰度差异显著(P<0.05)的菌门为担子菌门和罗兹菌门等,NT5样品担子菌门相对丰度显著高于NT1。综合4个采集地5月和7月根际土壤真菌群落(门水平)发现,造成5月和7月根际土壤真菌群落组成差异主要受被孢霉门、担子菌门和子囊菌门真菌影响。

3.6 根际土壤真菌黄酮类成分分析
各组样品黄酮类成分测定结果见表8。

表8 各组样品黄酮类成分测定结果
3.7 根际土壤真菌与黄酮类成分相关性分析
采用R 3.6.0软件对5月朝鲜淫羊藿根际土壤真菌(属水平)与黄酮类成分进行Spearman相关性分析,其中与黄酮类成分呈显著或极显著相关性菌属较多。对平均相对丰度占比较高且与黄酮类化学成分具有显著关系(P<0.05)的菌属相关系数进行统计(表9),蜡壳耳属与朝藿定A和朝藿定B呈显著负相关(P<0.05);湿伞属朝藿定C呈显著正相关(P<0.05),与淫羊藿苷呈显著负相关(P<0.05);红菇属与总黄酮醇苷呈显著正向相关(P<0.05),Paraphoma属与朝藿定C呈极显著正相关(P<0.01),丝盖伞属与总黄酮呈显著正相关(P<0.05),与淫羊藿苷和总黄酮醇苷呈极显著正相关(P<0.01),锁瑚菌属除与朝藿定C和淫羊藿苷无显著相关性外,与其他4种化学成分均呈显著正相关(P<0.05)。

表9 5月根际土壤真菌主要菌属与黄酮类成分相关系数
7月朝鲜淫羊藿根际土壤真菌(属水平)与黄酮类成分相关性分析结果见表10,蜡壳耳属与总黄酮呈显著正相关(P<0.05),Archaeorhizomyces属与淫羊藿苷呈显著正相关(P<0.05),湿伞属、被孢霉属黄酮类化学成分均呈不同程度负相关,绝大部分显著相关(P<0.05)。与5月不同的是,蜡壳耳属在5月与朝藿定A和朝藿定B呈显著负相关,而在7月与总黄酮呈显著正相关。

表10 7月根际土壤真菌主要菌属与黄酮类成分相关系数
4 讨论与结论
研究表明,吉林省临江市地区朝鲜淫羊藿根际土壤真菌群落主要由被孢霉属和蜡壳耳属组成。但因采集地点和采集时期的不同,相对丰度存在一定的差异。以上菌属广泛存在于植物的根际土壤中[7-10]。此外本研究发现不同采集地和不同采集时期的根际土壤真菌数量、种类、结构不同,原因可能是真菌组成和分布对外界环境变化较为敏感[11],4个采样点虽同处于一个地区,但降水量、土壤理化性质等因素可能是造成真菌组成和分布差异的因素之一[12];7月朝鲜淫羊藿根际土壤真菌群落丰富度高于5月,这一结论与康捷等的研究结果[13]较相似。
在本研究中被孢霉属在朝鲜淫羊藿根际土壤中广为分布,是5月不同采集地差异菌属之一。相关研究表明,被孢霉属在土壤中分布广泛,可对土壤结构的改良[14]及植物的生长和代谢[15-16]起到一定的作用。蜡壳耳属和红菇属属于外生菌根真菌,在促进植物生长和对水分的吸收具有一定的作用[17-18],在本研究中蜡壳耳属、红菇属、湿伞属等菌属是造成7月不同采集地不同生长阶段根际土壤真菌群落结构差异的主要菌属。
通过对吉林省临江市地区不同采集地朝鲜淫羊藿根际土壤真菌多样性进行分析表明,其根际土壤真菌种类丰富,受采集地和采集时期不同根际土壤真菌的种类、数量和结构存在不同程度的差异。通过进一步分析朝鲜淫羊藿根际土壤真菌与内在黄酮类成分之间的关系发现,在不同的采集时期真菌群落对其成分的影响也是不同的。
现有研究表明蜡壳耳属中vermifera菌株可促进植物的生长和对磷元素的吸收,同时提高植株的抗灰霉病能力[19-20],在本研究中,7月根际土壤真菌中蜡壳耳属与总黄酮呈显著正相关(P<0.05)。此外Archaeorhizomyces属具有良好的抗菌活性[21]。7月根际土壤真菌中该属与淫羊藿苷呈正相关(P<0.05)。因此,依据本研究结果,可以推测蜡壳耳属、Archaeorhizomyces属等真菌类群与黄酮类化学成分含量具有正相关关系。研究结果可为后续筛选促进朝鲜淫羊藿黄酮类成分合成和积累或可产相似化学成分相关微生物提供理论依据。

