SHCBP1高表达促进鼻咽癌细胞上皮间质转化过程的分析
鲜志芃,喻国冻,,张田,吴志敏,周方伟
(1.贵州医科大学,贵州 贵阳 550004;2.贵州医科大学附属医院 耳鼻咽喉科,贵州 贵阳 550004)
鼻咽癌是一种起源于鼻咽黏膜内层的上皮源性恶性肿瘤,其发病机制复杂,目前认为与EB 病毒 (epstein-barrvirus, EBV) 感染等多因素有关[1]。鼻咽癌发病较为隐匿,患者确诊时往往已有远处转移[2]。因此,探索鼻咽癌细胞侵袭及转移分子机制对早期诊断、抑制或延缓鼻咽癌转移、改善鼻咽癌患者预后具有重大意义。
Src同源成员和胶原同源物(Src homolog and collagen homolog,SHC)SH2结构域结合蛋白1(SHC SH2-domain binding protein 1,SHCBP1)位于染色体 16q11.2[3]。研究发现SHCBP1是细胞内信号转导和细胞分裂中的重要蛋白质,参与细胞生长、增殖、分化、早期胚胎发育、肿瘤发生和进展[4]。目前有研究发现SHCBP1在调控肿瘤细胞的上皮间质转化(epithelial-mesenchymal transformation, EMT)过程中扮演了重要的角色,而EMT也被证实在恶性肿瘤的发生发展中极为重要,其可增强恶性肿瘤转移、侵袭、放化疗抵抗、肿瘤干性等能力[5-7]。同时也有研究指出EMT与肿瘤免疫浸润之间有着密切的联系[8]。在滑膜肉瘤中SHCBP1高表达促进了EMT过程的发生,从而使肿瘤的侵袭、迁移能力增强[9]。Liu等[10]发现 在肺癌中表皮生长因子(epidermal growth factor,EGF)可诱导 SHCBP1高表达,从而促进β-catenin入核,促进EMT过程发生,并可通过激活EGF-β-catenin通路促进肺癌细胞的增殖与侵袭能力。
目前有研究表明[11-12],在鼻咽癌的发生发展中,特别是鼻咽癌的侵袭及转移能力可能与EMT过程密切相关。前期我们利用TCGA数据库,发现SHCBP1在头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSC)中高表达。因此我们假设SHCBP1在鼻咽癌中表达量也增高,而目前未见关于SHCBP1在鼻咽癌EMT过程发生的研究,故本研究通过探究SHCBP1在鼻咽癌中的表达情况,以及构建沉默SHCBP1表达的鼻咽癌细胞系稳转株,从而探究这一过程发生机制,同时分析了SHCBP1表达与HNSC患者生存率以及肿瘤免疫浸润间的关系,以期为鼻咽癌的治疗提供新的基础研究证据以及思路。
1 材料与方法
1.1 生物信息学分析
从美国癌症基因图谱TCGA数据库(https://portal.gdc.cancer.gov)获取502例HNSC及44例正常组织的mRNA表达水平。利用R-4.1.2软件整理、分析数据,并使用edgeR包筛选差异基因,探究SHCBP1在HNSC中的表达情况。将HNSC患者按SHCBP1表达量的四分位分组,高于表达量75%为高表达组(SHCBP1-High),低于表达量25%为低表达组(SHCBP1-Low),分析SHCBP1表达量与总体生存率之间的关系,并利用单样本基因集富集分析(single sample gene set enrichment analysis, ssGSEA)探究SHCBP1表达量与常见免疫细胞浸润的相关性[13]。
1.2 组织样本
收集贵州医科大学附属医院及贵州医科大学附属肿瘤医院经病理确诊的初诊鼻咽癌患者,所有患者确诊前均未接受任何放化疗,其中男18例,女13例;年龄31~60岁,平均年龄(46.19±8.46)岁。同期收集诊治的疑似鼻咽癌但病理示慢性鼻咽炎的患者,其中男12例,女19例;年龄29~67岁,平均年龄(45.64±6.79)岁。所有标本均由同一医师获取,所取组织离体后立即放入液氮中进行保存。本研究获得贵州医科大学附属医院伦理委员会伦理审查(伦理号2021伦审第81号),所取标本及标本用途均获得患者及其家属知情同意。
1.3 细胞及主要实验仪器、耗材
鼻咽癌细胞系5-8F、正常鼻咽部上皮NP69均购自丰晖生物,引物由上海生工设计合成,慢病毒载体(LV-SHCBP1-shRNA-ZsGreen-PURO、LV- NC-ZsGreen-PURO)购自上海汉恒生物。RPMI 160培养基、胎牛血清、0.25%胰蛋白酶、Trizol均购自Thermo Fisher Scientific公司,Matrigel基质胶、Transwell小室均购自美国CORNING公司,逆转录及qPCR相关试剂购自南京诺维赞生物科技有限公司,anti-SHCBP1(ab184467)购自美国Abcam,anti-E-cadherin(#3195)、anti-N-cadherin(#13116)、anti-Vimentin(#5741)、anti-基质金属蛋白9(matrix metalloprotein,MMP9,#13667)均购自美国CST公司。
1.4 临床样本检测与细胞系中SHCBP1表达情况
Trizol法分别提取临床组织及细胞系总RNA后,使用Thermo Scientific Nano Drop 分光光度计测量所得RNA溶液浓度及纯度,随即按说明书使用逆转录试剂(Takara,JP)制取cDNA。将所得部分cDNA稀释3倍后用作实时荧光定量PCR(qPCR)检测,剩余cDNA置于-80 ℃冰箱保存。按qPCR试剂盒(诺唯赞,南京)说明书配置反应体系及设置反应条件,引物由上海生工公司合成。引物序列信息见表1,qPCR反应体系见表2,循环条件为预变性95 ℃,30 s;变性95 ℃,10 s,退火+延伸60 ℃,30 s,共循环40次。每个样本设置2个复孔,分别独立重复3次实验,结果以2-ΔΔct计算。
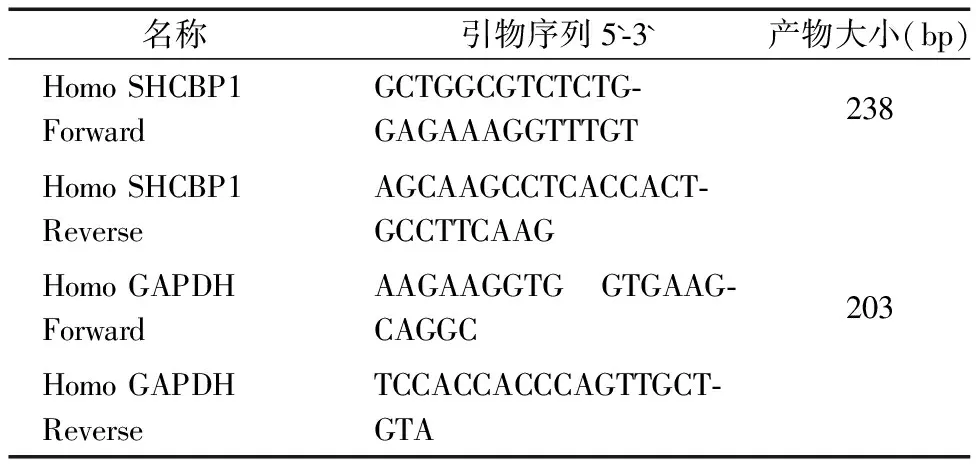
表1 引物序列

表2 PCR反应体系
1.5 细胞培养及慢病毒感染
将冷冻于液氮中的 5-8F 鼻咽癌细胞复苏后,接种于含有10%胎牛血清和90% RIPM 1640的完全培养基的6孔板内,接种密度为3×10-4/孔,并置于37 ℃、5%CO2的细胞培养箱内培养。24 h后待细胞密度达30%~40%时使用慢病毒进行感染(MOI=20),并分为NC组(空载慢病毒LV-ZsGreen-PURO-NC感染5-8F细胞)及SHCBP1-shRNA组(LV-SHCBP1-shRNA-ZsGreen-PURO沉默5-8F细胞SHCBP1表达)。感染24 h后更换无病毒完全培养基,48~72 h后于荧光显微镜下观察细胞绿色荧光表达情况,并加入嘌呤霉素(4 μg/mL)筛选稳转株用于后续实验。
1.6 CCK-8检测各组细胞增殖能力
取生长状态良好的NC组和SHCBP1-shRNA组细胞1 500/孔接种于96孔板内,每组设置3个复孔,并重复3次。分别在0、24、48、72、96 h时分别在每孔中加入10 μL CCK-8溶液,并置于培养箱内培养1 h后,利用酶标仪测量450 nm处吸光度。
1.7 划痕实验检测各组细胞迁移能力
取生长状态良好的NC组和SHCBP1-shRNA组细以1×10-5/孔种于6孔板内,放入培养箱内培养,待细胞长满6孔板后,使用200 μL枪头垂直于6孔板底壁做划痕,并使用PBS漂洗划落细胞后加入无血清培养基,于0、12、24 h后采用显微镜在相同位置拍照。
1.8 集落形成实验
取生长状态良好的NC组和SHCBP1-shRNA 1 000/孔接种于6孔板中,放入培养箱内,每隔2~3 d换液并于倒置显微镜下观察细胞生长状况,待肉眼可见细胞集落时,去除培养基,加入多聚甲醛固定20 min,加入结晶紫溶液染色20 min,并拍照、计数、分析数据。
1.9 Transwell迁移、侵袭实验
取生长状态良好的NC组和SHCBP1-shRNA制成5×10-4/mL无血清细胞悬液,并以200 μL/孔种入Transwell小室上室,并于下室内加入600 μL含30% FBS完全培养基。24 h后取出Transwell小室,使用棉签轻轻擦拭小室上室,将小室置于4%多聚甲醛内固定20 min。固定完成后,使用PBS轻轻漂洗小室,并将小室置于结晶紫溶液中染色20 min。PBS轻轻漂洗小室后置于倒置显微镜下拍照、分析细胞迁移率。Transwell侵袭实验先于小室上室涂抹Matrigel基质胶并放入细胞培养箱内1 h使基质胶凝固,其余步骤与迁移实验相同。
1.10蛋白免疫印迹检测
取生长状态良好的NC组、SHCBP1-shRNA组细胞接种于100 mm培养皿内。细胞汇合度达90%时,使用含有PMSF的RIPA细胞裂解液提取总蛋白。蛋白质定量试剂盒(BCA法)进行蛋白定量后,加入5×Loading buffer于蛋白样品内并充分混匀,置于100 ℃金属浴上变性5 min,置于-80 ℃冰箱备用。按说明书配制10% SDS-PADG凝胶,充分混匀变性蛋白样品后上样,上样量为5 μg/孔。以恒压方式进行电泳,电泳结束后以恒流260 mA转膜。转膜结束后,取下PVDF膜置于5%脱脂牛奶内室温封闭1 h,加入一抗4 ℃孵育过夜,回收一抗,TBST漂洗3次,10 min/次,加入二抗,室温孵育1 h,回收二抗,TBST漂洗3次,10 min/次。配置新鲜ECL显影液,将PVDF膜放入其中浸泡10 s左右后,放入凝胶成像仪内,采集荧光信号、拍照,并分析结果。
1.11统计学方法
2 结果
2.1 TCGA数据库中SHCBP1在HNSC中的表达情况
分析TCGA数据库中502例HNSC及44例正常组织的mRNA表达水平,得出SHCBP1的mRNA表达量在HNSC中明显增高(P<0.05),见图1A;Kaplan-Meier生存分析提示,SHCBP1高表达的患者生存率明显低于SHCBP1低表达患者(P<0.05),见图1B。
2.2 SHCBP1表达与肿瘤免疫浸润的关系
通过ssGSEA算法分析肿瘤浸润免疫细胞与HNSC中SHCBP1表达量高低的关系发现,在11种常见免疫细胞中,共有7种免疫细胞在HNSC中SHCBP1高表达组与SHCBP1低表达组中浸润程度的差异具有统计学意义(P<0.05),见图2A。通过对此7种免疫细胞进行相关性分析发现,Th2细胞的浸润程度与SHCBP1的表达量呈正相关(rs=0.422,P<0.05),而B细胞(rs=0.101,P=0.024)、T细胞(rs=0.148,P<0.001)、CD8+T细胞(rs=-0.151,P<0.001)、Tregs细胞(rs=0.146,P=0.001)、DC细胞(rs=0.169,P<0.001)的浸润程度与SHCBP1的表达量呈负相关(图2B)。
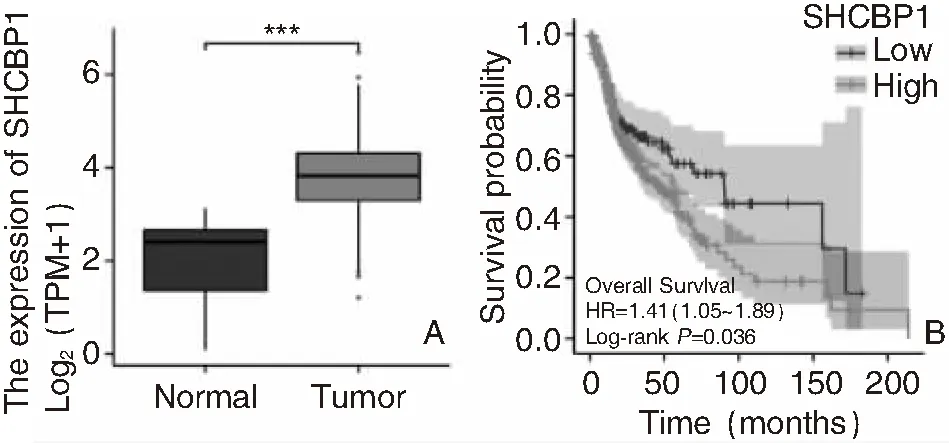
图1 SHCBP1在HNSC中的表达情况 A:柱状图(***P<0.001); B:HNSC患者Kaplan-Meier生存曲线(P=0.036) 注:HNSC(头颈鳞状细胞癌)。
2.3 RT-qPCR分析临床样本及细胞系中SHCBP1表达情况
SHCBP1在鼻咽癌中mRNA相对表达量1.58±0.37高于慢性鼻咽炎组织中mRNA相对表达量0.53±0.19(t=11.729,P<0.001,图3A);在5-8F细胞中mRNA相对表达量1.75±0.27高于NP69细胞中mRNA的表达量,差异具有统计学意义(t=6.895,P=0.001,图3B)。
2.4 慢病毒感染5-8F细胞及感染效率
倒置荧光显微镜下观察慢病毒感染后的5-8F细胞中荧光蛋白的表达,在72 h后荧光蛋白表达率高于80%(图4A)。RT-qPCR检测提示SHCBP1-shRNA组SHCBP1相对表达量0.25±0.03明显低于NC组(t=49.099,P<0.001,图4B),免疫印迹实验证实SHCBP1在NC组相对表达量1.05±0.32明显高于SHCBP1 shRNA组0.34±0.40(t=23.984,P<0.001,图4C、D),证明SHCBP1-shRNA慢病毒载体能有效沉默5-8F中SHCBP1的表达。
2.5 沉默SHCBP1对5-8F细胞增殖能力的影响
使用酶标仪测量各组各个时间点在450 nm处的吸光度(表3),结果显示NC组在24、48、72、96 h的吸光度均高于SHCBP1-shRNA组,这说明沉默5-8F细胞SHCBP1表达后可明显抑制5-8F细胞增殖(图5A)。克隆形成实验提示,SHCBP1-shRNA组细胞克隆数量31.00±12.05明显低于NC组283.43±41.43(t=15.478,P<0.001,图5B、C)。
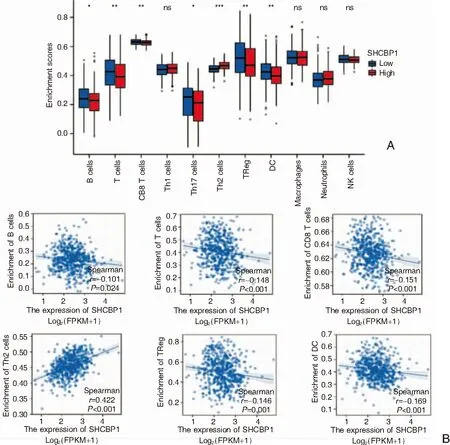
图2 免疫细胞在SHCBP1高表达组与低表达组中的浸润程度差异 A:11种免疫细胞; B:B细胞、T细胞、CD8+T细胞、Th2细胞、Treg细胞、DC细胞浸润程度与HNSC中SHCBP1表达量的关系(*P<0.05;**P<0.01;***P<0.001)
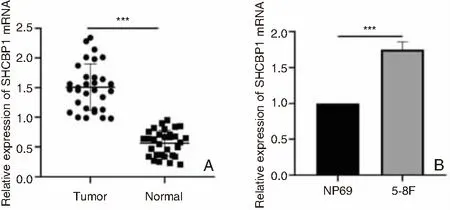
图3 临床样本及细胞系中SHCBP1的表达情况 A:鼻咽癌组织中mRNA相对表达量高于慢性鼻咽炎组织(***P<0.001); B:SHCBP1在NP69及5-8F中表达情况(***P<0.001)
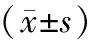
表3 各组450nm处吸光度
图4 慢病毒感染5-8F细胞 A:倒置荧光显微镜下观察 (×200); B:慢病毒沉默SHCBP1 mRNA表达效率(***P<0.001); C、D:慢病毒沉默SHCBP1蛋白表达效率(***P<0.001)
2.6 沉默SHCBP1表达可降低5-8F细胞迁移及侵袭能力
NC组及SHCBP1-shRNA组12、24h内迁移率见表4,SHCBP1-shRNA组较NC组迁移能力显著降低(P<0.05,图6)。Tranwell迁移实验提示NC组24h内细胞迁移数量明显高于SHCBP1-shRNA组(P<0.05);Transwell侵袭实验同样显示,NC组细胞24h内侵袭数量明显高于SHCBP1-shRNA组(P<0.05)(表5、图7)。
2.7 沉默SHCBP1表达可抑制5-8F细胞EMT过程激活
免疫印迹实验提示,SHCBP1-shRNA组E-cadherin表达明显高于NC组(t=6.271,P=0.003),SHCBP1-shRNA组N-cadherin、Vimentin、MMP9表达明显低于NC组(t=11.470/4.080/10.970,P<0.05),这说明了沉默SHCBP1后,可明显抑制5-8F细胞EMT过程(图8)。
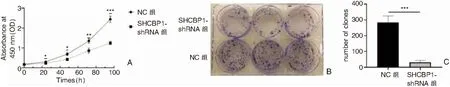
图5 CCK-8检测各组细胞增殖能力 A:各组不同时间段5-8F细胞增殖情况(*P<0.05;**P<0.01;***P<0.001); B:集落克隆形成实验; C:两组集落克隆数量柱状图(***P<0.001)
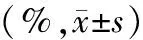
表4 NC组与SHCBP1-shRNA组不同时间迁移率比较
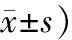
表5 NC组与SHCBP1-shRNA组 Transwell迁移及侵袭比较 (个,
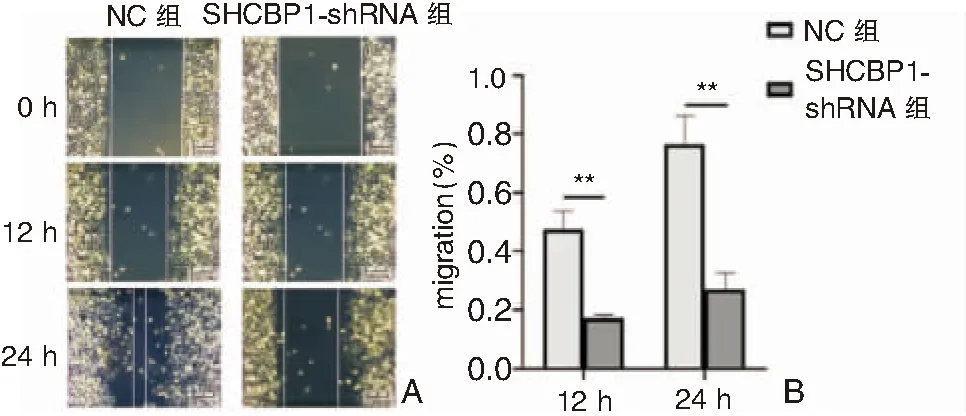
图6 划痕实验检测各组细胞迁移能力 A:5-8F细胞迁移能力 (×200); B:5-8F细胞迁移率柱状图(**P<0.01)
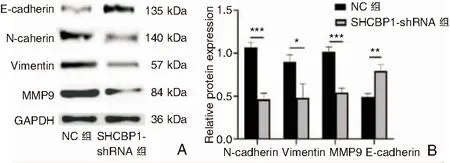
图8 免疫印迹实验 A:5-8F细胞沉默SHCBP1后EMT相关蛋白变化; B:柱状图显示SHCBP1-shRNA组N-cadherin、MMP9、Vimentin表达低于NC组,E-cadherin表达高于NC组(***P<0.001,**P<0.01,*P<0.05) 注:MMP9(基质金属蛋白9)。
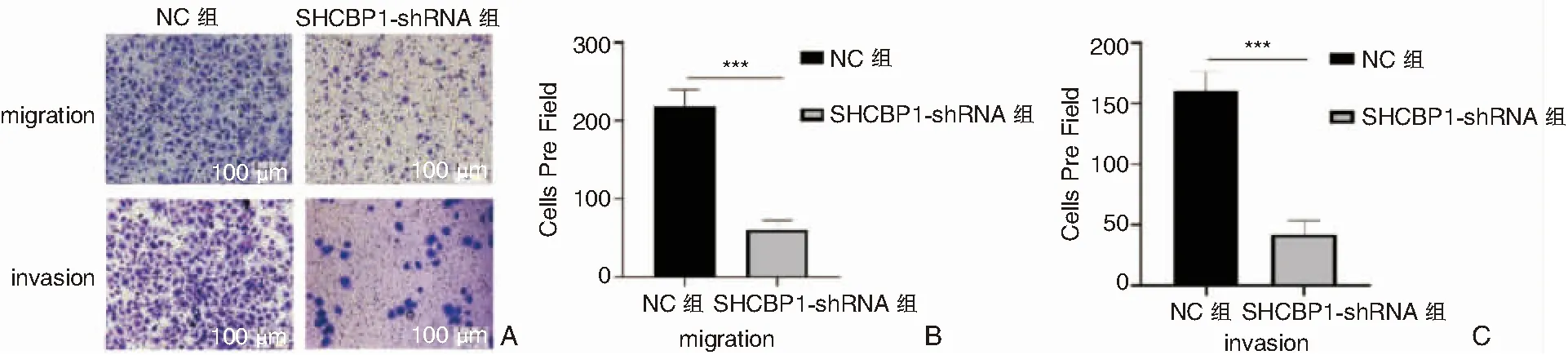
图7 Transwell迁移、侵袭实验 A: NC组与SHCBP1-shRNA组比较 (结晶紫 ×200); B:检测5-8F细胞迁移细胞数量柱状图(***P<0.001); C:检测5-8F细胞迁移细胞数量柱状图(***P<0.001)
3 讨论
鼻咽癌是一种常见的上皮来源的头颈部恶性肿瘤,好发于东南亚国家以及我国的福建、广东、广西等地区[14],其发病原因主要与EBV感染、遗传、饮食、环境等因素相关,并且有明显的家族聚集性[14-15]。目前鼻咽癌以放疗为主要治疗方式,特别是近期调强放疗的兴起,大大提高了鼻咽癌的治疗效率[16-17],但是因其发病部位隐蔽,早期无明显临床症状,大多数患者确诊时已经出现了局部淋巴结及远处转移,从而使得患者的远期生存率明显降低[17]。所以寻找鼻咽癌局部淋巴结及远处转移的机制以及NPC发病的特异性靶点就显得尤为重要。
SHCBP1能特异性结合SHC SH2结构域,目前研究证实SHCBP1是细胞内信号转导和细胞分裂的重要蛋白,其参与了细胞生长、增殖、分化、肿瘤发生发展。一项关于胰腺癌的研究发现,SHCBP1可抑制E-cadherin的表达,进而激活EMT过程,促进肿瘤转移[18]。在肺癌中SHCBP1可通过激活Wnt信号通路,从而促进肺癌的远处转移及侵袭[19]。另一项关于非小细胞肺癌的研究发现[10],SHCBP1可以促进非小细胞肺癌的增殖、侵袭、转移,并且SHCBP1的表达量与NSCLC患者的中位生存时间和无复发生存时间有密切关系。在前列腺癌[20]中SHCBP1高表达与前列腺癌的侵袭、转移能力相关,同时SHCBP1表达量与前列腺癌的临床分期呈正相关。神经胶质瘤中SHCBP1同样可以促进EMT过程,进而增强神经胶质瘤的转移、侵袭能力[21]。Feng等[22]发现SHCBP1在乳腺癌中表达增高,并且SHCBP1的表达量与乳腺癌临床分期有明显的相关性,通过对分子机制的研究,研究人员发现SHCBP1可能通过激活AKT信号通路,从而调节乳腺癌的增殖及凋亡。在滑膜肉瘤中SHCBP1高表达促进了EMT过程的发生,从而使肿瘤的侵袭、迁移能力增强[9]。EMT是一种细胞由上皮表型向间质表型转变的连续变化的生物学过程,从而使细胞获得更强的迁移、侵袭能力[23]。近年来多个研究已证实EMT在多种恶性肿瘤具有促进肿瘤转移、侵袭、耐药性的作用[24]。E-cadherin与N-cadherin是EMT过程发生的两种重要标志性分子。近年来有许多研究表明[11-12],在鼻咽癌发展过程中,鼻咽癌细胞E-cadherin的表达被抑制,这便造成了肿瘤细胞间的紧密黏附失效,从而肿瘤细胞的迁移能力增强。
因此本研究首先通过TCGA数据库分析发现SHCBP1在HNSC中表达明显增高,并且SHCBP1的表达量与HNSC患者的总体生存率相关。同时有文献报道SHCBP1在CD4+T细胞的调节中发挥着重要的作用[25],而CD4+T细胞的激活及分化在肿瘤浸润免疫中有着重要的作用。因此我们分析了SHCBP1的表达量与几种常见免疫细胞之间的关系。发现SHCBP1的表达量与HNSC中Th2细胞的浸润量呈正相关,这意味着SHCBP1可能也参与了HNSC的免疫浸润。随后我们通过对临床鼻咽癌样本的分析以及细胞实验发现SHCBP1在鼻咽癌组织及鼻咽癌细胞系中表达量均明显增高。紧接着在沉默鼻咽癌细胞中SHCBP1表达后,细胞功能实验以及检测EMT相关蛋白发现其表达量也出现了变化,这提示SHCBP1可促进鼻咽癌细胞的增殖、迁移、侵袭以及激活鼻咽癌的EMT过程的发生。
综上所述,SHCBP1在鼻咽癌中作为一种促癌基因,可以促进鼻咽癌细胞的增殖、迁移、侵袭能力,同时也能激活EMT过程。然而目前关于SHCBP1激活鼻咽癌的EMT过程所涉及的具体信号通路等仍然不明确,还有待进一步探究。与此同时,本研究也发现SHBCP1的表达量与HNSC中Th2细胞的浸润呈正相关,这是否意味着,SHCBP1也参与了HNSC的肿瘤免疫浸润,同时也影响了鼻咽癌 EMT过程的激活。但是由于鼻咽癌中仅有一部分属于角化型癌,仅仅通过TCGA数据库中对HNSC的分析,还不足以说明这一点。所以还有待进一步探究SHCBP1在鼻咽癌肿瘤免疫浸润中的作用。同时由于SHCBP1作为一种重要的与细胞内外信号传递有关的蛋白,这预示着SHCBP1有望成为一种鼻咽癌治疗的新靶点。

