化痰祛瘀法中药调控lncRNA-TUG1防治动脉粥样硬化的机制研究
李文涛,秦合伟,牛雨晴
动脉粥样硬化(AS)是缺血性心脑血管疾病的主要病理基础,目前对于缺血性心脑血管疾病的防治不理想,抗血小板、调血脂、血管介入疗法等均难以彻底解决动脉再狭窄的根本问题[1],中医药的整体观念、辨证论治、多靶点作用在防治AS方面具有优势。研究显示,血管内皮细胞在受外界因素刺激导致损伤时,引起细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子(VCAM-1)、白细胞介素-8(IL-8)、单核细胞趋化蛋白-1(MCP-1)等分子呈现高表达,进而促进单核细胞与内皮的黏附和浸润,促进AS的发生发展[2]。在AS的病变过程中,长链非编码RNA-TUGl(lncRNA-TUGl)在血管内皮细胞中呈现高表达,而敲低lncRNA-TUGl表达能抑制内皮细胞凋亡,减少低氧及肿瘤坏死因子-α(TNF-α)刺激下的内皮细胞损伤,降低ICAM-1、VCAM-1表达水平,抑制p38丝裂原活化蛋白激酶(p38 MAPK)信号通路的活化,因此,lncRNA-TUGl参与内皮炎症损伤和AS相关疾病[3]。本课题组既往研究发现,化痰祛瘀法中药具有明显的防治AS的作用[4-8],本研究旨在观察化痰祛瘀法中药抗AS的作用机制是否与靶向调控lncRNA-TUG1抑制p38 MAPK信号通路活化及其下游信号T-p38、p-p38表达,从而抑制炎性反应、调控血脂、保护血管内皮损伤有关。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级健康雄性载脂蛋白E基因敲除(ApoE-/-)小鼠60只,体质量(20±2)g,购自北京维通利华实验动物技术有限公司[动物许可证号:SCXK(京)2016-0006],饲养于河南中医药大学第二附属医院动物实验中心[动物许可证号:SCXK(豫)2016-0009],(22±1)℃恒温、60%~75%恒湿、12 h循环照明,自由摄食、饮水。经河南中医药大学第二附属医院动物实验伦理委员会审核通过,本实验设计方案符合安全性和公平性原则,实验动物符合国家对医学实验动物的有关要求[4],伦理审核批准标号:20190622。
1.2 实验药物 研究所用化痰祛瘀法中药组方为血管软化丸,组成:山楂30 g,陈皮12 g,清半夏10 g,黄芪30 g,丹参12 g,三七12 g,莱菔子15 g。方中所有中药均来源于河南中医药大学第二附属医院药剂科。按照“人和动物体表面积折算的等效剂量比率表”换算成低、高2个剂量(43.2 g/kg、86.4 g/kg),分别相当于60 kg成人临床用量等效量的11.6倍和23.3倍,医院煎药房按照要求煎煮成生药,含量为1.738 g/mL、3.476 g/mL。
1.3 主要试剂 荧光定量聚合酶链式反应(PCR)试剂盒(批号:A8203-6,TaKaRa公司),蛋白提取试剂盒(批号:P0027,碧云天公司),MCP-1抗体(批号:ab8015,英国Abcam公司),VCAM-1抗体(批号:FNab09950,武汉菲恩生物科技有限公司),ICAM-1抗体(批号:FNab04103,武汉菲恩生物科技有限公司),IL-8抗体(批号:ATA31455,武汉益普生物科技有限公司),T-p38抗体(批号:AF869,上海嵘崴达实业有限公司),p-p38抗体(批号:PL0304503,深圳市豪地华拓生物科技有限公司),荧光二抗(批号:SA00007-2,美国Proteintech公司),RNA逆转录试剂盒(批号:MR05101M,莫纳公司),无水乙醇(批号:E111963,上海恒斐生物科技有限公司),二甲苯(批号:FT21419yy,上海梵态生物科技有限公司),磷酸缓冲盐溶液(PBS)(批号:JS0722,北京德航五洲科技有限公司),蛋白酶K溶液(批号:YT8625,北京伊塔生物科技有限公司)。
1.4 主要仪器 TGL-16M型台式高速冷冻离心机(济南欧莱博科学仪器有限公司),MT-200型Morris水迷宫视频跟踪系统(成都泰盟科技公司),JT-12J型电脑生物组织脱水机(武汉俊杰电子有限公司),HS-B7126-B型包埋机(沈阳恒松科技有限公司),EMUC7型超薄切片机(德国Leica公司),光学显微镜(奥林巴斯北京有限公司),Reichert Ultracut E切片机(米力光国际贸易有限公司)。
1.5 方法
1.5.1 分组、造模与给药 ApoE-/-小鼠适应性饲养1周后全程给予高脂饲料(含玉米淀粉23.51%、酪蛋白22.18%、可可脂17.19%、蔗糖12.53%、麦芽糊精7.87%、纤维素5.54%、大豆油2.77%、柠檬酸钾1.83%、磷酸钙1.44%、胆固醇1.25%、维生素预混料1.11%、矿物质预混料1.11%、碳酸钙0.61%、胆酸钠0.50%、胱氨酸0.33%、胆碱0.22%)喂养。饲养8周造模成功(每组随机抽取1只小鼠,可见主动脉壁明显的斑块形成)后开始干预,随机分为模型组(每天给予生理盐水86.4 g/kg)、lncRNA-TUG1拮抗剂组(每天小鼠静脉注射lncRNA-TUG1拮抗剂30 mg/kg)、化痰祛瘀法低剂量组(每天给予化痰祛瘀法中药43.2 g/kg)、化痰祛瘀法高剂量组(每天给予化痰祛瘀法中药86.4 g/kg),每组15只。每天干预1次,连续干预8周。
1.5.2 样品采集 干预8周后取材,采集血清检测血脂和血清炎性因子水平。取胸腹全长主动脉,其中近心端主动脉采用苏木精-伊红(HE)染色;其余部分采用逆转录聚合酶链式反应(RT-PCR)和蛋白质免疫印迹法(Western Blot)检测。
1.5.3 血脂检测 采用大型生化检测仪检测各组小鼠血脂4项:胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)。
1.6 病理学观察 收集小鼠近心端主动脉,采用HE染色进行病理观察,采用Image Pro Plus 检测管腔面积(luminal area,LA)、内膜厚度(intima medium thickness,IMT)、斑块面积(plaque area,PA)、纤维肌性成分(fiber structure,FS)、脂质中心面积(cholesterol area,CA)、最小纤维帽厚度(fiber cap thickness,FCT)。
1.7 酶联免疫吸附法(ELISA)测定外周血清ICAM-1、VCAM-1、IL-8和MCP-1等炎性因子水平 采用ELISA法按试剂盒说明书检测血清中ICAM-1、VCAM-1、IL-8和MCP-1水平。
1.8 RT-PCR检测各组主动脉lncRNA-TUG1、ICAM-1、VCAM-1相对表达量 收集主动脉提取总RNA,利用Nanodrop 2000测定总RNA浓度,利用反转录试剂盒将总RNA反转成cDNA模板,将荧光染料SYBR Green和目的基因与内参GADPH的引物混匀后上机检测;反应条件:95 ℃ 30 s,1个循环;94 ℃ 5 s,58 ℃退火 30 s,35个循环,72 ℃ 延伸5 min在BIO-RAD Real-Time PCR仪上进行实时荧光定量PCR,按照2-△△Ct计算目的基因的相对表达量[7]。引物序列:lncRNA-TUG1正向引物为5′-GCGTCGTGTACTACTTCGTCG-3′,反向引物为5′-GCGTCGTTACCGAGACTGATT-3′;ICAM-1正向引物为5′-CCGGCATTTACTACTTCGTCG-3′,反向引物为5′-GCTGCTGTACCGAGACCAGCA-3′;VCAM-1正向引物为5′-GCGTCCAAATTTACTCGTCG-3′,反向引物为5′-CAGGGGGGTCCGAGGCAGCA-3′;GAPDH正向引物为5′-AACAGCGTCGGCTCAATATC-3′,反向引物为5′-GGAGTCTTCATGTAGTCTTCCA-3′。
1.9 Western Blot法检测主动脉p38MAPK信号通路p38总蛋白(T-p38)及其磷酸化蛋白(p-p38)相对表达量 收集血清进行处理48 h后的细胞,提取蛋白,采用二喹啉甲酸法(BCA)蛋白定量法,蛋白电泳、分离、转膜,室温下5%脱脂奶粉封闭2 h,用相应的一抗(T-p38及p-p38),分别按照1∶200和1∶500孵育,4 ℃过夜,洗涤后标记二抗(滴度1∶200)杂交,采用化学发光试剂盒检测[7],使用Image Lab 4.1图像分析软件检测T-p38及p-p38印迹条带净吸光度值,以β-actin为内参,结果以样本灰度值/内参照灰度值表示。

2 结 果
2.1 一般情况 动物造模鉴定时每组各处死1只小鼠,实验过程中因撕咬致死和灌胃致死6只,采用偏度-峰度检验法来判断离群值,剔除离群值,最后各组纳入统计的小鼠均为10只。
2.2 化痰祛瘀法中药对小鼠血脂的影响 模型组与lncRNA-TUG1拮抗剂组TC、TG、LDL-C和HDL-C水平比较,差异均无统计学意义(P>0.05);与模型组比较,化痰祛瘀法低剂量组和高剂量组TC、TG、LDL-C水平明显降低,HDL-C水平明显升高(P<0.05)。与lncRNA-TUG1拮抗剂组比较,化痰祛瘀法低剂量组和高剂量组TC、TG、LDL-C水平明显降低,HDL-C水平明显升高,差异均有统计学意义(P<0.05)。化痰祛瘀法低剂量组和高剂量组TC、TG、LDL-C和HDL-C水平比较,差异均无统计学意义(P>0.05)。详见图1。

与模型组比较,* P<0.05;与lncRNA-TUG1拮抗剂组比较,# P<0.05。图1 各组小鼠血脂水平比较(n=10)(A为模型组;B为lncRNA-TUG1拮抗剂组;C为化痰祛瘀法低剂量组;D为化痰祛瘀法高剂量组)
2.3 化痰祛瘀法中药对小鼠主动脉粥样硬化程度的影响 光学显微镜下发现,模型组小鼠主动脉的管径变小,管壁厚薄不均匀,内膜不光滑,管腔内可见明显的条状AS斑块形成,斑块内可见浅染无定形物和钙化颗粒物。lncRNA-TUG1拮抗剂组也可见较小AS斑块,但病灶表层纤维帽较薄,中膜平滑肌厚度均匀,AS斑块明显较模型组小。化痰祛瘀法低剂量、高剂量组小鼠主动脉管径厚薄虽然不均匀,但未发现明显AS斑块,主动脉各层结构清晰,动脉粥样硬化病变程度明显轻于模型组和lncRNA-TUG1拮抗剂组。详见图2。
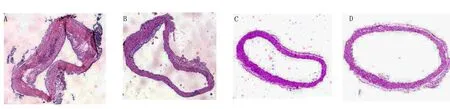
图2 各组小鼠主动脉病理形态观察(HE染色,×200)(A为模型组;B为lncRNA-TUG1拮抗剂组;C为化痰祛瘀法低剂量组;D为化痰祛瘀法高剂量组)
2.4 各组小鼠主动脉病理学检测指标比较 与模型组比较,lncRNA-TUG1拮抗剂组、化痰祛瘀法低剂量组、化痰祛瘀法高剂量组LA增大,IMT、PA、FS、CA、FCT减小,差异均有统计学意义(P<0.05);与lncRNA-TUG1拮抗剂组比较,化痰祛瘀法低剂量组和化痰祛瘀法高剂量组LA增大,IMT、PA、FS、CA、FCT减小,差异均有统计学意义(P<0.05)。化痰祛瘀法低剂量组和化痰祛瘀法高剂量组LA、IMT、PA、FS、CA、FCT比较,差异均无统计学意义(P>0.05)。详见表1。

表1 各组小鼠主动脉病理学检测指标比较(±s)
2.5 各组小鼠血清ICAM-1、VCAM-1、IL-8和MCP-1水平比较 与模型组比较,lncRNA-TUG1拮抗剂组、化痰祛瘀法低剂量组和化痰祛瘀法高剂量组小鼠外周血清ICAM-1、VCAM-1、IL-8和MCP-1水平明显降低(P<0.05);化痰祛瘀法低剂量组和化痰祛瘀法高剂量组小鼠外周血清ICAM-1、VCAM-1、IL-8和MCP-1水平比较,差异均无统计学意义(P>0.05)。表明化痰祛瘀法可能是通过调控lncRNA-TUG1降低细胞液中ICAM-1、VCAM-1、IL-8和MCP-1水平防治AS。详见图3。

与模型组比较,* P<0.05。图3 各组小鼠血清ICAM-1、VCAM-1、IL-8和MCP-1水平比较(n=10)(A为模型组;B为lncRNA-TUG1拮抗剂组;C为化痰祛瘀法低剂量组;D为化痰祛瘀法高剂量组)
2.6 化痰祛瘀法对主动脉lncRNA-TUG1、ICAM-1、VCAM-1 mRNA表达的影响 与模型组比较,lncRNA-TUG1拮抗剂组、化痰祛瘀法低剂量组和化痰祛瘀法高剂量组小鼠主动脉中lncRNA-TUG1、ICAM-1、VCAM-1 mRNA表达水平明显较低(P<0.05)。与lncRNA-TUG1拮抗剂组比较,化痰祛瘀法低剂量组和化痰祛瘀法高剂量组小鼠主动脉中lncRNA-TUG1、ICAM-1、VCAM-1 mRNA表达水平明显升高(P<0.05)。化痰祛瘀法低剂量组和化痰祛瘀法高剂量组小鼠主动脉中lncRNA-TUG1、ICAM-1、VCAM-1 mRNA表达水平比较,差异均无统计学意义(P>0.05)。表明化痰祛瘀法可能通过调控lncRNA-TUG1降低小鼠主动脉ICAM-1、VCAM-1 mRNA表达防治AS。详见图4。

与模型组比较,* P<0.05;与lncRNA-TUG1拮抗剂组比较,# P<0.05。图4 化痰祛瘀法对主动脉lncRNA-TUG1、ICAM-1、VCAM-1 mRNA表达的影响(n=10)(A为模型组;B为lncRNA-TUG1拮抗剂组;C为化痰祛瘀法低剂量组;D为化痰祛瘀法高剂量组)
2.7 化痰祛瘀法对小鼠主动脉T-p38、p-p38蛋白表达的影响 与模型组比较,lncRNA-TUG1拮抗剂组、化痰祛瘀法低剂量组和化痰祛瘀法高剂量组主动脉中T-p38、p-p38蛋白表达水平明显降低(P<0.05)。与lncRNA-TUG1拮抗剂组比较,化痰祛瘀法低剂量组和化痰祛瘀法高剂量组T-p38、p-p38蛋白表达水平明显升高(P<0.05)。化痰祛瘀法低剂量组和化痰祛瘀法高剂量组主动脉中T-p38、p-p38蛋白表达水平比较,差异均无统计学意义(P>0.05)。表明化痰祛瘀法可能通过调控lncRNA-TUG1降低主动脉T-p38、p-p38蛋白表达防治动脉AS。详见图5、图6。

与模型组比较,* P<0.05;与lncRNA-TUG1拮抗剂组比较,# P<0.05。图5 化痰祛瘀法对主动脉T-p38、p-p38蛋白表达的影响(n=10)(A为模型组;B为lncRNA-TUG1拮抗剂组;C为化痰祛瘀法低剂量组;D为化痰祛瘀法高剂量组)

图6 各组小鼠主动脉T-p38、p-p38蛋白表达条带图(A为模型组;B为lncRNA-TUG1拮抗剂组;C为化痰祛瘀法低剂量组;D为化痰祛瘀法高剂量组)
3 讨 论
炎症反应是引起血管内皮功能障碍的最常见危险因素,与TNF-α和白细胞介素-1(IL-1)的过表达有关[9]。多种因素刺激损伤内皮细胞,高表达ICAM-1、VCAM-1黏附分子以及IL-8和MCP-1等炎性因子,可引起更严重的内皮功能障碍,加剧血管炎症,导致AS的发生[2]。研究发现,有39个lncRNAs参与缺血性心脑血管疾病的发生,参与AS的病理过程,lncRNA-TUGl在血管内皮细胞中呈现高表达,而内皮细胞覆盖于全身血管的内膜,对维持血管通透性、抗血栓形成、防治AS具有重要的作用[10-11]。在血管内皮细胞中敲低TUGl表达能抑制TNF-α刺激下内皮细胞的凋亡,降低ICAM-1、VCAM-1和IL-8和MCP-1等表达水平,抑制p38 MAPK信号通路及其下游信号T-p38、p-p38表达[12],表明lncRNA-TUGl参与内皮细胞功能紊乱和AS的发生发展[3]。
AS属于中医学“脉痹”范畴,痰、瘀等病理产物壅塞脉道,沉积脉壁,痰瘀蓄留不去可形成“脉痹”。本课题组结合中医基础理论和临床实践,确定“痰瘀阻滞”是AS的主要证型,本研究所用化痰祛瘀法中药复方血管软化丸由保和丸加减化裁而成,该方中山楂消食积滞、活血化瘀,为君药;陈皮、半夏理气健脾、化痰散结;黄芪补气以推动血液运行;丹参、三七行气散结、活血化瘀,共为臣药,莱菔子理气消食,为佐药,诸药合用,共奏消积化痰、活血化瘀之功。本课题组既往研究发现,血管软化丸防治AS与调控PI3K/AKT/mTOR通路、TLR3/TLR9、miRNA-155、miRNA-181、miRNA-467b等信号通路有关[13-17]。本研究旨在观察化痰祛瘀法中药抗AS的作用机制是否与靶向调控lncRNA-TUG1抑制ICAM-1、VCAM-1表达,抑制p38 MAPK通路活化有关,进而揭示中医药防治AS的分子机制。
本研究结果发现,生化检测发现化痰祛瘀法低剂量组和高剂量组小鼠血清TC、TG和LDL-C水平均降低,HDL-C水平均升高;病理学检测结果发现化痰祛瘀法中药和lncRNA-TUG1拮抗剂均能够抑制AS的发生发展;lncRNA-TUG1拮抗剂组、化痰祛瘀法低剂量组和高剂量组小鼠外周血清中ICAM-1、VCAM-1、IL-8和MCP-1水平和主动脉中lncRNA-TUG1、ICAM-1、VCAM-1、T-p38、p-p38表达水平低于模型组,表明化痰祛瘀法可能通过调控lncRNA-TUG1降低小鼠主动脉中lncRNA-TUG1、ICAM-1、VCAM-1、T-p38、p-p38表达及血清中ICAM-1、VCAM-1、IL-8和MCP-1水平。
综上所述,化痰祛瘀法防治AS的分子机制可能与靶向调控lncRNA-TUG1抑制p38MAPK信号通路的活化及其下游信号T-p38、p-p38表达,抑制炎性反应、调控血脂、保护血管内皮损伤有关。

