METTL3介导的m6A甲基化修饰经Notch通路调控血管内皮细胞生物学活性
唐 韵,陈 思,叶 巍,王文喆,高 颖,葛轶睿,黄振平
0 引言
年龄相关性黄斑变性(age-related macular degeneration, ARMD)是一种视网膜慢性退行性疾病,其病变主要发生在黄斑区,是55岁以上人群常见的致盲性眼病[1]。ARMD的全球患病率约为8.7%,预计2040年全球患病人数将达到2.88亿[2]。其主要临床表现为视物变形、视野中央暗点,严重者出现不可逆性视力丧失[3]。早期和中期ARMD表现为黄斑区的玻璃膜疣和色素异常,晚期ARMD表现为新生血管和地图状萎缩[4]。晚期ARMD与严重的中心视力丧失有关,其中未经治疗的新生血管性ARMD导致超过90%的患者失明[5]。新生血管性ARMD主要由脉络膜新生血管(choroidal neovascularization, CNV)引起。早期ARMD的特征是脂质和蛋白质沉积于Bruch膜形成玻璃膜疣,在黄斑区氧化应激环境下形成氧化磷脂[6],与动脉粥样硬化沉积物的组成相似[7],可促进炎症因子和血管内皮生长因子(vascular endothelial growth factor, VEGF)的分泌,诱导CNV形成[8]。且在病理状态下,脉络膜血流灌注受损[9],缺血和缺氧诱导VEGF上调,促进CNV形成。目前抗VEGF治疗是延缓疾病进展的主要手段[10],但价格昂贵,需要频繁治疗,且不能完全治愈疾病。因此,为了降低成本且进一步提高治疗效果,新的药物仍在研究中。在多种缺氧、炎症、代谢障碍引起的微血管病变中,N6-甲基腺苷(N6-methyladenosine, m6A)甲基化修饰发挥着关键作用[11]。m6A甲基化修饰是真核生物RNA中最普遍的表观遗传修饰,由甲基转移酶复合物、去甲基化酶和结合蛋白动态调控,它影响RNA剪接、翻译和稳定性以及某些非编码RNA的表观遗传效应[12]。m6A甲基化修饰对血管发育和血管内皮细胞的正常功能至关重要[13]。甲基转移酶3(methyltransferase-like 3, METTL3)是m6A甲基化最关键的甲基转移酶之一[14],它的缺失或过表达会改变m6A的总甲基化水平,在多种疾病发生发展过程中发挥重要作用。METTL3介导的m6A修饰促进动脉粥样硬化的发展[15],在胃癌、结直肠癌等肿瘤进展中促进血管生成[16-17],参与糖尿病视网膜病变中视网膜血管并发症的发生[18],但其在CNV发病过程中的机制尚不明确。因此,本文旨在探索METTL3介导的m6A甲基化修饰在CNV发病中对血管内皮细胞生物学活性的调控作用及机制。
1 材料和方法
1.1 材料
1.1.1 细胞株人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC)、猴视网膜-脉络膜内皮细胞(RF/6A)购自美国ATCC。
1.1.2 主要试剂胎牛血清购自美国ScienCell;DMEM高糖、低糖培养基购自上海中乔新舟生物科技有限公司;青霉素/链霉素溶液、胰酶购自苏州新赛美生物科技有限公司;荧光标记的低密度脂蛋白(Dil-LDL)、荧光标记的氧化低密度脂蛋白(Dil-ox-LDL)、低密度脂蛋白(LDL)、氧化低密度脂蛋白(ox-LDL)购自广州奕源生物科技有限公司;STM2457、DAPT(溶于DMSO)、DMSO购自美国MCE公司;m6A抗体(68055-1-Ig)、METTL3抗体(15073-1-AP)、VEGF抗体(19003-1-AP)、α-SMA抗体(67735-1-Ig)、VE-Cadherin抗体(66804-1-Ig)、GAPDH抗体(10494-1-AP)、HRP标记山羊抗兔IgG(SA00001-2)、HRP标记山羊抗鼠IgG(SA00001-1)、594标记山羊抗兔IgG(SA00013-4)购自武汉三鹰生物技术有限公司;DAPI、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒购自上海碧云天生物技术有限公司;Trizol试剂购自美国Thermo Fisher Scientific;Evo M-MLV反转录预混型试剂盒、SYBR Green Premix Pro Taq HS qPCR Kit(Rox Plus)购自湖南艾科瑞生物工程有限公司;transwell小室、Matrigel胶购自美国Corning;结晶紫溶液购自美国SigmaAldrich。
1.2 方法
1.2.1 细胞培养和分组HUVEC细胞用10%胎牛血清、1%青霉素/链霉素的DMEM高糖培养基,RF/6A细胞用10%胎牛血清、1%青霉素/链霉素的DMEM低糖培养基,均在37℃、5% CO2条件下培养。检测HUVEC细胞内吞脂蛋白水平的实验中,将细胞分为以下4组培养6h:对照组(Control组,正常培养),Dil-LDL组(12.5μg/mL Dil-LDL),12.5μg/mL Dil-ox-LDL组,25μg/mL Dil-ox-LDL组。检测ox-LDL处理对HUVEC细胞METTL3表达水平及血管形成影响的实验中,将细胞分为以下4组培养24h:对照组;LDL组;12.5μg/mL ox-LDL组;25μg/mL ox-LDL组。检测抑制METTL3对HUVEC细胞血管形成、对Notch通路影响的实验中,将细胞分为以下4组培养24h:对照组;12.5μg/mL ox-LDL组;DMSO组,细胞培养基中同时加入12.5μg/mL ox-LDL和0.1% DMSO处理;STM2457组,细胞培养基中同时加入12.5μg/mL ox-LDL和5μmol/L METTL3抑制剂STM2457处理。检测抑制Notch通路对血管形成影响的实验中,将HUVEC及RF/6A细胞各分为以下4组培养24h:对照组;12.5μg/mL ox-LDL组;DMSO组,细胞培养基中同时加入12.5μg/mL ox-LDL和0.1% DMSO处理;DAPT组,细胞培养基中同时加入12.5μg/mL ox-LDL和5μmol/L Notch通路抑制剂DAPT。
1.2.2 激光共聚焦显微镜观察细胞吞脂水平无菌条件下,将Dil-LDL和Dil-ox-LDL用细胞培养基稀释至目标浓度加入活细胞培养皿内,37℃培养3~6h。吸去培养基,并用无探针的培养基清洗3次,激光共聚焦显微镜下观察。
1.2.3 免疫荧光检测METTL3蛋白表达量细胞经PBS洗涤、4%多聚甲醛固定、0.5% Triton X-100通透后,1% BSA室温下封闭30min,METTL3一抗(1∶100稀释)4℃孵育过夜。PBS洗涤后荧光二抗标记山羊抗兔IgG(按1∶200稀释)避光室温孵育1h。经PBS洗涤后,DAPI(1∶1000稀释)室温孵育15min。激光共聚焦显微镜下观察。
1.2.4Dotblot检测m6A甲基化水平使用Trizol法提取HUVEC中的总RNA。分光光度计测定RNA浓度。取2μL RNA样品按顺序滴在NC膜上,紫外灯照30min。TBST洗涤后5%脱脂牛奶封闭1h,m6A抗体(1∶1000稀释)4℃孵育过夜。TBST洗涤3次,二抗HRP标记山羊抗兔IgG(按1∶10000稀释)室温孵育1h。TBST洗涤3次,ECL化学发光法显影检测,亚甲蓝染色30min清洗后拍照。通过Image J软件测量每个点的相对信号密度。
1.2.5RT-qPCR检测mRNA水平使用Trizol法提取HUVEC中的总RNA。按照Evo M-MLV反转录预混型试剂盒说明书反转录合成cDNA。RT-qPCR[SYBR Green Premix Pro Taq HS qPCR Kit (Rox Plus)]检测靶基因的mRNA水平。反应条件参照试剂盒说明书。ACTB作为内参基因,使用2-ΔΔCt公式计算靶基因的相对表达量。基因引物序列见表1。

表1 基因引物序列
1.2.6Westernblot检测蛋白水平提取各组细胞中的总蛋白,采用BCA蛋白浓度测定试剂盒对蛋白进行定量。SDS-PAGE凝胶分离蛋白,转移至PVDF膜,5%脱脂牛奶封闭1h。一抗METTL3、VEGF、α-SMA、VE-Cadherin及GAPDH(均按1∶1000稀释)4℃孵育过夜,TBST洗涤3次,二抗HRP标记山羊抗兔IgG及HRP标记山羊抗鼠IgG(均按1∶10000稀释)室温孵育1h。ECL化学发光法显影检测,Image J分析条带灰度值。
1.2.7Transwell实验检测细胞迁移能力将无血清培养基中的HUVEC细胞(5×104个)植入每个24孔板中transwell小室的上室,并将培养基加入下室。培养24h后用4%多聚甲醛固定,结晶紫溶液染色,显微镜成像。在5个随机视野检测迁移细胞的平均数量。
1.2.8 体外成管实验检测细胞血管形成能力96孔板每孔加入50μL Matrigel胶,凝固后每孔加入1×104个HUVEC细胞。5% CO2、37℃孵箱内孵育6h,显微镜下观察管状结构,拍照记录并通过总管长评估细胞成管能力。使用Image-Pro Plus软件测量管的总长度。每组细胞接种3个复孔,结果取平均值。
统计学分析:采用GraphPad Prism 9.0软件进行绘图,SPSS 21软件进行数据分析,结果以均数±标准差表示。两组间差异比较采用独立样本t检验,采用单因素方差分析比较多组间差异,多组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1HUVEC细胞内吞脂蛋白与对照组相比,Dil-LDL组、12.5μg/mL、25μg/mL Dil-ox-LDL组HUVEC细胞内的荧光标记的脂蛋白含量显著增加,见图1,提示脂蛋白能够进入HUVEC细胞。

图1 激光共聚焦显微镜观察HUVEC内吞脂蛋白结果 红色荧光为吞噬的Dil-LDL、Dil-ox-LDL;DIC图像为明场图像;MERGE图像为共定位。
2.2ox-LDL处理的HUVEC细胞METTL3表达水平及细胞迁移和血管形成能力升高与对照组相比,12.5μg/mL、25μg/mL ox-LDL组HUVEC总RNA整体m6A水平显著升高(P<0.05、P<0.01),见图2A、B;12.5μg/mL ox-LDL组METTL3 mRNA表达水平显著上调(P<0.05),见图2C;METTL3蛋白表达水平显著上调(均P<0.01),见图2D、E;免疫荧光检测METTL3表达水平升高且定位于细胞核内,见图2F;12.5μg/mL ox-LDL组、25μg/mL ox-LDL组细胞迁移能力和血管形成能力显著升高(均P<0.01),见图2G、H。与对照组相比,LDL组HUVEC总RNA整体m6A水平、METTL3表达水平、细胞迁移和血管形成能力均无显著性差异(P>0.05)。提示ox-LDL刺激使HUVEC细胞m6A甲基化水平升高,METTL3表达水平上调,促进血管形成。12.5μg/mL ox-LDL用于后续实验。
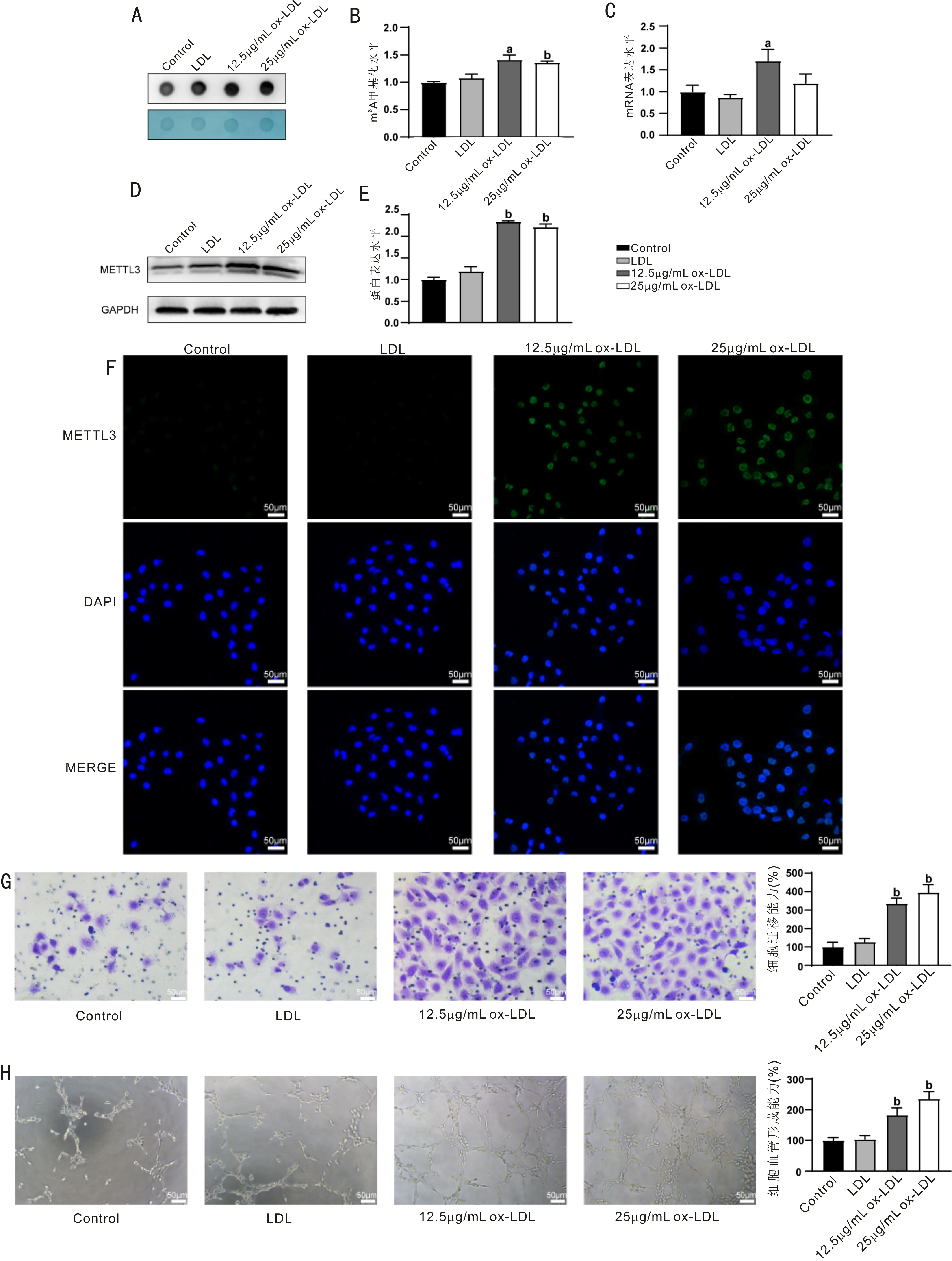
图2 ox-LDL处理的HUVEC细胞METTL3表达水平及细胞迁移和血管形成能力升高 A:Dot blot检测m6A甲基化水平;B:Dot blot结果统计图;C:RT-qPCR检测METTL3 mRNA表达水平;D:Western blot检测METTL3蛋白表达水平;E:Western blot结果统计图;F:免疫荧光检测METTL3的蛋白表达水平及细胞内定位;绿色荧光为METTL3;蓝色荧光为DAPI染细胞核;MERGE图像为共定位;G:Transwell实验检测细胞迁移能力;H:体外成管实验检测细胞血管形成能力。aP<0.05,bP<0.01 vs 对照组。
2.3METTL3抑制剂使经ox-LDL处理的HUVEC细胞的VEGF、α-SMA、VE-Cadherin表达水平及细胞迁移和血管形成能力下降与DMSO组相比,STM2457组总RNA整体m6A水平显著下降(P<0.05),见图3A、B;METTL3的蛋白及mRNA表达水平无显著差异(均P>0.05),VEGF、α-SMA、VE-Cadherin等与血管生成相关标志物蛋白表达水平显著下降(均P<0.01),mRNA表达水平显著下调(均P<0.05,P<0.05,P<0.01),见图3C~E;细胞迁移能力和血管形成能力显著降低(均P<0.01),见图3F、G;ox-LDL组总RNA整体m6A水平,METTL3、VEGF、α-SMA、VE-Cadherin的蛋白及mRNA表达水平,细胞迁移能力和血管形成能力均无显著差异(P>0.05)。与对照组相比,ox-LDL组METTL3蛋白及mRNA表达水平均显著升高(P<0.05,P<0.01)。这提示STM2457能有效抑制经ox-LDL处理的HUVEC细胞的m6A水平和血管生成能力,但不影响METTL3的表达,且溶剂DMSO对实验结果无显著影响。
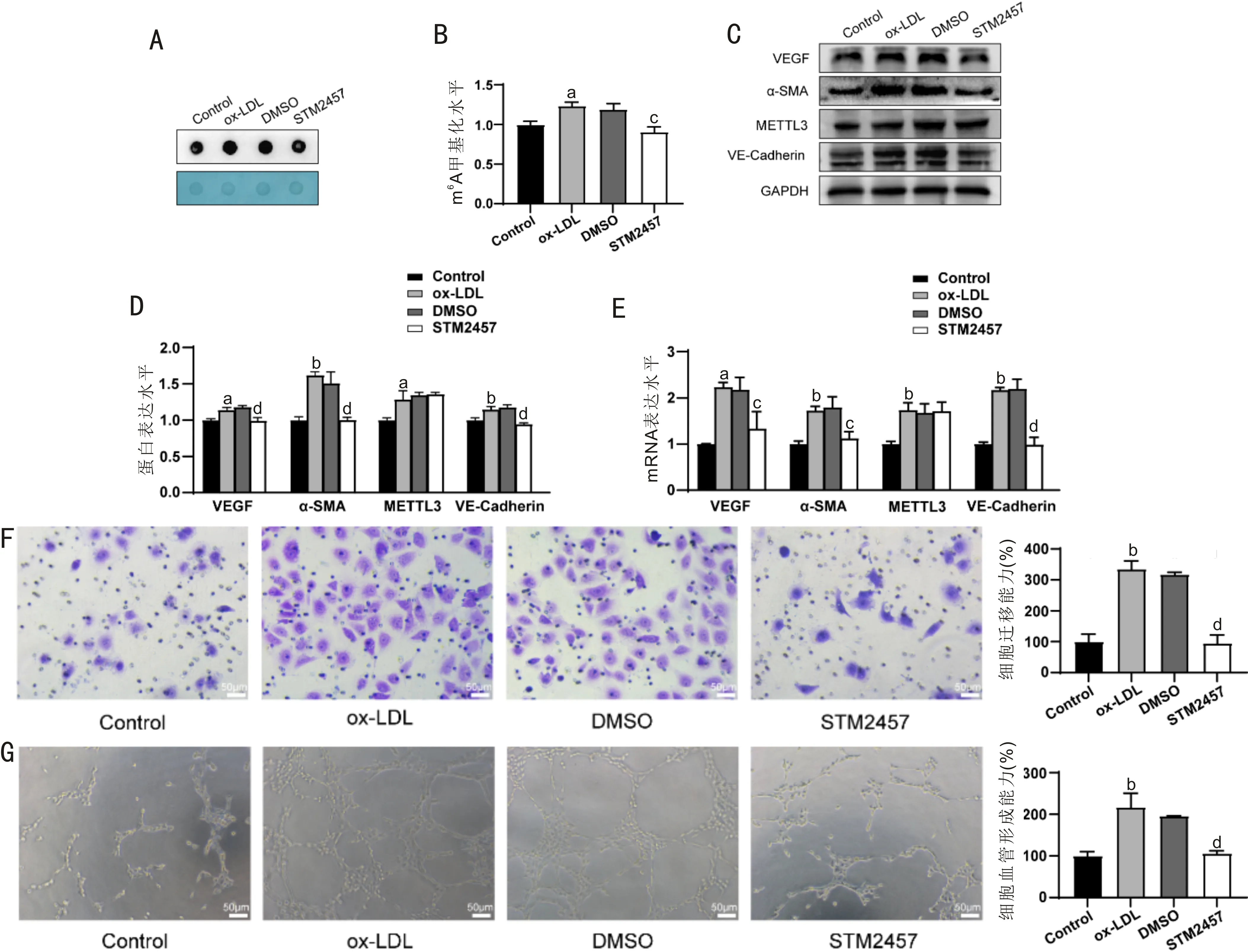
图3 抑制METTL3使经 ox-LDL处理的HUVEC细胞的VEGF、α-SMA、VE-Cadherin表达水平及细胞迁移、血管形成能力下降 A:Dot blot检测m6A甲基化水平;B:Dot blot结果统计图;C:Western blot检测VEGF、α-SMA、METTL3、VE-Cadherin蛋白表达水平;D:Western blot结果统计图;E:RT-qPCR检测VEGF、α-SMA、METTL3、VE-Cadherin mRNA表达水平;F:Transwell实验检测细胞迁移能力;G:体外成管实验检测细胞血管形成能力。aP<0.05,bP<0.01 vs 对照组;cP<0.05,dP<0.01 vs DMSO组。
2.4 抑制Notch通路使VEGF和NICD表达水平及细胞迁移与血管形成能力下降与DMSO组相比,STM2457组NICD蛋白表达水平显著下降(P<0.05),见图4A、B。VEGFmRNA表达水平显著下调(P<0.01),见图4C;与DMSO组相比,DAPT组VEGF及NICD蛋白表达水平显著下降(P<0.05,P<0.01),见图4D、E;HUVEC细胞迁移能力和血管形成能力显著降低(均P<0.01),见图4F、G;RF/6A细胞迁移能力和血管形成能力显著降低(均P<0.01),见图4H、I;ox-LDL组VEGF及NICD蛋白水平、HUVEC及RF/6A细胞迁移和血管形成能力均无显著性差异(P>0.05)。与对照组相比,ox-LDL组VEGF、NICD表达量均显著升高(均P<0.05)。这提示DAPT能有效抑制经ox-LDL处理的HUVEC细胞VEGF表达、HUVEC及RF/6A细胞血管生成能力,且溶剂DMSO对实验结果无显著影响。
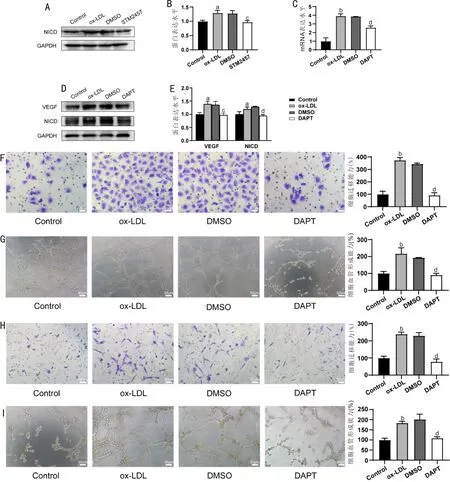
图4 抑制METTL3使HUVEC细胞Notch通路受抑制,抑制Notch通路使HUVEC细胞VEGF、NICD表达水平及HUVEC与RF/6A细胞迁移、血管形成能力下降 A:Western blot检测NICD蛋白表达水平;B:Western blot结果统计图;C:RT-qPCR检测VEGF mRNA表达水平;D:Western blot检测VEGF、NICD蛋白表达水平;E:Western blot结果统计图;F:Transwell实验检测HUVEC细胞迁移能力;G:体外成管实验检测HUVEC细胞血管形成能力;H:Transwell实验检测RF/6A细胞迁移能力;I:体外成管实验检测RF/6A细胞血管形成能力。aP<0.05,bP<0.01 vs 对照组;cP<0.05,dP<0.01 vs DMSO组。
3 讨论
在本研究中,我们发现HUVEC细胞可内吞LDL和ox-LDL,但仅ox-LDL刺激可使HUVEC细胞m6A甲基化水平升高,METTL3表达水平上调,对血管形成有促进作用。使用METTL3抑制剂使m6A甲基化水平下降,VEGF、α-SMA、VE-Cadherin等血管形成相关标志物[19-20]表达下降,对血管形成有抑制作用。这表明METTL3的表达水平可以显著影响血管内皮细胞的血管生成,METTL3的升高可能促进CNV病变的发生发展。Dong等[21]研究发现,METTL3在ox-LDL诱导的HUVEC中高表达,METTL3的敲除抑制了ox-LDL处理的HUVEC细胞增殖、迁移、血管的形成和VEGF的表达与分泌,阻碍了体内的动脉粥样硬化过程,并阻止了正在发育的胚胎的体内血管生成。Chamorro-Jorganes等[22]研究表明,METTL3维持m6A RNA水平并提高内皮细胞的血管生成能力。Yao等[23]研究显示,增强的m6A甲基化修饰有助于病理性血管生成,METTL3沉默减少了内皮细胞的异常增殖、迁移和血管形成,在角膜新生血管模型中发挥抗血管生成作用。Jiang等[24]研究证明,在CNV模型中METTL3沉默导致CNV面积减少。STM2457是一种具有高度特异性的METTL3催化抑制剂,它通过直接结合METTL3的S-腺苷甲硫氨酸结合位点抑制其甲基转移酶活性,但并不破坏其结构[25]。STM2457使m6A水平显著下降,但对METTL3蛋白及RNA表达水平无显著影响。因此,我们认为RNA的m6A水平与METTL3的表达量不完全相关,主要与METTL3和mRNA的结合量密切相关。
m6A高甲基化mRNA的相关通路分析中显示,Notch信号是METTL3调控的首要信号[24]。Han等[26]研究报道,METTL3介导的m6A修饰通过调控Notch信号通路促进癌症的进展。Lv等[27]研究显示,内皮特异性m6A通过Notch信号调节小鼠造血干细胞和祖细胞发育。因此,我们选择探索在CNV形成中METTL3对Notch通路是否具有调控作用。Notch通路是一种进化保守的细胞间信号通路,在血管系统中主要分布于动脉血管的内皮细胞和平滑肌细胞中[28],在生理性和病理性血管生成中均发挥重要作用[29]。在本研究中,ox-LDL刺激HUVEC细胞METTL3升高的同时Notch胞内结构域(Notch intracellular domain, NICD)蛋白表达升高,使用METTL3抑制剂使NICD蛋白表达下降,这表明METTL3可能通过调控Notch通路影响血管内皮细胞的血管形成。DAPT是一种γ-分泌酶抑制剂,通过阻止γ-分泌酶的裂解抑制NICD蛋白的形成,从而有效地阻断Notch信号通路[30]。本研究发现,使用DAPT抑制Notch通路使NICD表达下降,导致VEGF表达下降,对血管形成有抑制作用,这说明Notch通路在CNV病变中可能有促进血管形成的作用。Dong等[31]研究发现,在缺氧诱导的CNV模型中,Notch家族配体中的Delta-like ligand 4(Dll4)可能参与HIF-1α-VEGF通路调控CNV血管生成,Notch信号促进了CNV血管生成的过程。这与我们的研究结果一致。
综上所述,在ox-LDL处理的细胞中m6A甲基化修饰水平升高,METTL3表达上调,抑制METTL3对mRNA的m6A甲基化修饰能够减少ox-LDL诱导的血管生成,METTL3通过Notch通路在CNV病变中促进血管内皮细胞的血管形成。本研究为阐明CNV发病的分子机制提供了新的证据,METTL3介导的m6A甲基化修饰或许能作为临床防治CNV的重要靶点。但本研究存在一定的局限性:所涉及实验均为离体实验,缺乏在体实验的验证,后续需进一步探索在体实验中METTL3介导的m6A甲基化修饰在CNV发病中的作用。

