抗VEGF辅助治疗增殖性糖尿病视网膜病变对眼内炎症因子水平的影响
罗金秀,胡仔仲,刘庆淮,方 圆
0 引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的主要并发症之一。目前,全球约4.63亿成年人患有糖尿病[1],而DR总体患病率接近糖尿病患病人群的35%[2]。DR早期阶段为非增殖性糖尿病视网膜病变(non-proliferative diabetic retinopathy,NPDR),以眼底微动脉瘤为主要特征,继而发展为增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)。PDR的主要特征为眼底硬性及软性渗出、新生血管和出血[3]。其中持续性玻璃体出血、广泛性纤维血管增生或牵拉性视网膜脱离是玻璃体切除术(pars-plana vitrectomy,PPV)的适应证。
高血糖代谢作用导致视网膜微血管损伤,引起血管通透性增加,视网膜缺血缺氧,促血管生成和炎症因子随之上调,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素、肝细胞生长因子、肿瘤坏死因子(tumor necrosis factor,TNF)和白细胞介素(interleukin,IL)-6等[4]。其中VEGF作为PDR的主要血管生成因子,其水平已被证明与PPV手术难度[5]以及PPV术后早期[6]或晚期玻璃体积血[7]的复发有关。抗VEGF治疗可有效降低玻璃体腔VEGF水平,减少视网膜血管渗漏,促进新生血管消退,从而减少PPV术中出血风险,降低手术难度,有利于手术预后[8]。炎症与视网膜新生血管亦密切相关。炎症细胞在高糖环境中分泌生长因子、细胞因子及蛋白酶等,以介导新生血管形成[9]。激活的内皮细胞表达促炎因子,介导激活白细胞[10-11]。促炎细胞因子包括IL-6、IL-1α、IL-1β、TNF-α等可通过作用于内皮细胞直接激活血管生成,还可通过激活白细胞和内皮细胞产生更多的促血管生成因子间接促进血管生成。此外,PDR患者玻璃体中促炎细胞因子和趋化因子浓度显著升高[12]。研究表明,PPV术前联合抗VEGF注射后,眼内血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)水平显著快速下降[13]。然而,随着VEGF-A水平的下降和新生血管的退化,炎症因子在眼微环境中的变化仍不清楚。既往研究通常检测抗VEGF治疗后数周或数月眼内炎症因子的变化,但研究结果仍存在争议[14-17]。本研究通过检测玻璃体液炎症因子水平,探讨PPV术前联合玻璃体腔注射康柏西普(intravitreal injection of Conbercept, IVC)早期对视网膜炎症状态的作用,为临床治疗提供依据。
1 对象和方法
1.1 对象前瞻性随机对照研究。收集2017-06/2018-01于南京医科大学第一附属医院眼科就诊并确诊的PDR患者49例49眼为研究对象,随机分为两组,no-IVC组患者25例25眼PPV术前未接受玻璃体腔注射治疗,IVC组患者24例24眼PPV术前接受玻璃体腔注射康柏西普治疗。纳入标准:(1)年龄18岁以上;(2)根据2014年中华医学会眼科学分会眼底病学组提出的DR分期方法[18]确诊为PDR(Ⅳ~Ⅴ期);(3)符合PPV和玻璃体腔注射康柏西普治疗适应证。排除标准:(1)既往有内眼手术史;(2)合并其他玻璃体视网膜疾病或合并眼前节新生血管;(3)临床资料不全者。本研究遵循《赫尔辛基宣言》,符合医学伦理学原则并获得南京医科大学第一附属医院医学伦理委员会批准(No.2017-SR-283)。所有患者均对本研究知情同意并签署知情同意书。
1.2 方法
1.2.1 手术方法IVC组患者于PPV术前5~7d接受玻璃体腔注射康柏西普治疗(其中PPV术前5、6、7d接受玻璃体腔注射治疗者均为8例8眼)。IVC手术方法:常规内眼手术消毒铺单,表面麻醉后,将27G 1mL一次性无菌注射器于颞上方角巩膜缘后4mm处穿刺入玻璃体腔注射康柏西普0.5mg/0.05mL(成都康弘生物科技有限公司,10mg/mL),拔出注射器后用棉签按压30~60s,观察有无出血、切口渗漏,注药后予左氧氟沙星滴眼液预防感染。PPV手术方法:由同一名资深眼科医生完成所有患者的PPV手术。常规距角膜缘3.5~4.0mm扁平部行三通道23G穿刺,颞下方穿刺套管放置灌注。行23G闭合式后入路全玻璃体切除,如果出血则采用玻切头压迫、提高灌注压、眼内电凝等方法, 对未处理的视网膜区域进行激光光凝,以完成全视网膜光凝。如果出现视网膜裂孔,选择硅油行眼内填充,无视网膜裂孔则灌注液填充。术闭,可吸收缝线缝合巩膜切口。
1.2.2 玻璃体液收集及细胞因子检测纳入患者均于PPV手术开始时,即眼内灌注开始前用玻璃体切割器收集0.5~0.8mL未稀释的玻璃体液样本。将样品收集至无菌试管中,立即置于冰上,离心(4℃,1500r/min,5min)以去除细胞和碎片,然后于-80℃保存备用。本研究检测的细胞因子包括VEGF-A和炎症相关细胞因子IL-1β、IL-2、IL-4、IL-6、IL-8、IL-10、IL-12、IL-13、IL-17A、IL-18、TNF-α、单核细胞趋化因子(monocyte chemotactic protein-1,MCP-1)。利用Luminex液相悬浮芯片技术,在Wayen生物技术公司(上海)的协助下完成以上细胞因子水平的检测。所有步骤严格按照产品说明书操作,在96孔微孔板每孔上加50μL玻璃体液样品或标准品,室温孵育后用稀释后的生物素抗体与样品孵育,加入PE标记的链霉亲和素进一步孵育,再加入洗涤缓冲液,最后将平板送入Bio-Plex MAGPIX系统读值。

2 结果
2.1 两组患者基线资料比较no-IVC组和IVC组患者年龄、性别构成、PDR类型、视力下降持续时间、糖尿病病程、术前视力、糖化血红蛋白(HbA1c)水平和既往行全视网膜激光光凝情况比较,差异均无统计学意义(P>0.05),见表1。
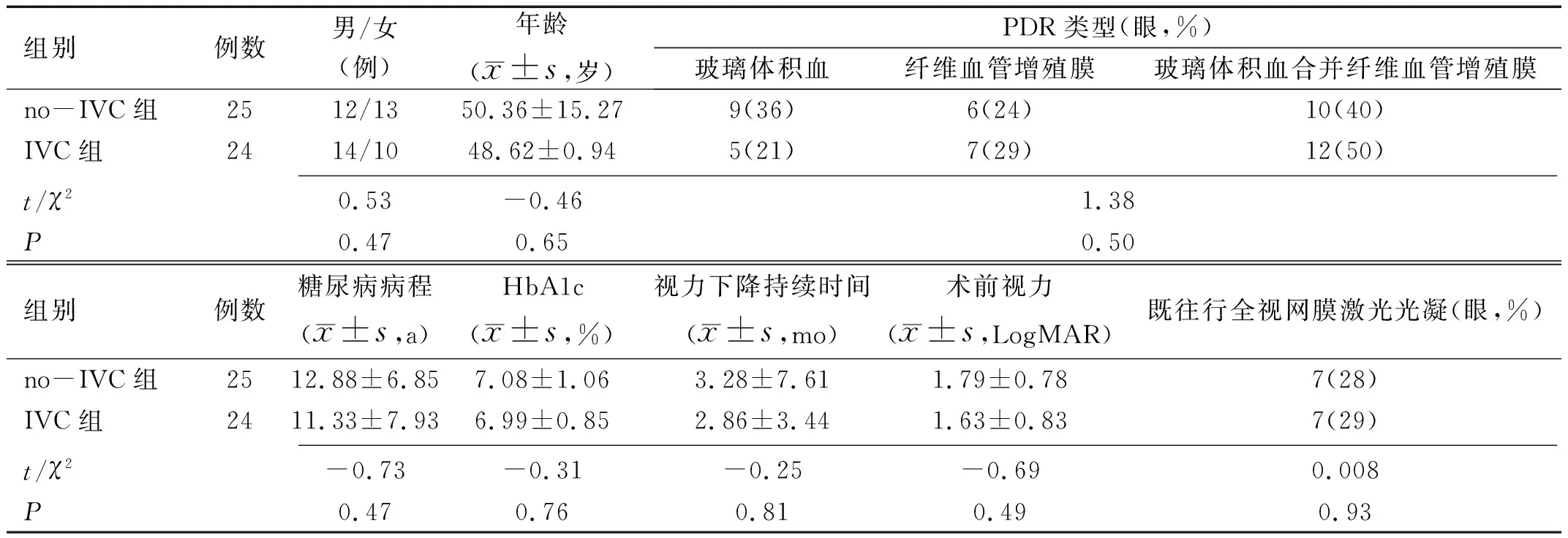
表1 两组患者基线资料比较
2.2 两组患者玻璃体液细胞因子水平比较与no-IVC组相比,IVC组患者玻璃体液中VEGF-A水平显著降低(P<0.001),炎症细胞因子IL-6(P=0.004)、IL-8(P=0.002)、IL-18(P=0.04)、TNF-α(P=0.03)水平显著升高,见表2。IVC组康柏西普注射后5、6、7d的患者玻璃体液中炎症细胞因子水平差异均无统计学意义(P>0.05),见表3。

表2 纳入患者玻璃体液中细胞因子水平比较 pg/mL
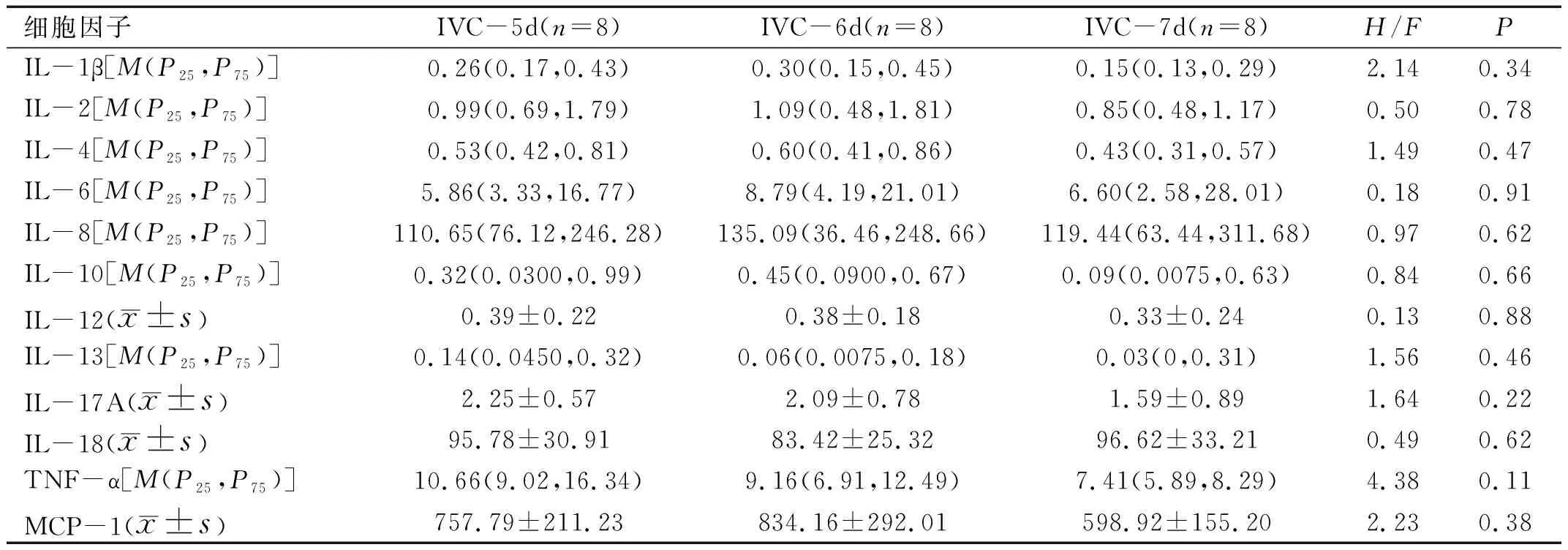
表3 IVC组康柏西普注射后5~7d患者玻璃体液中细胞因子水平比较 pg/mL
3 讨论
康柏西普是VEGF受体与人免疫球蛋白Fc段基因重组的融合蛋白,对VEGF-A、VEGF-B及胎盘生长因子(PIGF)具有高度亲和力,竞争性抑制VEGF与其受体结合,从而抑制内皮细胞增殖及新生血管生成[19]。PPV治疗PDR术前抗VEGF治疗的目的是诱导视网膜新生血管消退,减少术中出血,使纤维血管膜更易被剥离,减少医源性视网膜裂孔,使PPV手术更顺利[20]。本研究发现,玻璃体腔注射康柏西普后玻璃体液中VEGF-A水平快速下降,但抗VEGF治疗早期对多数炎症细胞因子的表达影响甚微。
在DR中,视网膜缺血缺氧通过激活缺氧诱导因子1(HIF-1)诱导VEGF表达上调[21]。糖尿病患者外周血中磷脂酶A2(PLA2)升高也会引起VEGF表达上调[22]。VEGF通过诱导细胞间紧密连接蛋白磷酸化,增加毛细血管通透性[23]。VEGF激活VEGFR-1和VEGFR-2两种酪氨酸激酶受体,刺激内皮细胞增殖、迁移,促进新生血管形成[24]。这些血管分布不规则,血管结构不良,易发生渗漏,导致视网膜内液体积聚。血管渗漏增加是糖尿病性黄斑水肿(diabetic macular edema,DME)的严重危险因素。因此,抗VEGF治疗已成为DME的一线治疗方案[25]。尽管如此,仍有部分DME患者对抗VEGF治疗反应不佳,这也说明除VEGF外还有其他机制参与DR及DME的发生发展。慢性低度炎症被证实存在于DR的各个阶段[26]。炎症细胞因子IL-1β、IL-6、IL-8、IL-17A和TNF-α水平与DR的严重程度和预后相关[27]。PDR患者玻璃体中炎症细胞因子IL-6、IL-17A和TNF-α等水平显著升高,诱导白细胞的活化和迁移,并引起白细胞淤积,进而导致毛细血管闭塞、视网膜缺氧和内皮细胞损伤[28]。上调的TNF-α导致细胞间黏附分子1(ICAM-1)介导的内皮细胞黏附和内皮功能障碍,增加血-视网膜屏障的渗透性,加速DME的发生发展[29]。此外,炎症因子高表达亦能促进VEGF表达。高血糖介导IL-17A表达,促进视网膜炎症及血管通透性增高,同时还能增强VEGF表达,间接促进视网膜血管增殖和新生血管形成[30]。
VEGFR-1主要由单核细胞和巨噬细胞表达,参与白细胞在炎症部位的募集[24]。VEGFR-2仅在内皮细胞中表达。VEGF与VEGFR-2的结合启动信号传导,不仅增加血管通透性,而且通过核因子活化B细胞κ轻链增强子(NF-κB)上调炎症细胞因子(如MCP-1、ICAM-1)的表达[31-32]。在DME中,可溶性VEGFR-2的水平与IL和MCP-1等炎症因子的水平显著相关,这些炎症因子诱导白细胞趋化,促进炎症细胞黏附到血管内皮,导致血管通透性进一步增加[33]。因此,VEGF与血管内皮细胞、单核细胞和巨噬细胞上的受体结合进一步促进黄斑水肿。VEGF对炎症细胞具有趋化性[34],VEGF除了增加血管通透性外,还可能促进炎症。Yoshimura等[35]研究发现PDR患者玻璃体中VEGF、MCP-1、IL-8、IL-6水平显著升高,且VEGF水平与MCP-1、IL-8、IL-6水平呈正相关。此外,抑制Müller细胞来源的VEGF可显著降低糖尿病小鼠TNF-α、ICAM-1和NF-κB的表达[36]。
抗VEGF治疗抑制VEGFR-1和VEGFR-2的信号传导,是否能够抑制炎症因子,下调眼内炎症因子水平有待进一步研究。本研究主要观察康柏西普注射5~7d后,即抗VEGF治疗早期玻璃体液中细胞因子的变化。结果发现,玻璃体腔注射康柏西普5~7d后,玻璃体液中IL-6、IL-8、IL-18及TNF-α水平显著增高,其余炎症因子(IL-1β、IL-2、IL-4、IL-10、IL-12、IL-13、IL-17A和MCP-1)水平无显著变化。康柏西普特异性结合VEGF-A,竞争性抑制VEGF与其受体结合,但在治疗早期对炎症细胞因子水平无明显抑制作用。IL-18作为促炎细胞因子,最初被描述为干扰素-γ诱导因子,表达于活化的自然杀伤(natural killer,NK)细胞、T淋巴细胞、上皮细胞等[37]。VEGF与IL-18相互抑制[38]。随着DR病程的进展,血清IL-18水平呈逐渐下降趋势,对VEGF抑制作用减弱,导致血管内皮细胞增生,新生血管形成。本研究发现康柏西普抑制VEGF表达,玻璃体液中IL-18水平升高。这与视网膜新生血管模型中,VEGF和IL-18水平呈负相关的观察结果一致[39]。既往研究发现注射雷珠单抗7d后玻璃体内IL-6、IL-8水平显著升高[40],玻璃体内注射贝伐单抗3~7d后房水中IL-8水平显著升高,IL-6及MCP-1水平高于治疗前,但差异均无统计学意义[41]。相似地,本研究发现玻璃体腔注射康柏西普5~7d,玻璃体液中IL-6及IL-8水平较未注药组显著升高。IL-6作为一种多功能促炎因子,广泛作用于炎症的各级反应,可以诱导炎症急性期反应,增加血管通透性[42]。慢性高糖刺激可显著促进缺血的视网膜、血管内皮细胞及平滑肌细胞分泌IL-6[42],这可能是本研究中应用康柏西普抑制VEGF表达后,IL-6水平升高的原因之一。IL-8则是由缺血视网膜的内皮细胞和胶质细胞产生的促炎和血管生成细胞因子[43],其分泌受IL-6调节,并进一步加重炎症反应[44]。IL-6及 IL-8眼内水平均与黄斑水肿的严重程度相关[45-46]。此外,Roh等[47]研究发现抗VEGF治疗DME后,DME复发与房水中IL-6升高有关,而与VEGF无关,这可能也是部分DME患者抗VEGF治疗后应答不佳的原因之一。TNF-α作为非糖基化蛋白,由单核细胞、巨噬细胞等多种炎症细胞合成和分泌,可促进淋巴细胞增生,趋化并活化中性粒细胞和单核细胞释放炎性介质,诱发炎症反应。既往研究发现雷珠单抗注射1d后眼内IL-6、IL-8水平骤升,IL-2、TNF-α水平升高,但差异无统计学意义[48]。本研究比较了玻璃体腔注药后5、6、7d玻璃体液中炎症细胞因子水平,发现这些细胞因子水平无明显波动。推测本研究中IL-6、IL-8、IL-18及TNF-α升高的过程短暂而急剧,可能发生于注射后1~4d。这些炎症因子水平的升高也可能与注射穿刺或药物作用过程中的急性反应或视网膜缺血缺氧[48]有关。上述研究结果表明,抗VEGF治疗早期对眼内炎症因子水平影响甚微。
本研究采用患者玻璃体液作为标本以检测各因子水平,玻璃体液较房水能够更好地反映视网膜病变情况[49]。本研究为前瞻性随机对照研究,随机分组可减少一定的选择偏倚,所有患者均严格按照纳入标准选择。但本研究仍具有一定的局限性,如纳入样本量有限,纳入患者的PDR类型较复杂,且本研究未在随机研究中评估假处理对照组,这可能会影响研究结果。
抗VEGF药物作为PDR及DME的一线治疗方法已被广泛研究,但仍有相当一部分患者对抗VEGF治疗反应不佳。DR的病因是多因素的,DR的发病机制涉及多种细胞因子,如炎症、氧化应激、细胞凋亡等[50],通过拮抗单一细胞因子治疗DR存在一定困难。本研究证实,玻璃体腔注药后视网膜仍处于炎症状态。既往研究表明,眼内炎症细胞因子水平与PPV术后远期视力具有相关性[51]。玻璃体注射曲安奈德联合PPV对PDR患者术后炎症有显著抑制作用,可减少术后早期黄斑水肿的发生[52]。缓释地塞米松植入物、氟轻松玻璃体内植入物也能有效降低PPV术后DME的发生[53-54]。因此,我们认为PPV术前抗VEGF治疗联合PPV术后抗炎治疗对PDR的预后具有重要临床意义。未来可进一步研究DR的免疫炎症机制,为深入了解DR相关靶向治疗提供思路。本研究结果也提示针对炎症机制治疗及联合治疗(如抗VEGF治疗联合抗炎治疗)的开发,将为DR患者的综合和个性化治疗提供希望。

