葡萄辅助因子VvVQ10负调控白藜芦醇生物合成分子机理研究
刘先菊,刘安,姜金铸
(中国中医科学院中药研究所/中药鉴定与安全性评估北京市重点实验室,北京 100700)
白藜芦醇(Resveratrol,Res),是一种存在于葡萄、虎杖等植物中含有二苯乙烯结构的多酚化合物[1]。因著名的“法国悖论”(French Paradox)的流传,白藜芦醇的保健与药用价值逐渐引起广泛关注。之后众多药理研究揭示其具有抗肿瘤、抗炎、抗病毒和抗氧化等多种活性[2-3]。然而葡萄中白藜芦醇含量普遍较低,常规条件下通过提取葡萄材料获取白藜芦醇无法满足市场需求[4]。为提高葡萄中白藜芦醇含量,科研人员对白藜芦醇生物合成的调控机制进行了大量研究,期望通过分子遗传改良方法获得白藜芦醇含量高的葡萄品种[5]。前期研究表明,葡萄中极可能存在一个以MYB、WRKY转录因子为主体,通过蛋白相互作用调控白藜芦醇生物合成的精细网络[6],除转录因子外,其他蛋白参与白藜芦醇生物合成调控网络的研究则相对较少,仅VqSnRK2.4/2.6与VqMAPKKK38激酶通过磷酸化参与其中[7-8]。
VQ蛋白(Valine-glutamine motif containing proteins)是一类蛋白结构具有保守FxxhVQxhTG残基的植物特异性转录调控辅助因子[9],在植物生长发育以及响应生物与非生物胁迫过程中发挥重要作用。如拟南芥AtVQ29在种子发育中发挥关键作用[10],同时AtVQ12和AtVQ29蛋白在植株防御灰葡萄孢菌(Botrytis cinerea)中发挥负调控作用[11]。研究表明,VQ蛋白可通过与WRKY转录因子或丝裂原活化蛋白激酶(MAPK)蛋白互作参与植物生长发育以及响应生物与非生物胁迫[12],如拟南芥AtVQ23和AtVQ16(SIB1/2)蛋白通过与AtWRKY33互作参与植物生物胁迫防御[13],而AtVQ9蛋白通过与AtWRKY8互作维持AtWRKY8介导的盐胁迫耐受通路[14]。然而现阶段对于VQ蛋白参与次生代谢产物生物合成的报道还相对较少。
葡萄VQ蛋白相关研究主要集中于家族成员鉴定及表达量分析,尚未有具体基因功能研究。基于现有基因组信息,葡萄中共存在18个VQ家族成员,其中16个成员分布在10条染色体,另2个成员分布于未组装染色体区段[15]。利用已公开的葡萄各组织器官不同发育时期转录组数据对葡萄VQ家族成员基因表达情况进行分析,并利用RT-qPCR方法验证它们在干旱、白粉病感染和激素(水杨酸、乙烯)处理下的表达情况,结果显示葡萄VQ家族成员可能在葡萄响应不同逆境胁迫时发挥重要作用[15]。
本文通过分析已公开的紫外、伤害与霜霉菌(Plasmopara viticola)侵染逆境处理后葡萄叶片转录组数据中葡萄VQ家族成员表达量,筛选可能参与逆境调控葡萄白藜芦醇类成分生物合成的VQ家族成员,并通过遗传转化与分子生物学实验揭示其功能,为未来更全面地解析各种环境因素对葡萄白藜芦醇生物合成的调控机制提供信息。
1 材料与方法
1.1 植物材料
选取欧亚葡萄品种‘红巴拉多’成熟叶片(茎基部向上第7、8片叶)作为基因扩增试验材料。选取山葡萄(V. amurensisRupr.)组培苗幼嫩叶片作为基因本源瞬时试验材料,组培苗培养于光照培养箱,温度:25 ℃/18 ℃,光周期:16 h/8 h。
1.2 VQ家族成员及其不同逆境表达水平信息获取
根据Wang等[15]发表的葡萄VQ基因家族鉴定文章获得各成员基因的相关信息。之后根据NCBI数据库中紫外、伤害与霜霉菌侵染处理24 h和48 h后欧亚种葡萄‘黑比诺’叶圆片转录组数据(GSE37743)[16]提取VQ基因家族成员不同逆境条件下的表达量。
1.3 VvVQ10引物设计、基因克隆及入门载体构建
使用E.Z.N.A.® Plant RNA Kit试剂盒(Omega bio-tek,R6733)提取葡萄叶片总RNA,之后使用HiScript® III 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒(诺维赞,R312)合成一链cDNA。利用欧亚种葡萄‘黑比诺’参考基因组中VvVQ10CDS序列信息设计5'端添加Gateway attB接头的基因全长引物,VvVQ10-F:ggggacaagtttgtacaaaaaagcaggcttaATG AAGAAACAAGGGAAAAGCAGAAG;VvVQ10-R:ggggaccactttgtacaagaaagctgggtgTCACACCCCATCA AGCCTTCTC。使用PrimeSTAR®Max DNA聚合酶(TaKaRa,R045)扩增VvVQ10基因全长。反应程序为:98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸10 s,35个循环。PCR产物经纯化后重组到pDONR221入门载体后,转化大肠杆菌DH5α。菌落PCR阳性克隆送北京博迈德基因技术有限公司测序。
1.4 葡萄叶片瞬时遗传转化
葡萄叶片瞬时遗传转化参照西北农林科技大学徐炎团队方法[17]进行。将VvVQ10重组到双元表达载体pK7GWIWG2(II)载体中,转化根癌农杆菌GV3101获得阳性菌落。之后28 ℃液体震荡培养至OD600值1.0,5000 r·min-1离心5 min,弃上清,等体积侵染缓冲液(10 mmol·L-1MgCl2;10 mmol·L-1MES,pH5.6;乙酰丁香酮150 μmol·L-1;蔗糖2%)重悬菌体,28 ℃静置4 h。山葡萄组培苗完全浸没于重悬菌液中,保持负压环境直至所有葡萄叶片呈现水浸状。去除重悬菌液后组培苗正常光照条件培养3 d,叶片液氮速冻保存。
1.5 葡萄白藜芦醇及其糖苷提取及含量测定
白藜芦醇提取参照Xi等[18]方法进行,并加以改进。准确称取1 g速冻叶片粉末,料液比1∶15加入甲醇/乙酸乙酯等体积混合液,室温避光静置24 h后高速离心收集上清液。加入提取液重悬沉淀并再次离心收集上清液,两次提取液合并后旋转蒸干溶剂,2 mL质谱级甲醇重新溶解后0.22 μm尼龙膜过滤。吸取1 μL注入UPLCQQQ-MS系统(1290 Infinity Ⅱ-6470,Agilent)进行含量测定。色谱柱选用ACQUITY UPLC BEH C18色谱柱(Waters,粒径1.7 μm,内径2.1 mm×150 mm)。流动相选用水(A相)和乙腈(B相),梯度洗脱程序为:0 min,10% B相;8 min,18% B相;14 min,22%B相;19 min,33% B相;22 min,90% B相;26 min,90% B相;27 min,10% B相;30 min,10% B相,流速0.3 mL·min-1。质谱条件为电喷雾离子源(ESI源);鞘气温度300 ℃;鞘气流速 11 L·min-1;喷嘴电压500 V;雾化器压力35 psi;毛细管电压3500 V;干燥气温度320 ℃;干燥气流量8 L·min-1。数据采集模式为多反应监测(MRM)模式,参数见表1。采用外标法定量:精确称取反式白藜芦醇及其糖苷形式(反式虎杖苷)标准品,质谱级甲醇溶解并精确定容。之后取部分溶液进行紫外照射,根据残存反式白藜芦醇及反式虎杖苷含量计算顺式白藜芦醇及顺式虎杖苷含量。将四种标准溶液进行不同比例稀释后进行质谱检测,根据溶液浓度与相应峰面积绘制各自标准曲线。
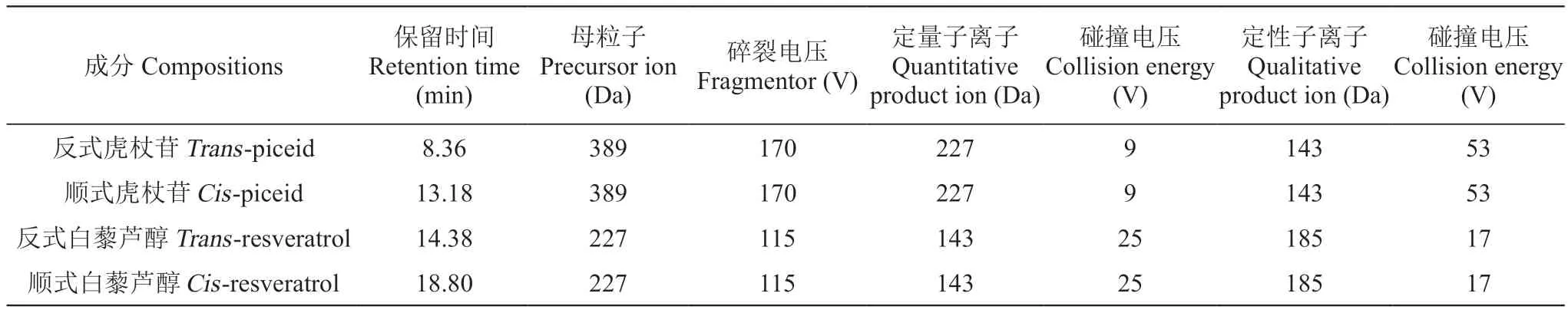
表1 质谱MRM模式下白藜芦醇及虎杖苷参数Table 1 Parameters of resveratrol and piceid in MRM mode
1.6 酵母双杂交
将VvVQ10与前期鉴定负调控葡萄白藜芦醇生物合成的转录因子VvWRKY8[6]分别重组到pGADT7与pGBKT7载体中,PEG/LiAc法共同转化Y2HGold酵母细胞,SD/-Trp/-Leu固体培养基30 ℃培养,之后菌落稀释后利用SD/-Ade/-His/-Leu/-Trp/X-α-Gal固体培养基观察生长及显色情况。
1.7 VvVQ10蛋白磷酸化位点预测
VvVQ10蛋白序列导入GPS 5.0在线分析软件(http://gps.biocuckoo.cn/)中进行磷酸化位点预测,除类型参数选择全部外其余全部采用默认参数。
2 结果与分析
2.1 各种逆境胁迫下葡萄VQ家族基因表达量
利用NCBI数据库中紫外、伤害与霜霉菌侵染等逆境胁迫下葡萄转录组数据对葡萄VQ家族基因在各种逆境中的表达量进行分析。结果如图1所示,葡萄VQ家族成员中VvVQ10在正常生长状况下呈高表达,紫外光处理轻度上调后迅速恢复,而伤害与霜霉菌侵染处理显著下调,推测VvVQ10可能在葡萄应答逆境胁迫中起到重要作用。

图1 葡萄VQ家族成员不同逆境表达量分析Figure 1 Expression pattern analysis of grape VQ family members under different stress
2.2 葡萄叶片瞬时遗传转化探究VvVQ10基因功能
为探究VvVQ10基因功能,将VvVQ10连入沉默载体pK7GWIWG2(II)载体后,转化根癌农杆菌GV3101。通过负压渗透方法瞬时转化葡萄叶片,避光培养3 d后收集叶片,利用UPLC-QQQ-MS检测白藜芦醇及虎杖苷含量,结果发现VvVQ10沉默后白藜芦醇及虎杖苷含量均显著升高(图2)。
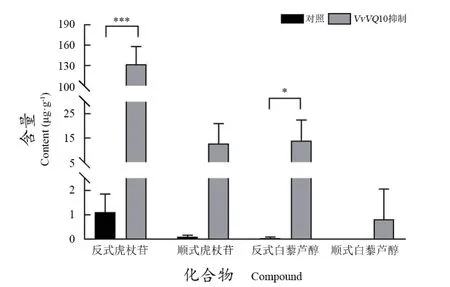
图2 葡萄叶片瞬时沉默VvVQ10白藜芦醇及虎杖苷含量Figure 2 The resveratrol and piceid contents in grape leaves after transient silencing VvVQ10
2.3 VvVQ10与VvWRKY8蛋白互作分析
为探究VvVQ10负调控白藜芦醇生物合成的机理,通过酵母双杂交实验探究其与作者前期鉴定同样具有负调控白藜芦醇生物合成功能的VvWRKY8是否存在蛋白互作关系。将前期鉴定在酵母中不具有激活活性的VvWRKY8与pGBKT7载体的Gal4 DNA结合区进行融合表达,VvVQ10与pGADT7载体的Gal4激活区进行融合表达,两种重组质粒共同转化到酵母Y2HGold细胞中。结果发现在SD/-Leu/-Trp(DDO)培养基上所有酵母均生长良好,但在SD/-Ade/-His/-Leu/-Trp/X-α-Gal(QDO/X)培养基上只有同时转化pGADT7-T和pGBKT7-p53的阳性对照和同时转化pGADT7-VvVQ10和pGBKT7-VvWRKY8的菌株能正常生长,且表现出α-半乳糖苷酶活性使菌落呈现蓝色,其余组合与阴性对照表现一致,均不能生长(图3)。

图3 酵母双杂交检测VvVQ10与VvWRKY8蛋白互作Figure 3 Detection of protein interaction between VvVQ10 and VvWRKY8 by yeast two hybrid
2.4 VvVQ10与VvWRKY8蛋白互作区段分析
为进一步明确互作机理,将VvWRKY8蛋白分为N段与C段(图4A)分别构建到pGBKT7载体中,分别与pGADT7-VvVQ10共同转化Y2H Gold酵母菌株后检测互作情况,结果发现VvVQ10与VvWRKY8的N段、C段均存在互作关系(图4B)。

图4 酵母双杂交检测VvVQ10与VvWRKY8蛋白互作区段Figure 4 Detection of protein interaction between VvVQ10 and VvWRKY8 segments by yeast 2 hybrid
2.5 VvVQ10磷酸化位点预测
为探究VvVQ10是否存在磷酸化修饰可能,利用GPS 5.0在线分析软件对VvVQ10的氨基酸序列进行磷酸化位点分析。结果发现其具有多个潜在磷酸化位点(图5)。

图5 VvVQ10磷酸化位点预测Figure 5 Phosphorylation site prediction of VvVQ10
3 讨论
葡萄中白藜芦醇生物合成主要通过苯丙氨酸代谢途径在一系列酶促反应下合成,其中芪合酶(Stilbene synthase,STS)催化底物4-香豆酰辅酶A和丙二酰辅酶A反应生成白藜芦醇,之后在3-O-β-糖基转移酶(3-O-GT)的催化下进一步生成虎杖苷[16]。值得注意的是4-香豆酰辅酶A和丙二酰辅酶A同样可在查尔酮合成酶(Chalcone synthase,CHS)的催化下进入类黄酮合成途径[19]。因此芪合酶是将反应底物竞争性引入二苯乙烯合成途径的关键酶,其表达量决定了葡萄中白藜芦醇及其糖苷含量[20-21]。众多研究表明,生物及非生物胁迫可通过各种转录因子直接或间接调控STS表达水平,进而诱导白藜芦醇及其糖苷含量显著升高。MYB类转录因子VvMYB14/15最先被鉴定可通过激活下游STS基因表达正调控白藜芦醇合成[22],之后刺葡萄(V. davidii)VdMYB1和毛葡萄(V. quinquangularis)VqMYB154也被鉴定具有直接激活下游STS基因表达的功能[23-24]。然而单纯操纵MYB转录因子无法实现葡萄中白藜芦醇及其糖苷的大量积累[5]。2019年,作者研究发现VvWRKY8通过与VvMYB14 蛋白互作负调控VvSTS15/21的表达,进而减弱白藜芦醇生物合成[6]。之后西北农林科技大学王跃进团队研究发现,VqbZIP1通过与ABA信号关键成员VqSnRK2.4/2.6蛋白互作正调控VqSTS6/16/20的表达[5];VqERF114可通过与VqMYB35蛋白互作进而促进VqSTS15/28/42/46表达[25];VvWRKY53同样可与VvMYB14/15蛋白互作进而调控VqSTS9/16/32/41启动子活性[26]。这些研究表明,葡萄存在一个以MYB转录因子为核心,其他转录因子及激酶通过蛋白复合体形式共同参与的调控网络。本研究发现,辅助因子VvVQ10可与VvWRKY8蛋白互作,进一步扩展了白藜芦醇调控网络成员类型,证实辅助因子也参与白藜芦醇生物合成调控,为后续改造葡萄种质进而提升白藜芦醇含量提供了新思路。
与WRKY及MAPK家族成员相互作用是VQ蛋白较为常见行使功能的方式[9]。作为植物界最大的转录因子家族,部分WRKY家族成员可通过与VQ蛋白中保守的VQ残基相互作用来调节植物生理过程并响应各种生物和非生物胁迫[27],例如拟南芥SIB1(AtVQ16)和SIB2(AtVQ23)通过识别和结合WRKY33的C端结构域来调节WRKY33的DNA结合活性[13]。另外,VQ蛋白可作为MAPKs的下游底物,MPK3、MPK4和MPK6是与VQ蛋白相互作用的三种最常见激酶[28]。多项研究表明,VQ蛋白似乎具有桥接MAPK和WRKY以形成三元复合物(WRKY-VQMAPK)的能力[9],例如MKS1(AtVQ21)被鉴定为AtMPK4的下游底物并被磷酸化,同时WRKY25和WRKY33也与AtVQ21和AtMPK4相互作用[28-29]。本研究中VvVQ10被证实除与VvWRKY8的DNA结合区(C段)互作外,还可与N段结合,这种多互作位点的模式是否具有特殊意义值得进一步探究。同时,对VvVQ10的蛋白序列进行磷酸化位点预测发现其具有多个潜在磷酸化位点,VvVQ10除与VvWRKY8存在蛋白互作外,是否与MAPK家族成员具有蛋白互作关系同样值得进一步探究。
4 结论
综上所述,VvVQ10通过其表达量差异响应不同环境胁迫,进而通过与VvWRKY8的N端和C端互作负调控葡萄白藜芦醇的生物合成。

