松叶猪毛菜叶片原生质体的制备及优化
席昱欣,张玉慧,闻志彬
(1.中国科学院新疆生态与地理研究所,荒漠与绿洲生态国家重点实验室,新疆 乌鲁木齐 830011;2.新疆抗逆植物基因资源保育与利用重点实验室,新疆 乌鲁木齐 830011;3.中国科学院大学,北京 100049;4.中国-塔吉克斯坦生物资源保育与利用联合实验室,新疆 乌鲁木齐 830011;5.中国科学院新疆生态与地理研究所标本馆,新疆 乌鲁木齐 830011)
植物原生质体是植物细胞去除细胞壁以外各种结构的总称,并且能够进行一定的生命活动[1]。原生质体由于失去了细胞壁的保护,可摄取DNA、质粒、病毒等外源物质[2],实现外源基因功能、蛋白亚细胞定位以及蛋白质-蛋白质相互作用等方面研究[3-5],是植物分子遗传和植物育种领域理想的实验材料。获得植物原生质体的方法有机械法和酶解法,其中,酶解法是目前应用最多最广泛的分离方法。将植物材料置于能溶解细胞壁的酶解液中,待细胞壁溶解后释放出原生质体[6]。通过前人不断优化实验条件,模式植物如拟南芥(Arabidopsis thaliana)[7-8]、烟草(Nicotiana tabacum)[9-10]、水稻(Oryza sativa)[11]的原生质体制备技术、转化及再生体系已较为完备并得到广泛应用,非模式植物如非洲菊(Gerbera hybrida)[12]、黑麦草(Lolium perenne)[13]、苋菜(Amaranthus tricolor)[14]、山茶花(Camellia sinensis)[15]、陆地棉(Gossypium hirsutum)[16]、油棕(Elaeis guineensis)[17]、葡萄(Vitis vinifera)[18]、甜樱桃(Prunusavium)[19]的制备与转化体系也不断发展。虽然,模式植物如拟南芥、烟草的制备及转化体系已经十分完备且方便易得,但由于遗传背景不同,基因在模式植物中异源表达可能与其在本底植物中的表达存在差异[20]。植物原生质体分离的原理虽相似,但目前并没有一种通用的原生质体制备及转化体系,仅有研究者建立了适用于被子植物花器官和果实的原生质体制备和转化体系[21]。因此,建立不同物种的原生质体制备及转化体系对于自身基因功能的验证及挖掘具有重要的意义。
松叶猪毛菜(Salsola laricifolia)隶属藜科猪毛菜族,小灌木,主要分布于蒙古、苏联、中亚地区及中国[22],广泛分布于砾质山坡和砾质荒漠[23]。基于松叶猪毛菜的解剖结构、超微结构及酶活性等指标,确定松叶猪毛菜为C3-C4中间型植物(C3到C4途径进化的中间类型)[24-26]。研究C3-C4中间型植物的解剖结构、生理生化特性和特殊功能基因,有助于探究C4植物的高光效机制以及进化意义。因此,松叶猪毛菜作为典型的C3-C4中间型荒漠植物,建立完备的原生质体制备体系是建立其他技术体系(如蛋白亚细胞定位、瞬时表达分析、蛋白质间互作)的前提,这对于该物种特殊功能基因的挖掘以及进化意义的探索具有十分重要的意义。本研究以松叶猪毛菜无菌组培苗真叶为实验材料,对纤维素酶、离析酶、甘露醇浓度以及酶解时间4 个因素进行正交实验,探究酶解液组成与酶解时间对原生质体制备的影响,并在此基础上利用PEG介导法验证松叶猪毛菜NADP-苹果酸酶基因4(SaNADP-ME4)的亚细胞定位。
1 材料与方法
1.1 植物材料
松叶猪毛菜种子于2020年10月采自北疆,4 ℃冰箱保存备用。种子用无菌水浸泡15 min,次氯酸钠溶液洗涤8 min,无菌水冲洗5 次,75%酒精洗涤30 s,种衣剂福美双(称取1 g 福美双溶于15~20 mL ddH2O)洗涤30 s,直接播种于1/2 MS 固体培养基上,在人工气候箱中萌发7 d(白天:25 ℃,14 h;夜晚:18 ℃,10 h;光照6000 Lux),挑选长势好并且大小一致的幼苗移植入新的1/2 MS固体培养瓶中,人工气候箱其他条件不变,光照设为12000 Lux。
1.2 载体及试剂
过表达载体pBI121-SaNADP-ME4 及pBI121-GFP空载的大肠菌株为本实验室保存,具有卡那霉素抗性基因和GFP报告基因。已有研究表明,SaNADP-ME4[27]编码一种646 个氨基酸的蛋白质,前人利用拟南芥原生质体进行激光共聚焦成像发现该蛋白质定位于叶绿体中。纤维素酶Cellulase R-10、离析酶Macerozyme R-10、D-甘露醇、牛血清白蛋白(BSA)、质粒小提试剂盒Plasmid Mini Kit 购自相关生物公司,其他试剂均为国产分析纯。
1.3 酶解液配制
酶解液成分为:4.265 g·L-1MES、1.000 g·L-1BSA、1.110 g·L-1CaCl2、甘露醇、纤维素酶R-10、离析酶R-10(纤维素酶、离析酶和甘露醇浓度配比如表1 所示)。酶解液需现配现用,配置时甘露醇与MES溶解后于55 ℃水浴10 min,冷却至室温后加入BSA 和CaCl2,纤维素酶和离析酶最后加入,酶解液配置好后用0.22 μm无菌过滤器过滤除菌。

表1 原生质体分离的正交实验因素水平Tab.1 Orthogonal experiment factor level of protoplast isolation
1.4 原生质体的分离
取100 mg松叶猪毛菜无菌组培苗真叶,在超净工作台里用无菌解剖刀将叶片从中间纵向剖开,置于0.7 mol·L-1甘露醇溶液中质壁分离10 min,将叶片转移至1 mL 酶解液(37 ℃水浴激活5 min)中,25 ℃避光酶解数小时(酶解时间如表1 所示),取出后轻柔颠倒几次,充分释放出原生质体。
1.5 原生质体的纯化
用W5 溶液(成分为:0.900 g·L-1葡萄糖、9.000 g·L-1NaCl、13.875 g·L-1CaCl2、0.370 g·L-1KCl 及0.853 g·L-1MES;pH 5.8)提前润洗200目筛网,过滤酶解液,去除残余未分解的植物组织;向酶解过滤液中加入等体积的W5 溶液终止酶解反应(剪去枪头尖端,并沿管壁缓慢环加),4 ℃下800 rpm·min-1离心5 min;弃上清,加入500 μL W5 溶液悬浮清洗底部原生质体;4 ℃下800 rpm·min-1离心5 min;弃上清,加入200 μL W5溶液重悬底部原生质体(全程温和操作,避免剧烈摇动原生质体),即获得松叶猪毛菜原生质体悬浮液,置于4 ℃冰箱备用。
1.6 原生质体的活力测定及计数
利用伊文思蓝染色法测定原生质体活力:用剪去枪头尖端的移液器吸取50 μL原生质体悬浮液置于载玻片上,滴加20 μL 0.25%伊文思蓝染液,静置5 min 后在光学显微镜下观察,检测原生质体活性。原生质体活力计算公式:原生质体活力=(视野内未被染色的原生质体数÷视野内原生质体总数)×100%。
采用血球计数法计算原生质体的产量:用乙醇溶液轻轻擦拭血球计数板,清水冲洗干净,滤纸擦干;用擦镜纸擦拭光学显微镜的物镜及目镜;将洁净的盖玻片盖在血球计数板中央计数区,用剪去枪头尖端的移液器吸取原生质体悬浮液滴加于盖玻片一侧,让其渗入计数室中,静置片刻待原生质体悬浮液不再流动且完全沉降至血球计数室内,即可开始计数。25×16 规格的血球计数板,取视野中的左上、左下、右上、右下及中央中方格为计数区域,每个中方格包含16 个小方格,总计80 个小方格。计数80个小方格内原生质体的数目,每组原生质体悬浮液进行3次计数。原生质体数目计算方法参照25×16 规格血球计数板计算公式[28]。原生质体数目/100 mg=5 个中方格内的原生质体数/80×400×104×稀释倍数。
1.7 原生质体分离正交实验
在前期预实验的基础上,采用正交实验设计四因素三水平,共计9 组处理,每组处理3 个重复,比较纤维素酶浓度、离析酶浓度、甘露醇浓度和酶解时间对松叶猪毛菜组培苗真叶原生质体分离产量和活力的影响(表1)。
1.8 外源基因在原生质体中的转化
将制备好的原生质体溶液在4 ℃下800 rpm·min-1离心5 min;弃上清,用1 mL MMG 溶液(成分为:73.000 g·L-1甘露醇、1.430 g·L-1MgCl2、0.853 g·L-1MES;pH 5.8)重悬原生质体;利用广泛使用且高效的PEG介导法[29]进行转化:用剪去枪头尖端的移液器吸取100 μL 的原生质体溶液于1.5 mL 的离心管中,将10 μL pBI121-SaNADP-ME4-GFP质粒载体加入管底,轻弹管底混匀;再加入110 μL PEG 溶液(成分为:400.000 g·L-1PEG4000、36.500 g·L-1甘露醇、11.100 g·L-1CaCl2;pH 5.8),缓慢倒置几次混匀;静置20 min 完成转化;加入440 μL W5 溶液混匀终止转化反应;800 rpm·min-1离心3 min;弃上清,用1 mL WI溶液(成分为:73.000 g·L-1甘露醇、0.853 g·L-1MES、1.490 g·L-1KCL;pH 5.8)重悬原生质体,室温黑暗过夜孵育;800 rpm·min-1离心3 min,去除800 μL 上清,浓缩原生质体溶液,取适量制片;以转化pBI121-GFP空载的原生质体做对照,于激光共聚焦扫描显微镜下观察GFP的表达情况。
2 结果与分析
2.1 松叶猪毛菜组培苗真叶原生质体的分离
收集移植在1/2 MS 固体培养瓶中的松叶猪毛菜幼苗,每组处理称取100 mg 幼苗真叶,将叶片从中间纵向剖开,置于0.7 mo·L-1的甘露醇溶液中质壁分离10 min(图1a),将叶片转移到1 mL酶解液中酶解(图1b)。

图1 松叶猪毛菜真叶原生质体分离Fig.1 Protoplast isolation of Salsola laricifolia
2.2 酶解液组合、甘露醇浓度、酶解时间对原生质体产量、活力的影响
按照正交实验设计四因素三水平的9个实验组合,进行松叶猪毛菜真叶原生质体的分离,对产量及活力进行统计并对产量数据进行极差分析(表2)。对原生质体产量影响的结果显示,纤维素酶浓度的极差最高,表明实验设计的4个因素中,纤维素酶浓度对松叶猪毛菜真叶原生质体分离产量的影响最为显著。此外,甘露醇浓度的极差仅次于纤维素酶浓度,表明甘露醇浓度是松叶猪毛菜真叶原生质体分离产量的另一重要因素。酶解时间及离析酶浓度的极差较小,表明在该实验设计的四个因素的三个水平下,二者对原生质体分离产量的影响小于纤维素酶和甘露醇浓度造成的影响。对原生质体活力影响的结果显示酶解时间的极差最高,甘露醇浓度的极差仅次于酶解时间,说明酶解时间对于原生质体活力的影响最大,维持溶液渗透压的甘露醇浓度对于原生质体制备活力也存在十分显著的影响。
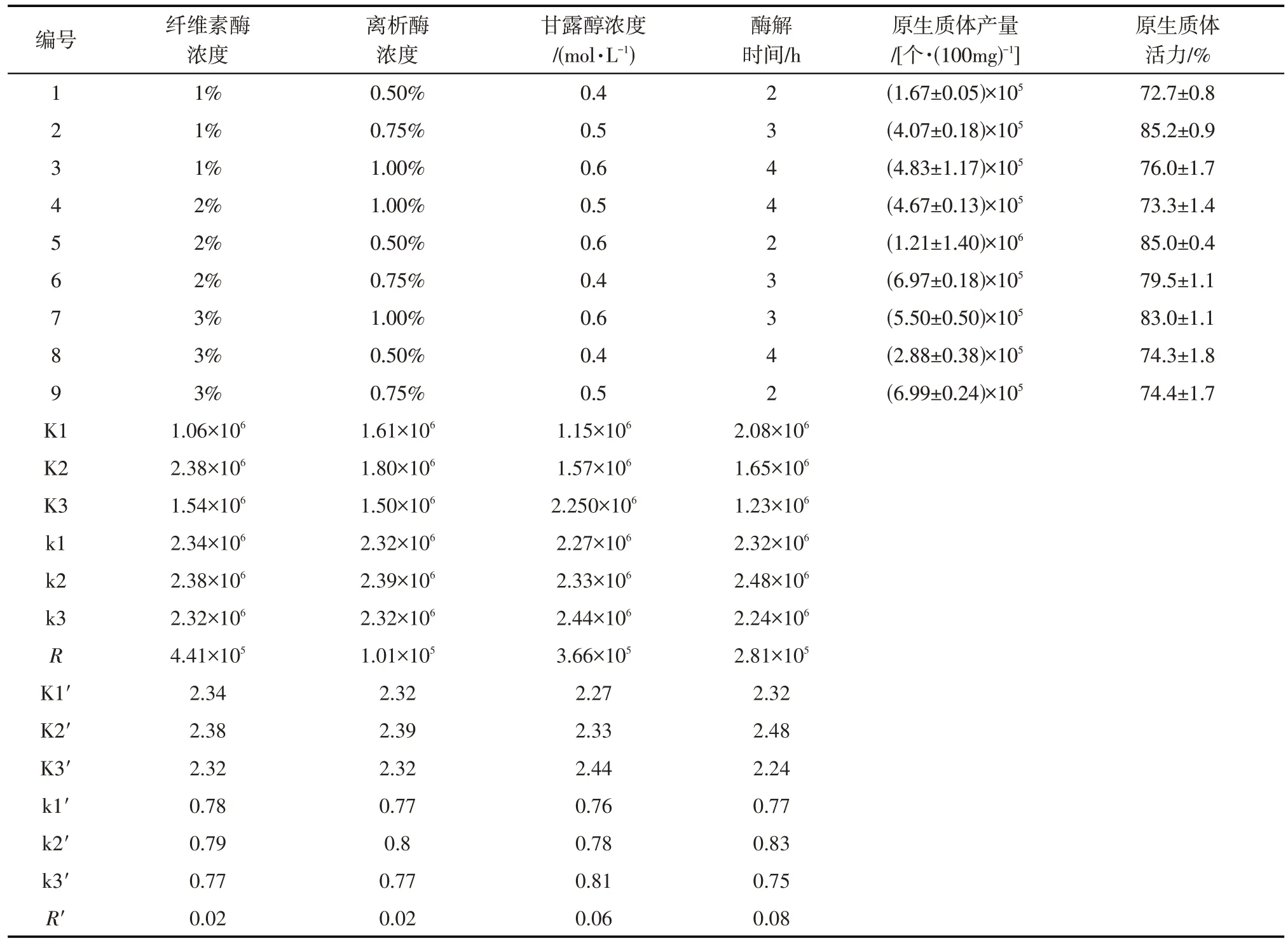
表2 不同条件下获得松叶猪毛菜原生质体的产量及活力的极差分析Tab.2 Protoplast yield and viability of Salsola laricifolia under different conditions
对各组正交实验条件下原生质体分离的产量以及活力数据进行分析,第5 组的原生质体产量最高,达到每100 mg 真叶1.21×106个,第6 组和第9 组产量也较高,分别为每100 mg 真叶6.99×105个和6.97×105个,以上3组实验条件制备的原生质体形态呈饱满的球状,叶绿体清晰可见,且数量能满足后续实验要求。但第6组和第9组所得的原生质体活力较第5 组低,可能由于酶解时间的延长或纤维素酶浓度过高对原生质体细胞产生了损伤。第2组原生质体活力略高于第5组,但其产量远不及第5组,可能由于纤维素酶含量较低,未能使原生质体充分得以释放。结合酶的用量,酶解时间以及原生质体活力因素,第5 组与第6 组相比,酶用量少,耗费时间短;第5 组与第9 组相比,酶用量少,细胞碎片少;第5组与第2组相比,耗费时间短且产量高。因此,纤维素酶浓度为2%、离析酶浓度为0.5%、甘露醇浓度为0.6 mol·L-1为松叶猪毛菜真叶制备原生质体的最佳酶解液组合,2 h为最佳酶解时间。
松叶猪毛菜无菌组培苗真叶原生质体在光学显微镜下呈大小不一的球体,光滑饱满,叶绿体清晰可见的分布于细胞边缘(图2a、图2b)。

图2 光学显微镜下松叶猪毛菜无菌组培真叶原生质体形态Fig.2 Protoplast morphology of euphylla in aseptic tissue culture of Salsola laricifolia microscope
2.3 原生质体的转化研究
以上述最佳条件制备得到的松叶猪毛菜无菌组培苗真叶原生质体作为受体,以植物瞬时表达载体pBI121-SaNADP-ME4 质粒及pBI121-GFP空载质粒(对照)为目标DNA,利用PEG介导法导入原生质体细胞中,室温过夜孵育,在激光共聚焦扫描显微镜下观察GFP 蛋白的荧光信号。结果显示,转化2种质粒的原生质体细胞呈透明状,形状规则且没有破损(图3)。以蓝光(460~480 nm)作为激发光时,转化pBI121-SaNADP-ME4 质粒载体的原生质体可在叶绿体内观察到GFP蛋白绿色荧光(图3a、图3b、图3c、图3d),而空载质粒导入的原生质体只在细胞质中发出绿色荧光,叶绿体内无明显荧光(图3e、图3f、图3g、图3h)。综上所述,空载质粒只在细胞质中表达荧光,而pBI121-SaNADP-ME4质粒载体在叶绿体上发出绿色荧光,说明SaNADP-ME4 定位于叶绿体。

图3 pBI121-SaNADP-ME4转化松叶猪毛菜原生质体的显微观察Fig.3 Microscopic observation of Salsola laricifolia protoplasts transformed by pBI121-SaNADP-ME4
3 讨论
原生质体分离过程中有多种因素会影响原生质体的产量和活力,例如植物材料的选择、材料预处理、酶解液组合、渗透压选择、酶解时间、纯化转速及温度等[6,30-31]。植物材料的选择是成功分离原生质体的基础,通常选择取材较简单且富含组织细胞的叶片,且幼嫩的叶片分离效果较好,并且采用无菌组培苗可免去材料表面消毒的工作,还能减少后续实验染菌的可能[32],本研究采用25 d苗龄的组培苗叶片作为实验材料。对材料进行预处理会大大提升分离效率,分离高粱(Sorghum bicolor)原生质体时,将叶片置于甘露醇溶液中进行质壁分离预处理,有利于维持离体叶片的渗透压,提高分离效率[33];对拟南芥、烟草进行叶片原生质体分离时,利用胶带去除植物叶下表皮组织,省去了纯化过程,一定程度上提高分离效率[34];分离沙冬青子叶原生质体时,将叶片切成约1 mm宽的细条,增大了植物材料与酶解液的接触面积,利于达到较高的分离效率[35]。由于松叶猪毛菜的叶片较细小,去除下表皮较为困难,所以采用纵向剖开细小叶片,并置于0.7 mol·L-1甘露醇溶液中进行质壁分离预处理来提高分离产量。
原生质体分离酶解液的组成是分离成功与否的关键因素[16]。纤维素酶可以去除细胞壁主要成分,离析酶是比果胶酶温和的消化细胞骨架中骨胶质成分的酶[36],2 种酶结合使用最为广泛[37]。由于制备原生质体选择的植物材料的细胞壁组成成分存在差异,2种酶浓度配比也不尽相同,如非洲菊叶片原生质体采用2%纤维素酶和0.3%离析酶得到最佳制备产量[12];多年生黑麦草叶片原生质体采用2%纤维素酶和0.5%离析酶为最优酶解液组合[13]。由于原生质体不具备细胞壁,极易受渗透压的影响而导致质膜受损,酶解液中的渗透压也需要严格控制。最常用的渗透压稳定剂为甘露醇,其特点是不易被细胞吸收利用[38]。酶解液的pH也需要维持于稳定水平,常用MES 作为pH 稳定剂[39]。制备草莓叶片原生质体时,选择0.9 mol·L-1的甘露醇[40],分离葡萄原生质体时,0.6 mol·L-1的甘露醇可以维持渗透压[18]。本实验使用纤维素酶和离析酶进行酶解,甘露醇维持渗透压,MES作为pH稳定剂,所制备的松叶猪毛菜原生质体效果较好。
酶解时间是影响分离效率的又一重要因素,酶解时间过长会导致原生质体质膜受损,导致碎片增多;时间过短,分离的原生质体量太少,无法进行后续实验[13,33]。酶解时间在不同物种中差异很大,一般在3[14]~24 h[41]不等。本研究发现,随着酶解时间的延长,酶量也会随之增加,但会导致细胞碎片增多,分离得到的原生质体活力降低,可能是由于较长时间的酶解,会对原生质体质膜产生一定的损害作用[42]。酶解温度也会影响原生质体分离的产量及活力[40],采用25 ℃的酶解温度可以充分发挥酶的活性,且不会对原生质体造成损伤作用。在纯化过程中,将原生质体沉降下来的离心步骤也至关重要,过高的离心力会导致原生质体受到机械损伤,过低会导致沉降不彻底[37],本实验使用的800 rpm·min-1离心力可以得到良好的沉降分离效果。综上所述,本研究采用25 d 苗龄的幼苗真叶,纵向剖开后预先质壁分离10 min后,置于2%纤维素酶+0.5%离析酶+0.6 mol·L-1甘露醇的酶解液中25 ℃酶解2 h,得到了较高的原生质体产量和活力,可用于后续实验。
为验证制备的原生质体可用于瞬时转化,本研究以定位于叶绿体的SaNADP-ME4 作为目标DNA进行原生质体的转化。结果发现,SaNADP-ME4-GFP融合蛋白定位于原生质体的叶绿体中,与前人研究该基因定位于拟南芥原生质体叶绿体结果一致[25],表明本研究建立的原生质体分离和转化方法可以用于松叶猪毛菜的基础研究,为松叶猪毛菜基因功能研究奠定了基础。
4 结论
本研究以松叶猪毛菜无菌组培苗的真叶为材料,分析不同纤维素酶和离析酶的浓度配比、渗透压及酶解时间对分离原生质体的产量及活力的影响。结论如下:
(1)探究的4 个影响因素中:纤维素酶对原生质体制备产量的影响较大,酶解时间对分离的原生质体活力的影响最为显著。
(2)采用25 d叶龄的无菌组培苗真叶,在2%纤维素酶+0.5%离析酶+0.6 mol·L-1甘露醇的酶解液中于25 ℃酶解2 h,使用W5溶液在800 rpm·min-1的转速下纯化,原生质体产量可达1.21×106个,活力为85%。
(3)利用制备的松叶猪毛菜原生质体作为受体,用PEG 转化法转化pBI121-SaNADP-ME4-GFP质粒载体,检测到SaNADP-ME4定位于叶绿体中。

