白花蛇舌草总黄酮对肝细胞癌干细胞增殖及凋亡的影响
姚博文,李亚昭,廖子君,鲁 叶,张 祥,马婕群,李 倩,张彦兵
(1.西安交通大学第一附属医院肝胆外科,陕西西安 710061;2.西安交通大学第一附属医院转化医学中心,陕西西安 710061;3.陕西省肿瘤医院肿瘤内科,陕西西安 710061;4.西安交通大学附属儿童医院心电诊断科,陕西西安 710003)
肝癌是全球常见的消化道恶性肿瘤之一,肝细胞肝癌(hepatocellular carcinoma,HCC)占全球原发性肝癌的80%以上[1]。全球肝癌发病人数为91万,占所有癌症的4.7%,在癌症发病率中排名第六位,死亡人数在全球排名第三位,且发病率呈逐年上升趋势[2]。
肝癌干细胞(liver cancer stem cells,LCSCs)是HCC中具有自我更新、分化和肿瘤发生能力的一小部分肿瘤细胞,与肿瘤的增殖、转移、复发及化疗耐药等肿瘤恶性进程具有密切的关系[3-4]。目前已被鉴定的肝癌干细胞标志物包括CD133、EpCAM、CD44、CD13、CD90、CD24、CD47和OV6等[3]。其中,CD133与HCC患者的分级、分期、甲胎蛋白(AFP)水平、生存周期及复发等具有显著相关性[5-7]。同时,CD133的抗原能够在Huh7细胞系表面表达,并且来自Huh7细胞系的CD133+细胞具有更高的体外增殖、分化、致瘤及血管生成能力[8-9],是流式分选Huh7 细胞中LCSCs常用的分子标志物。
白花蛇舌草(HedyotisdiffusaWilld.)为茜草科耳草属植物,白花蛇舌草总黄酮(total flavone of oldenlandia diffusa,FOD)是其重要的活性提取物之一。前期研究已经证实,FOD 对HCC的增殖及上皮间质转化具有显著抑制作用[10-11]。同时,其对肺癌干细胞、大肠肿瘤干细胞等均具有抑制作用[12-14]。
本研究对肝细胞癌细胞系Huh7中肝细胞癌干细胞标志物CD133 阳性的细胞群(CD133+-Huh7)进行流式分选,探究FOD 药物刺激对CD133+-Huh7细胞增殖及凋亡的影响,为FOD 在HCC临床治疗中的应用提供新的依据及研究基础。
1 材料与方法
1.1 试剂与仪器
Huh7细胞购买自中国科学院细胞库。DMEM高糖培养基、细胞胰酶、胎牛血清(FBS)购自Hyclone,CD133流式抗体购自Biolegend;青霉素-链霉素-两性霉素B 溶液、细胞蛋白裂解液、BCA 蛋白定量试剂盒、BSA 购自碧云天生物试剂;CCK-8 检测液、ECL 发光液购自新赛美生物;Annexin V-PE/7-AAD 凋亡检测试剂盒购自BD;一抗β-actin、Bcl-2、Nanog、Caspase3、FAS、FADD、P53及二抗购自武汉三鹰;Bax、Oct4、Sox2 一抗购自Santa Cruz公司。细胞培养箱(赛默飞);超净工作台(海尔);MoFlo XDP超速流式细胞分选仪(贝克曼);流式细胞分析仪(BD);多功能酶标仪(Enspire);垂直电泳系统、转膜仪、ECL发光仪(伯乐)。
1.2 FOD的提取
取白花蛇舌草药材粗粉50 g,加入500 mL石油醚回流提取1 h,滤过,药渣挥干石油醚,加700 m L/L乙醇500 m L,回流提取1.5 h,滤过,滤液减压回收至约50 m L后,D101树脂柱上样,分别用水和100、300、500 m L/L 乙醇洗脱后,收集500 m L/L 乙醇洗脱液,加压回收乙醇至约10 m L,聚酰胺柱上样,分别用水和100、300、500、700 m L/L 乙醇洗脱,收集洗脱液,减压浓缩,干燥即得。
1.3 细胞培养
将冻存的Huh7细胞放入37℃水浴锅中快速解冻,迅速移入10 m L含有100 m L/L FBS的DMEM高糖培养基中,轻柔混匀后转入细胞培养皿中。在37℃,50 m L/L CO2细胞培养箱中进行培养。待细胞生长汇合达到约90%时,用细胞胰酶消化液消化1 min后,加入等体积的完全培养基终止消化,1 000 r/min离心5 min,弃上清,轻柔重悬细胞沉淀后进行1∶3传代。
1.4 细胞免疫荧光染色及干细胞的流式分选及鉴定
将对数生长期Huh7 细胞汇合至约80%时,用胰酶消化成单细胞悬液,PBS溶液漂洗2次去除残留培养基。加入100μL PBS 溶液重悬细胞后,加入5μL CD133抗体,37℃避光孵育30 min。PBS溶液漂洗后,加入1 m L PBS溶液重悬细胞,使用单细胞筛网进行过滤,通过MoFlo XDP超速流式细胞分选仪对CD133+细胞进行流式分选,获得纯化Huh7干细胞。取部分获得分选细胞培养并再次染色后,使用流式细胞术检测CD133阳性细胞比例。
Western blotting 检测所获取分选细胞CD133阳性细胞的干性标志物Nanog、Sox2及Oct4的相对表达。将分选后的CD133+细胞收集于含有青霉素-链霉素-两性霉素B 溶液的完全培养基中,进行后续培养。
1.5 CCK-8(Cell Counting Kit-8)法 检 测FOD 对 分选细胞的增殖抑制率
将纯化的CD133+Huh7细胞以500个/孔的密度加入96孔板中,移入细胞培养箱中过夜培养使其贴壁,分别用0、50、100、400μg/m L FOD 干预24、48、72、96 h,进行CCK-8实验检测。向每孔中加入10μL CCK-8检测,37℃孵育2 h,用多功能酶标仪检测吸光度A450nm值。根据抑制率公式计算抑制率,公式如下:抑制率(%)=(Acontrol-Asample)/(Acontrol-Ablank)×100%(control代表对照组即加入细胞未加药品组,blank 为空白对照即未加细胞和药品组,sample代表加入细胞及药品检测组)。
分选的Huh7干细胞分别用0、50、100、400μg/mL处理,根据细胞生长抑制率曲线,选取合适浓度(经实验后选用100μg/m L)的FOD 处理组为实验组(后文称为FOD 组),0μg/m L FOD 处理组为对照组(后文称为DMSO 组)。
1.6 平板克隆实验
取分选后的对数生长期CD133+-Huh7 细胞,1 000/孔种于6孔细胞培养板中,FOD 组和DMSO组细胞培养10 d,弃去细胞培养基,PBS溶液轻柔清洗2遍,吸干残余液体,每孔加入2 m L 100 m L/L甲醛溶液固定细胞20 min后弃去,PBS溶液轻柔清洗2遍,加入结晶紫溶液染色10 min。弃去染料后清洗5遍。风干培养板后,显微镜下拍照并计数。
1.7 Annexin V-PE/7-AAD法检测细胞凋亡
将对数生长期的FOD 组和DMSO 组CD133+-Huh7细胞,胰酶消化成单细胞悬液,用PBS溶液漂洗2次,加入100μL稀释好的binding buffer重悬细胞后,分别加入5μL Annexin V-PE及7-AAD,37℃避光孵育30 min 后,加 入500μL 稀 释 好 的binding buffer,使用单细胞筛网进行过滤后使用流式分析仪进行检测。
1.8 Western blotting检测凋亡相关蛋白表达
将FOD 组及DMSO 组细胞,使用蛋白裂解液提取总细胞蛋白,BCA 法检测蛋白浓度并变性蛋白后,进行SDS-PAGE 电泳后,转印至PVDF 膜,经BSA封闭,一抗(细胞凋亡标志物Bcl-2、Bax 及Cleaved-Caspase3及凋亡相关通路蛋白P53、FAS及FADD)、二抗孵育后,进行ECL发光。
1.9 统计学处理
实验数据分析采用SPSS v19.0及GraphPad作图软件自带分析完成。分别完成3次独立重复实验,实验数据汇总后,A 值、蛋白电泳条带扫描后灰度、凋亡细胞百分比、平板克隆细胞集落数采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 CD133+-Huh7肝细胞癌干细胞的分选情况
使用CD133抗体对Huh7细胞进行流式免疫荧光染色分析发现,CD133+-Huh7细胞比例为40.2%(图1A)。对CD133+的Huh7 细胞执行分选后培养,经此纯化后的CD133+细胞比例为98.2%(图1B)。Western blotting实验证实纯化后的CD133+-Huh7干性指标Nanog、Sox2及Oct4的表达较分选前更高(图1C)。

图1 流式分选并纯化CD133+-Huh7细胞及其鉴定Fig.1 Fluorescence-activated cell sorting and purifying C D133+-Huh7 cells
2.2 FOD对CD133+-Huh7肝细胞癌干细胞增殖的影响
CCK-8法检测结果显示,以50、100、400μg/m L FOD 刺激CD133+-Huh7肝细胞癌干细胞不同时间后,其增殖能力均被一定程度抑制,400μg/m L 的FOD刺激CD133+-Huh7肝细胞癌干细胞96 h,细胞增殖抑制程度最为显著(图2,P<0.01)。综合考虑药物的抑制率及浓度增高的副作用,选择100μg/m L FOD 作用72 h(FOD 组)进行后续实验。平板克隆实验结果显示,FOD 组的Huh7 细胞增殖能力较DMSO 组减弱(图3,P<0.01)。

图2 各浓度FOD对CD133+-Huh7肝细胞癌干细胞不同作用时间的抑制率比较Fig.2 The inhibition rate of FOD on CD133+-Huh7 detected by CCK-8
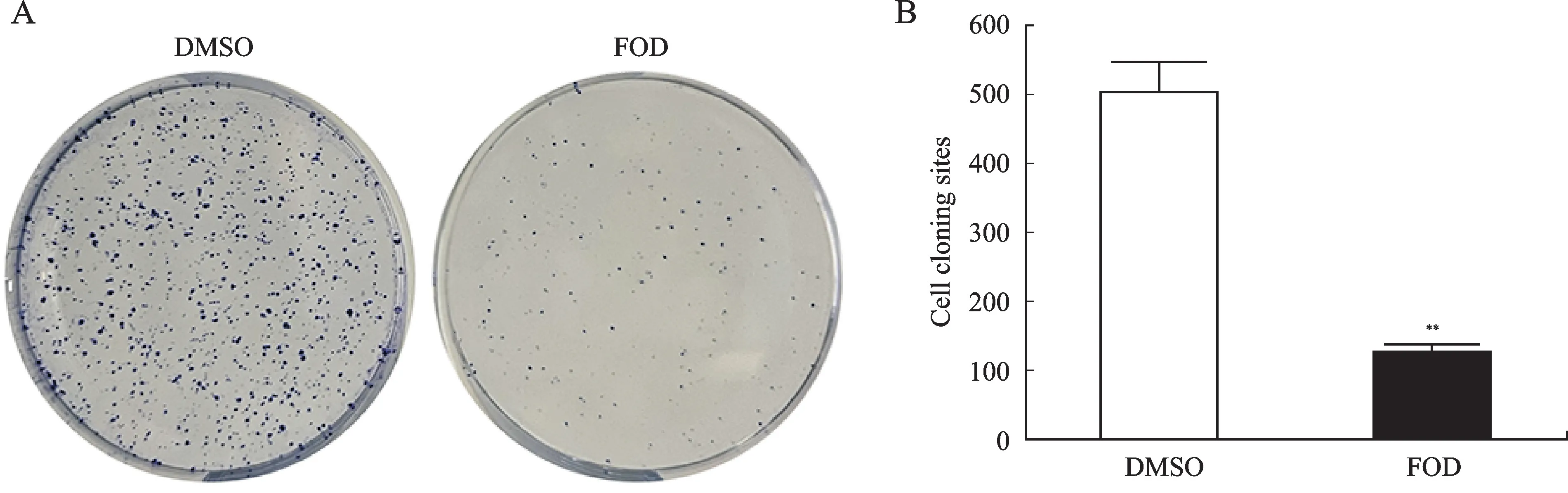
图3 平板克隆实验观察FOD对CD133+-Huh7肝细胞癌干细胞增殖的影响Fig.3 The effect of FOD on CD133+-Huh7 proliferation
2.3 FOD对CD133+-Huh7肝细胞癌干细胞凋亡的影响
Annexin V-PE/7-AAD 凋亡检测结果显示,100μg/m L的FOD 作用CD133+-Huh7干细胞凋亡水 平 显 著 升 高(P<0.01),DMSO 组 和FOD 组CD133+-Huh7的细胞凋亡比例分别为(6.775±1.018)%vs.(16.55±1.212)%(图4)。
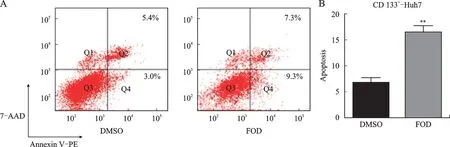
图4 FOD对CD133+-Huh7干细胞凋亡的影响Fig.4 The effect of FOD on CD133+-Huh7 cell apoptosis
Western blotting检测结果显示,相较于DMSO组,FOD组抗凋亡蛋白Bcl-2表达降低,而促凋亡蛋白Bax、片段化的Caspase3升高(P<0.05,图5)。
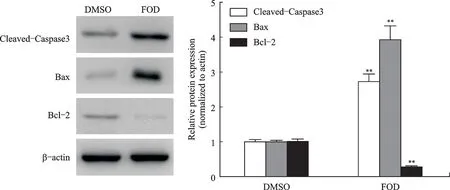
图5 FOD对CD133+-Huh7肝细胞癌干细胞Bcl-2、Bax及Caspase3蛋白表达的影响Fig.5 The effect of FOD on CD133+-Huh7 Bcl-2 and Bax and Caspase3 protein expressions
以 上 结 果 证 明,100μg/m L 的FOD 能 够 促 进CD133+-Huh7细胞凋亡。
为进一步探究引起Huh7细胞发生凋亡的上游通路,根据经典的凋亡家族蛋白上游通路筛检,发现FOD 可以显著上调FAS、FADD 以及经典抑癌通路关键蛋白P53(P<0.05,图6)。据此推测,FOD 激活Huh7细胞发生凋亡的潜在上游机制可能为P53-Bax以及FAS-FADD-Caspases家族蛋白共同作用的强效促凋亡机制。
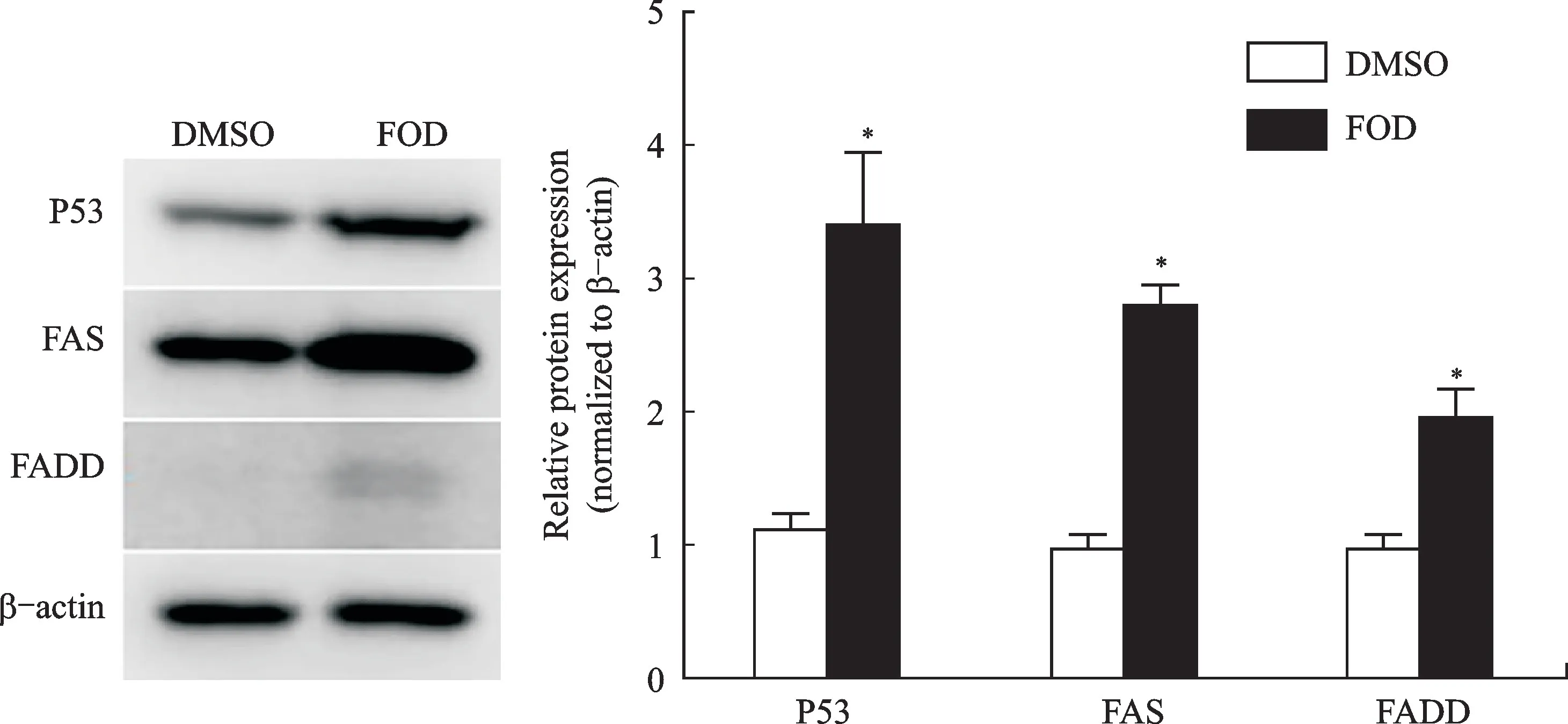
图6 FOD对CD133+-Huh7肝细胞癌干细胞p53/FAS-FADD通路蛋白表达的影响Fig.6 The effect of FOD on CD133+-Huh7p53/FAS-FADD axisprotein expression
3 讨 论
肝细胞癌是最致命的恶性肿瘤之一,具有高度的肿瘤异质性,并且其发病率呈逐年上升的趋势[15]。我国是乙肝大国,同时也是肝癌大国,肝癌新发病例数和死亡病例数均位列全球第一[16]。目前肝癌治疗的主要手段包括手术切除[17]、肝脏移植[18]、射频消融[19]、经动脉介入治疗[20]、细胞毒T 淋巴细胞相关抗原4及程序性死亡受体-1等单抗或抑制剂免疫治疗[21-22]、索拉非尼及仑伐替尼药物靶向治疗[23-24]等。然而,由于LCSCs的存在,导致HCC的转移、复发及耐药风险大幅升高[3-4]。
FOD 作为白花蛇舌草中重要的活性提取物之一,能够对肺癌干细胞的增殖、凋亡及细胞周期产生影响[12],能够通过Wnt信号通路抑制结肠肿瘤干细胞分化[13],并且在结肠癌中能够通过调控Wnt/βcatenin通路抑制干细胞的生长[14]。然而其对肝细胞癌干细胞的作用未见报道。本研究通过流式分选成功分离出CD133+-Huh7 肝细胞癌干细胞,并将FOD 作用于该细胞,观察FOD 对CD133+-Huh7肝细胞癌干细胞增殖及凋亡的影响。结果显示,FOD能够对CD133+-Huh7 肝细胞癌干细胞增殖产生以剂量及时间依赖性抑制,同时,FOD 使其凋亡水平显著升高,且抗凋亡蛋白Bcl-2及促凋亡蛋白Bax的表达发生变化,这为FOD 在治疗复发型、转移型及耐药性HCC方面提供理论依据。
参与干细胞凋亡的蛋白众多。本研究所涉及的凋亡蛋白为线粒体凋亡家族蛋白,为凋亡蛋白的主要分支。FOD 是否参与Caspase家族其他蛋白及细胞坏死、细胞衰老相关家族蛋白仍需后续研究。为初步明确激活干性肝癌细胞凋亡的潜在上游,通过筛检凋亡通路蛋白发现P53、FAS-FADD 通路被FOD 激活,因此,有理由相信下游的Caspase 家族蛋白及Bax/Bcl家族蛋白表达变化与上游通路激活有关。然而,FOD 对干细胞凋亡通路的激活机制尚不清楚,目前发现的仍然只是表型和部分潜在机制,有关抑制增殖、促进凋亡的关键通路仍是未知,将在后续的研究中揭示。
研究肝细胞癌干细胞活性及机制,探索抑制肝细胞癌干性细胞的药物及治疗手段成为解决肝细胞癌治疗耐药及延长患者生存期的关键环节。本研究虽然提出FOD 抑制肝细胞癌干细胞活性的科学假设,并初步探讨抑制干性细胞增殖、促进其凋亡的潜在作用,但干细胞活性受多种因素影响,其凋亡亦受到肿瘤微环境、物理化学刺激等多种外因调节,干细胞活力下降且凋亡增加是否由FOD 单一因素引起仍需要更为严谨的科学实验进一步探究。本研究首次发现FOD 对肝细胞癌干细胞的显著抑制作用,将可能为一线治疗耐药的患者提供指导和帮助,与靶向药物、化疗药物、免疫治疗药物等联合使用FOD 或将增加对耐药细胞的杀伤作用。在祖国医学快速发展的今天,中西医结合理念及产品成为解决关键技术难题的中坚力量。白花蛇舌草来源丰富,具有较小的正常肝细胞毒性,而对肿瘤细胞、肿瘤干细胞的细胞毒性更强,联合使用FOD 可在尽量降低肝脏损害风险的同时,具有一定的治疗作用和较高的性价比。
简言之,肝细胞癌治疗进展及耐药很大程度源于肿瘤干细胞的异常增殖及逃逸,FOD 为杀伤LCSCS提供了可能,也为中药提取物对肿瘤干细胞治疗提供依据。

