枯草芽胞杆菌GB519在水稻植株中的定殖及对稻瘟病田间防效
祁山颜 朱峰 王继春 田成丽 王东元 欧玉苹 刘晓梅 李莉 姜兆远

摘要 枯草芽胞杆菌GB519是一株具有广谱抑菌活性的生防菌株。本研究利用绿色荧光蛋白标记的菌株GB519-GFP处理水稻种子、根和叶片,结合激光共聚焦显微镜观察和抗生素平板回收检测的方法,探究其在水稻根茎叶中的定殖动态。结果显示:经GB519-GFP发酵液处理水稻种子、根和叶片后,菌株均可内生定殖于植株的表皮、皮层和维管束中,表明其可在水稻植株内迁移和定殖。GB519-GFP在处理部位的定殖量通常呈现先减少后增多的趋势,非处理部位3~5 d后即可检测到标记菌株。浸种处理,3 d后在幼芽中可检测到标记菌株;20 d后在根中的菌量最多,达5.7×105 cfu/g。灌根处理,1 d后根中菌量为5.4×105 cfu/g;20 d后根、茎和叶中菌量均达到最大值;处理80 d后,根中定殖数量仍达1.9×105 cfu/g。叶面喷施处理,1 d后叶片菌量为4.2×105 cfu/g;20 d后叶片菌量达4.4×105 cfu/g。不同处理方法在各部位的定殖量几乎均在处理20 d后达到峰值。采用叶面喷施GB519对稻瘟病穗颈瘟的田间防效达73.9%,表明叶面喷施GB519能够起到防控稻瘟病的作用。本研究为使用枯草芽胞杆菌GB519防控水稻稻瘟病提供指导。
关键词 枯草芽胞杆菌GB519; GFP; 定殖动态; 稻瘟病; 防效
中图分类号: S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2021719
Abstract Bacillus subtilis GB519 displays antimicrobial activity in a broad spectrum. In this study, the GFP-labeled strain, GB519-GFP was used to explore its colonization dynamics in rice plants via both the laser confocal microscope observation and antibiotic plate recovery. The strain GB519-GFP could colonize the epidermis, cortex and vascular bundle after seed-soaking, root-irrigating or foliar-spray with the fermentation broth. These results indicated that it could migrate and colonize in rice plants. In general, the colonization quantity of GB519-GFP first decreased and then increased in the treated part, and it could be detected in the untreated part after 3-5 days. The GFP-labeled strain was detected in the bud three days after seed-soaking and the maximum amount of colonization reached 5.7×105 cfu/g in the root after 20 d. The amount of colonization in the root was 5.4×105 cfu/g one day after root-irrigating. The amount reached the maximum value in the root, stem and leaf after 20 d, and remained at 1.9×105 cfu/g in the root after 80 d. The colonization was 4.2×105 cfu/g in the leaves one day after foliar-spray, and reached 4.4×105 cfu/g after 20 d. The amounts of colonization in different tissues reached the peak 20 d after treated. The control efficacy of GB519 against rice blast was 73.9% in the field by foliar-spray. It indicated that foliar spraying with GB519 could play a role in preventing rice blast. This study provides a guidance for the control of rice blast by B.subtilis GB519.
Key words Bacillus subtilis GB519; GFP; colonization dynamics; rice blast; control efficacy
隨着人们生活品质的提高,对粮食质量愈发关注,绿色有机食品成为大众的广泛需求,而环保、低毒的生物防治方法成为生产绿色有机食品的重要措施[1]。枯草芽胞杆菌Bacillus subtilis是研究与应用较为广泛的生防菌之一,能促进植物生长和防治植物病害,提高养分利用率和改变植物激素水平,产生抗菌物质和触发诱导抗性等[2]。同时,枯草芽胞杆菌具有持久高效的活性,能够形成抗逆性强的芽胞,有利于制剂的研发和保存,是生防菌剂开发利用的重要组成部分[3]。
生防菌能否定殖决定了其生防效果,研究生防菌的定殖模式不仅可以揭示它的微生态特征,也有助于评估其适应性和活性的稳定性[4]。生防菌防效的优劣与其能否定殖及定殖能力强弱呈正相关[5-6]。因此,科学地施用生防菌,对提高其在植物中的定殖能力和防效具有重要意义[7]。利用抗生素标记菌株是探究生防菌定殖的最早方法,但该标记法不能区分出抗性相同的其他微生物[8]。绿色荧光蛋白(GFP)标记的菌株因其易于检测、灵敏度高、稳定性好且可以精准定位,相关的研究越来越多[9]。Liu等[10]研究发现枯草芽胞杆菌定殖位点较集中,主要聚集在水稻表皮、外皮层和维管束中。沙月霞等[11]将贝莱斯芽胞杆菌Bacillus velezensis E69菌悬液喷施于水稻,发现其能够从表皮进入水稻, 向薄壁组织和中央维管束扩展。
东北大米晶莹剔透、入口润甜,深受国人喜爱,但北方水稻稻瘟病防控中化学药剂仍然占主导地位,低毒绿色防控替代品一直在探索中。水稻稻瘟病菌通常以菌丝体或分生孢子在感病稻草上越冬,次年在温湿度适宜时产生分生孢子,分生孢子借风传播侵染植株叶片和穗颈部位,发生稻瘟病造成危害。GB519菌株是从吉林省稻区分离获得的一株枯草芽胞杆菌,经过试验证实对稻瘟病等多种植物病原菌表现出抑菌效果[12-13]。为了为实践应用提供有效的使用方式,本研究检测了绿色荧光蛋白标记的菌株GB519-GFP在不同处理水稻植株中的定殖动态,明确其定殖能力;并结合稻瘟病菌侵染时期和方式,采用叶面喷施GB519开展防控水稻稻瘟病试验。本研究可为阐释枯草芽胞杆菌 GB519 在水稻植株中的定殖规律和指导防控提供依据。
1 材料与方法
1.1 试验材料
枯草芽胞杆菌Bacillus subtilis GB519和GB519-GFP由吉林省农业科学院植物保护研究所水稻病害综合防控团队筛选、鉴定、构建并保存。供试水稻品种为‘吉粳88,种子由吉林省农业科学院水稻研究所提供。
LB培养基:酵母粉5.0 g,蛋白胨10.0 g,NaCl 10.0 g,补水至1 000 mL,调pH 7.0~7.2。固体培养基在LB基础上添加20.0 g琼脂粉。
对照药剂:75%肟菌·戊唑醇水分散粒剂(WG),由拜耳作物科学(中国)有限公司生产。
1.2 菌株GB519/GB519-GFP发酵液制备
超低温保存的GB519和GB519-GFP菌株经平板活化后,挑取单菌落于50 mL的LB培养液中,37℃、150 r/min培养12 h,再按5%接种量接种到LB培养液中(150 mL/500 mL三角瓶),30℃、150 r/min培养48 h后备用。
1.3 激光共聚焦显微观察与菌株GB519-GFP的菌落数量测定
将水稻目标组织制成临时切片,用激光共聚焦显微镜(Leica TCS SP8)在波长488 nm处观察菌株GB519-GFP在水稻组织中的定殖位点和扩展迁移方向。
菌株GB519-GFP的菌落数量测定参考Sorokan等[14]的方法。样品先在75%乙醇中浸泡3 min,再用蒸馏水冲洗3~5次,分别称取1 g根、茎、叶片组织,用预冷研钵研磨成匀浆,并加入100 mL无菌水,稀释10倍后,分别吸取100 μL稀释液均匀涂布于LB平板(含5 μg/mL氯霉素),无菌水作为对照,48 h后统计菌落数量。在激光共聚焦显微镜下观察菌落是否出现绿色荧光,出现绿色荧光的为GB519-GFP菌株。
1.4 菌株GB519-GFP处理在水稻根、茎、叶部的定殖动态
1.4.1 GB519-GFP浸种处理
根据Wang等[4]的方法,水稻种子经表面消毒后置于滤纸保湿的培养皿中,30℃催芽40 h至露白。将露白的种子置于新培养的GB519-GFP发酵液(1×108 cfu/mL)中浸泡24 h后播种于直径10 cm的营养钵(自然黑土占67%,草炭基质占33%)中,每钵播种50粒种子。以培养液浸泡的种子为对照。置于温室中培养。分别于浸种处理后第1、3、5、7、14、20、30、40、60天和第80天,从每钵中随机取5株植株,共25株作为1个重复,3次重复。采用非丢弃取样法,将25株植株的根、茎、叶片组织分别混合后,进行激光共聚焦显微观察和统计菌株GB519-GFP的菌落数量,处理方法同1.3。
1.4.2 GB519-GFP灌根处理
参照杨珍福等[15]的方法。水稻种子经表面消毒后播种于直径10 cm的营养钵(自然黑土占67%,草炭基质占33%)中,每钵播种50粒种子。播种14 d后,用GB519-GFP发酵液(1×108 cfu/mL)灌根處理(5 mL发酵液/株),以培养液灌根作为对照。分别在处理后第1、3、5、7、14、20、30、40、60天和第80天,采用非丢弃取样法,将25株植株的根、茎、叶片组织分别混合后,进行荧光检测和涂板检测菌落数量,处理方法同1.3。
1.4.3 GB519-GFP喷施叶面处理
参照Sha等[16]的方法,水稻种子经表面消毒后,播种于直径10 cm的营养钵(自然黑土占67%,草炭基质占33%)中,每钵播种50粒种子。在播种后45 d,将叶片以下组织及营养钵用保鲜膜包裹,使植株呈倒立状,再将GB519-GFP发酵液(1×108 cfu/mL)均匀喷施叶片(20 mL发酵液/钵),以喷施培养液作为对照。分别在处理后第1、3、5、7、14、20、30、40、60天和第80天,采用非丢弃取样法,将25株植株的根、茎、叶片组织分别混合后,进行荧光检测和涂板检测菌落数量,处理方法同1.3。
1.5 菌株GB519叶面喷施防控稻瘟病
在吉林省梨树县试验地连续2年(2020年和2021年)进行田间试验,该地为水稻病害常发区。水稻品种为‘吉粳88。设菌株GB519(1×108 cfu/mL)、75%肟菌·戊唑醇WG (15 g/667 m2)和清水对照3个处理,每667 m2按50 L水量均匀喷雾。小区处理面积100 m2,每处理5次重复,小区随机排列。在水稻抽穗前7月25日和齐穗期8月10日各施药1次。9月中旬调查穗茎瘟,每小区5点取样法,每点20穴,共100穴。穗茎瘟级别参照Meng等[17]的方法,病情指数和防治效果按下列公式计算。
病情指数=∑(各级发病数×各级代表值)/(调查总穗数×最高级代表值)×100;
防治效果=[(对照病情指数-处理病情指数)/对照病情指数)]×100%。
1.6 数据统计与分析
采用软件SPSS 26中单因素方差分析检验处理间是否存在显著性差异,采用Duncan氏新复极差法进行多重比较。显著水平设为α=0.05。
2 结果与分析
2.1 浸種处理后GB519-GFP在水稻植株中的定殖
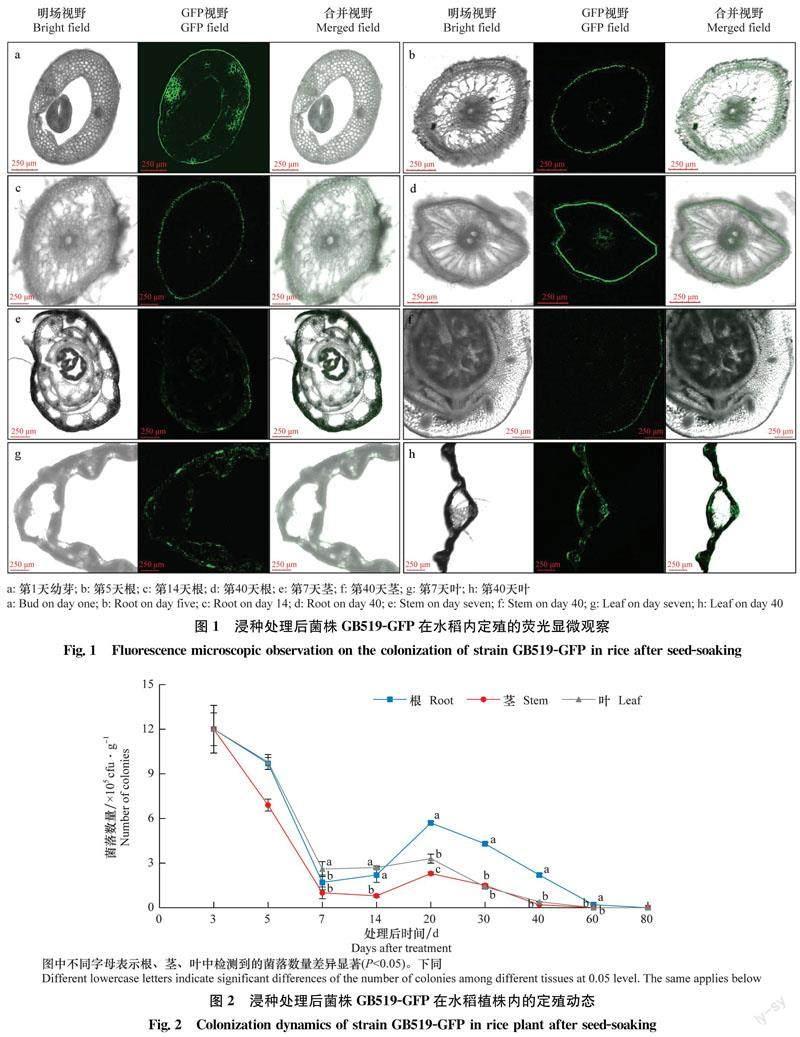
GB519-GFP发酵液浸种处理后1 d,从水稻种子未分化的嫩芽中就可以检测到明显的绿色荧光,均匀地分布于表皮和海绵薄壁组织的细胞间隙中(图1a)。处理后5、14 d和40 d,从根的表皮、皮层和维管束中可分别检测到明显的绿色荧光(图1b, c, d)。处理后7 d和40 d,从茎和叶中均能检测到绿色荧光(图1e, f, g, h),说明浸种处理的标记菌株已经在不同部位定殖。
菌株GB519-GFP浸种处理后,其在水稻植株中定殖数量的变化情况如图2所示。处理后20 d,根中定殖的菌株GB519-GFP的数量极显著高于茎和叶中的数量。处理后3 d,幼芽中检测到菌落数量为12.0×105 cfu/g,说明通过浸种处理有大量标记菌株进入水稻种子中。随着植株生长发育,菌株通过迁移扩展定殖于新生组织中,7~20 d各部位菌落数量的变化均趋于平缓。20 d时各部位菌落数量达到最高峰,其中根中的含菌量最多,为5.7×105 cfu/g。20~80 d各部位定殖量呈现递减趋势,处理后60 d,根中的定殖数量为0.2×105 cfu/g,茎和叶中未检测到菌株;80 d在各个部位都没有检测到菌株存在。
2.2 灌根处理后GB519-GFP在水稻植株中的定殖
用GB519-GFP发酵液灌根处理后1 d,仅从根的外表皮细胞间隙中检测到绿色荧光(图3a);处理后3 d和14 d,从维管束、中柱鞘及内皮层中检测到绿色荧光(图3b, c);处理后80 d,从根部仍能检测到明显的绿色荧光(图3d)。处理后7 d和40 d,从茎部检测到绿色荧光(图3e, f)。处理后1 d和60 d,叶部的泡状细胞、叶肉细胞中分别检测到了绿色荧光(图3g, h)。说明灌根处理标记菌株可定殖于植株各部位。
灌根处理后,GB519-GFP在水稻植株中定殖数量的变化情况如图4所示。根中定殖的菌株GB519-GFP的数量普遍高于茎和叶中的数量。灌根处理后1 d,从水稻根部可检测到大量GB519-GFP,菌量达到5.4×105 cfu/g。处理后5~14 d,在水稻幼苗的根部、茎部和叶部都检测到GB519-GFP,且菌量接近。处理后20 d,根、茎、叶中定殖的菌落数量达到最高峰,分别为8.0×105、3.8×105 cfu/g和4.4×105 cfu/g。20 d后各部位菌株定殖量都逐步下降,到处理后80 d,根中菌落数量仍可达1.9×105 cfu/g,而茎叶中含量接近于0。
2.3 叶面喷施处理后GB519-GFP在水稻植株中的定殖
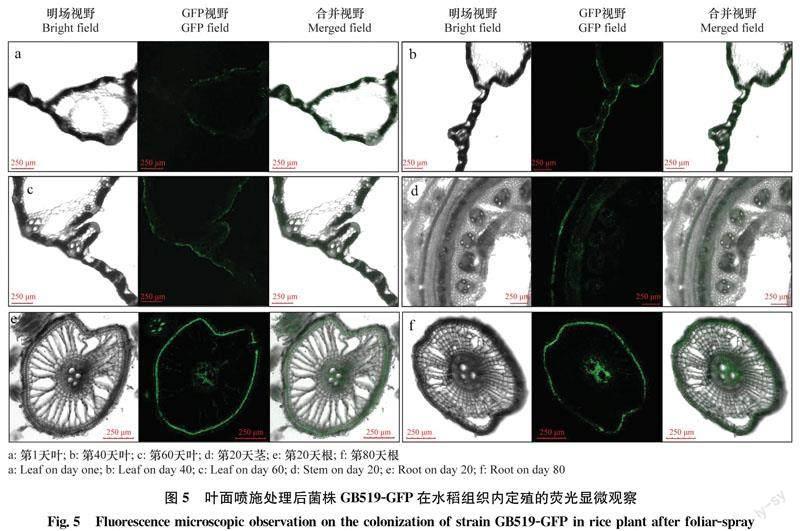
用GB519-GFP发酵液叶面喷施处理后1 d,在叶表面和表皮中都检测到较强的绿色荧光,表明菌株通过气孔和细微伤口进入水稻叶表皮之中,分布于上下表皮细胞间隙(图5a)。处理后40 d和60 d叶表皮中检测到绿色荧光度较强,表明菌株定殖量较大(图5b, c)。叶面喷施后20 d,从茎部维管束(图5d),根部表皮、皮层、维管束中都检测到较强的绿色荧光(图5e),表明标记菌株通过维管束在水稻植株内部迁移和扩展。而且叶面喷施后80 d,根部仍能检测到明显的绿色荧光(图5f),表明菌株定殖效果较显著。
叶面喷施处理后,GB519-GFP在水稻植株中定殖数量的变化如图6所示。处理后前5 d,叶片中定殖菌量呈现递减趋势,而根茎中菌量呈现递增趋势:处理后3 d茎中检测到菌落数量为0.2×105 cfu/g,处理后5 d根中检测到菌落数量为0.7×105 cfu/g。处理后20 d叶中检测到的菌落数量达到最高峰,为4.4×105 cfu/g。叶面喷施处理后,根中出现两个定殖高峰,分别为处理后14 d和60 d,定殖量分别为6.1×105 cfu/g 和5.2×105 cfu/g。特别是处理后80 d,根中菌量仍达3.1×105 cfu/g,但茎和叶中均未检测到标记菌株。这一结果与荧光检测结果相同。
2.4 枯草芽胞杆菌GB519对稻瘟病的防治效果
经过两年田间防治稻瘟病处理,枯草芽胞杆菌GB519叶面喷雾处理的病情指数分别为1.44(2020年)和1.60(2021年),防治效果分别达到73.9%(2020年)和74.5%(2021年)。同化学农药75%肟菌·戊唑醇WG防效76.6%(2020年)和75.6%(2021年)相比,防治效果没有显著差异(表1)。
3 结论与讨论
为保护生态环境、提高稻米品质,减少化学农药使用与降低残留,保障农业的可持续发展,越来越多的生防制剂产品应用于病害防控。由于枯草芽胞杆菌具有拮抗多种植物病原菌以及促进植物生长和提高作物产量的功能,是应用最多的菌种,成为生物防治的研究热点[18]。在研发新生物农药时,生防菌在作物中的内生定殖能力是影响其发挥作用的主要因子之一,定殖能力的强弱是评价其能否成为生物农药的重要指标[19]。本研究结合激光共聚焦显微镜观察和抗生素平板回收检测的方法,系统研究了GB519-GFP发酵液处理的水稻种子、根和叶片后,GB519在植株体内的定殖动态,结果表明菌株可定殖于植株的表皮、皮层、维管束中,揭示其可通过维管束在水稻植株内迁移和定殖。
枯草芽胞杆菌不仅可以在植物表面形成一层致密的生物膜,还可以进入植物内部定殖,起到阻止病原菌侵染、占据病原菌定殖的空间位点的作用[20-21]。稻瘟病菌主要侵染水稻的叶片、茎、节和花序等部位,可以通过自然孔口或直接降解角质层伤口穿透表皮的方式侵入,占据皮层细胞内或细胞间隙[22-23]。菌株GB519-GFP通过植物维管束进行扩展迁移运动。Hao等[24]研究发现,枯草芽胞杆菌B96-II发酵液灌根处理芦笋Asparagus officinalis时,菌株可以从根部侵入芦笋体内,经由维管束由根部向茎部迁移。在本研究中,使用枯草芽胞杆菌GB519-GFP发酵液灌根和叶面喷施两种常用手段处理水稻,处理后1 d就可发现标记菌株自根表或叶表侵入水稻体内,3~5 d后在非处理组织中发现标记菌株,分布于各器官表皮、外皮层、维管束等主要定殖位点。本研究证实了枯草芽胞杆菌GB519能够定殖于水稻植株根茎叶等部位,推测菌株GB519可能起到阻止病原菌侵入的作用。
Walker等[25]等研究发现,枯草芽胞杆菌L-forms作为植物的共生菌在白菜种子萌发过程中,抑制了随后接种的灰霉病菌孢子的萌发,对种子起到了保护作用。而使用枯草芽胞杆菌GB519发酵液浸种处理水稻种子后,发芽后标记菌株能定殖于水稻幼苗的各个组织部位,并伴随幼苗生长分布于所有新生组织中,为水稻种子发芽后防止病菌侵染提供保护作用。
生防芽胞杆菌能在多种植物上定殖,定殖量直接影响到防治效果,定殖的时长决定了防治效果的持续性[26-27]。穆常青等[28]用枯草芽胞杆菌B-332在叶面喷施处理水稻,21 d后叶片表面仍能检测到1.25×104 cfu/mm2的活菌,对稻瘟病防效为45.23%。Wang等[4]发现芽胞杆菌TUBP1在棉花中定殖时长超过45 d,对棉花黄萎病防效为55.21%。何朋杰等[29]在大白菜叶面喷施XF-1-gfp,处理后1 d样品检测到了标记菌(104 cfu/g),45 d后保持103 cfu/g的菌量。本试验用枯草芽胞杆菌GB519发酵液进行浸种、灌根和叶面处理,通过抗性平板检测,展示了不同处理根、茎、叶中菌株GB519-GFP的定殖量随时间的动态变化情况,结果显示不同处理方法GB519-GFP在各部位的定殖量几乎均在处理后20 d达到峰值,可为病害防控时间节点提供参考。在处理后较短时间内定殖量达到峰值,并且在处理后各组织中能持续检测到一定数量的标记菌株,表明菌株GB519具有较强定殖能力且防治作用可以维持较长时间。田间防控稻瘟病试验达到74%以上的防效也证明了枯草芽胞杆菌GB519具有显著预防和治疗稻瘟病的作用。而且,与之前报道的文献相比,菌株GB519具有更长的内定殖时长和内定殖能力。
由不同方式处理后7 d菌株GB519-GFP的定殖量可知,与灌根和浸种处理相比,叶面喷施在水稻叶片中定殖的菌量更多。叶面喷施处理后,根中菌落数量出现两个高峰,分别为处理后14 d和60 d,菌落数量分别为6.1×105 cfu/g和5.2×105 cfu/g。出现两次菌量高峰可能与环境的变化有关,具体的原因需要进一步的试验验证。第一次高峰可能是由于菌株GB519-GFP對根环境更适应,因而不断地增殖扩大菌体数量;第二次高峰可能是由于水稻植株已经处于生长后期,叶片和茎中的营养逐渐减少不适宜菌株的生长增殖,菌株逐渐由叶和茎中转移到根中生长增殖。植物病害生物防治的成功与否与引入生防菌株的定殖能力强弱有关,因此叶面喷施的处理方式对水稻稻瘟病的防治效果最佳。本研究为揭示枯草芽胞杆菌GB519的内生定殖能力和选择有效使用方法防控稻瘟病提供了科学参考。
参考文献
[1] ZHANG Hongyin, GODANA E A, SUI Yuan, et al. Biological control as an alternative to synthetic fungicides for the management of grey and blue mould diseases of table grapes: a review [J]. Critical Reviews in Microbiology, 2020, 46(4):450-462.
[2] BLAKE C, CHRISTENSEN M N, KOVCS A T. Molecular aspects of plant growth promotion and protection by Bacillus subtilis [J]. Molecular Plant-Microbe Interactions, 2021, 34(1): 15-25.
[3] 董丽红, 郭庆港, 张晓云, 等. 棉花根系分泌物对枯草芽胞杆菌NCD-2生物膜形成和根际定殖的影响[J]. 植物病理学报, 2015, 45(5): 541-547.
[4] WANG Bo, WAN Chuanxing, ZENG Hong. Colonization on cotton plants with a GFP labeled strain of Bacillus axarquiensis [J]. Current Microbiology, 2020, 77(10): 3085-3094.
[5] 高毓晗, 李世东, 郭荣君. sfp基因转化增强了Bacillus subtilis 168的定殖能力和对黄瓜茎内枯萎病菌的抑制作用[J]. 中国生物防治学报, 2016, 32(1): 76-85.
[6] ZABIHULLAH S, 杨娜, 张静, 等. 棉花内生解淀粉芽孢杆菌489-2-2对棉花黄萎病的防效研究[J]. 核农学报, 2021, 35(1): 41-48.
[7] 隋丽, 徐文静, 张正坤, 等. GFP标记的球孢白僵菌在玉米中的定殖[J]. 中国生物防治学报, 2018, 34(6): 848-857.
[8] 薛松, 汪军, 王国芬, 等. 解淀粉芽胞杆菌的GFP标记及定殖能力[J]. 热带作物学报, 2017, 38(3): 551-558.
[9] 田涛, 王琦. 绿色荧光蛋白作为分子标记在微生物学中的应用[J]. 微生物学杂志, 2005, 25(1): 68-73.
[10]LIU Xuming, ZHAO Hongxing, CHEN Sanfeng. Colonization of maize and rice plants by strain Bacillus megaterium C4 [J]. Current Microbiology, 2006, 52(3): 186-190.
[11]沙月霞, 隋书婷, 曾庆超, 等. 贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力[J]. 中国农业科学, 2019, 52(11): 1908-1917.
[12]朱峰, 王继春, 田成丽, 等. 枯草芽胞杆菌GB519抗菌蛋白的理化性质及生防效果[J]. 中国生物防治学报, 2020, 36(5): 778-785.
[13]ZHU Feng, WANG Jichun, JIA Yulin, et al. Bacillus subtilis GB519 promotes rice growth and reduces the damages caused by rice blast fungus Magnaporthe oryzae [J]. PhytoFrontiers, 2021, 1(4): 330-338.
[14]SOROKAN A, BENKOVSKAYA G, BURKHANOVA G, et al. Endophytic strain Bacillus subtilis 26DCryChS producing Cry1Ia toxin from Bacillus thuringiensis promotes multifaceted potato defense against phytophthora infestans (Mont.) de Bary and pest leptinotarsa decemlineata Say [J/OL]. Plants, 2020, 9(9): 1115. DOI: 10.3390/plants9091115.
[15]杨珍福, 何鹏飞, 吴毅歆, 等. 烟草内生细菌YN2014042对烟草、玉米的定殖和促生作用研究[J]. 中国农学通报, 2021, 37(12): 98-105.
[16]SHA Yuexia, ZENG Qingchao, SUI Shuting. Screening and application of Bacillus strains isolated from nonrhizospheric rice soil for the biocontrol of rice blast [J]. The Plant Pathology Journal, 2020, 36(3): 231-243.
[17]MENG Xiangkun, YU Junjie, YU Mina, et al. Dry flowable formulations of antagonistic Bacillus subtilis strain T429 by spray drying to control rice blast disease [J]. Biological Control, 2015, 85: 46-51.
[18]RAIS A, SHAKEEL M, MALIK K, et al. Antagonistic Bacillus spp. reduce blast incidence on rice and increase grain yield under field conditions [J]. Microbiological Research, 2018, 208: 54-62.
[19]CAI Xunchao, KANG Xingxing, XI Huan, et al. Complete genome sequence of the endophytic biocontrol strain Bacillus velezensis CC09[J/OL]. Genome Announcements, 2016, 4(5): e01048-16. DOI: 10.1128/genomeA.01048-16.
[20]申紅妙, 李正楠, 贾招闪, 等. 内生枯草芽胞杆菌JL4在葡萄叶上的定殖及其对葡萄霜霉病的防治[J]. 应用生态学报, 2016, 27(12): 4022-4028.
[21]GINGICHASHVILI S, DUANIS-ASSAF D, SHEMESH M, et al. The adaptive morphology of Bacillus subtilis biofilms: a defense mechanism against bacterial starvation [J/OL]. Microorganisms, 2020, 8(1): 62. DOI: 10.3390/microorganisms8010062.
[22]WILSON R A, TALBOT N J. Under pressure: investigating the biology of plant infection by Magnaporthe oryzae [J]. Nature Reviews Microbiology, 2009, 7(3): 185-195.
[23]VANVU B V, ITOH K, NGUYEN Q B, et al. Cellulases belonging to glycoside hydrolase families 6 and 7 contribute to the virulence of Magnaporthe oryzae [J]. Molecular Plant-Microbe Interactions, 2012, 25(9): 1135-1141.
[24]HAO Bianqing, MA Liping, QIAO Xiongwu. Quantitative analysis of the migration and accumulation of Bacillus subtilis in Asparagus officinalis [J]. Current Microbiology, 2015, 71(3): 357-362.
[25]WALKER R, FERGUSON C M J, BOOTH N A, et al. The symbiosis of Bacillus subtilis L-forms with Chinese cabbage seedlings inhibits conidial germination of Botrytis cinerea [J]. Letters in Applied Microbiology, 2002, 34(1): 42-45.
[26]KAMILOVA F, VALIDOV S, AZAROVA T, et al. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria [J]. Environmental Microbiology, 2005, 7(11): 1809-1817.
[27]何朋杰, 崔文艷, 何鹏飞, 等. 表面活性素促进枯草芽胞杆菌XF-1在大白菜叶际定殖能力研究[J]. 植物保护, 2021, 47(5): 28-34.
[28]穆常青, 刘雪, 陆庆光, 等. 枯草芽孢杆菌B-332菌株对稻瘟病的防治效果及定殖作用[J]. 植物保护学报, 2007, 34(2): 123-128.
[29]何朋杰, 崔文艳, 何鹏飞, 等. 叶面喷施枯草芽胞杆菌XF-1防治大白菜根肿病[J]. 植物保护, 2019, 45(1): 104-108.
(责任编辑:杨明丽)

