甘蔗镰孢菌插入突变体库的构建、致病变异突变体筛选及突变基因定位
蒙姣荣 黄海娟 杨惠贞 曾泉 李珅雨 陈保善


关键词:甘蔗镰孢菌;农杆菌介导;遗传转化;致病力相关基因;侧翼序列;甘蔗梢腐病
中图分类号:S435.661 文献标识码:A
甘蔗梢腐病(pokkah boeng disease, PBD)是甘蔗重要的真菌性病害之一,在我国主要甘蔗产区普遍发生,且有逐年上升的趋势[1]。通常年份甘蔗梢腐病可使甘蔗减产5%~20%,发病严重的年份可减产30.2%~48.5%,糖分降低2.63%~5.21%,造成甘蔗产量及糖分巨大损失[1-2]。有效防治甘蔗梢腐病已成为目前确保甘蔗糖产业稳定发展急需解决的主要问题之一。
甘蔗镰孢菌(Fusarium sacchari)最早从甘蔗上分离出来,其有性阶段为甘蔗赤霉菌(Gibberellasacchari),是甘蔗梢腐病优势病原菌[3-6];此外,甘蔗镰孢菌还是甘蔗枯萎病(sugarcane wilt)的病原菌,该病害对甘蔗产量及其糖含量的影响比甘蔗梢腐病的更为严重,是一种毁灭性病害[7-8]。在我国,有从小麦赤霉病样品上分离到甘蔗镰孢菌的报道[9],在香蕉果实和叶片上也经常分离到甘蔗镰孢菌[10-11]。目前,针对甘蔗镰孢菌的致病分子机理研究十分有限,已有的文献涉及铁红素合成酶基因功能鉴定、产生毒素种类鉴定和携带真菌病毒种类鉴定等[5, 12-13]。最近的文献报道,在甘蔗镰孢菌与甘蔗互作的研究中鉴定获得一批甘蔗镰孢菌的效应蛋白[14-16]。
农杆菌介导的遗传转化(Agrobacterium tumefaciens-mediated transformation, ATMT)是获得随机插入突变体的主要遗传手段之一,其转化起始材料通常不需经过去除细胞壁,如分生孢子、菌丝体均可用于转化,操作简便;同时具有转化率高及多为单拷贝插入等优点,被广泛应用于真菌功能基因的研究[17-19],在包括镰孢菌在内的多种植物病原菌致病基因功能及其致病机制的研究中已有较多成功应用的报道[20-22]。王鑫等[23]采用ATMT 技术构建了的甘蔗梢腐病菌CNO-1 菌株的突变体库,并针对生长速度减慢突变体的插入位点序列进行分析。本课题组于2016—2018 年对广西甘蔗梢腐病发生情况进行全面调查,并对其病原菌进行鉴定,明确甘蔗镰孢菌是广西甘蔗梢腐病菌的优势病原菌种类[6],并对分离获得的强致病力代表性菌株FF001 进行了全基因组序列测定(尚未发表)。本研究采用ATMT 技术构建菌株FF001 的突变体库,筛选致病力差异较大的突变体,并对突变基因进行定位分析,以期为克隆致病相关基因提供研究材料,为甘蔗镰孢菌的致病分子机理研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 供試菌种、质粒与甘蔗品种 甘蔗镰孢菌FF001 菌株为本课题组从具有典型梢腐病症状的甘蔗病株上分离纯化并保存[6] ; 大肠杆菌(Escherichia coli)Trans1-T1 感受态和pEASY-T1Clonging Kit 购自北京全式金生物技术有限公司;根癌农杆菌(Agrobacterium tumefaciens)菌株AGL-1 , 携带潮霉素B 磷酸转移酶基因的pTHR1-AH 质粒由本实验构建并保存。甘蔗品种‘中蔗9 号为甘蔗梢腐病感病品种,用于致病力测定。
1.1.2 主要试剂 抗生素利福平(rifampicin,Rif)、氨苄青霉素(ampicillin, Amp)、壮观霉素(spectinomycin, Spe)、头孢霉素(cefalosporiner,Cef)、潮霉素 B(hygromycin B, Hyg B)、乙酰丁香酮(acetosyringone, AS)和2-(N-马啉)乙基磺酸[2-(N-morpholino) ethane-sulfonic acid,MES]均购自北京索莱宝科技有限公司。琼脂糖凝胶DNA 回收试剂盒购自天根生化科技(北京)有限公司,质粒小量提取试剂盒购自南京诺唯赞生物科技股份有限公司;DIG Wash and Block BufferSet 试剂盒和DIG High Prime DNA Labeling andDetection Starter Kit II 试剂盒购自罗氏公司。2×EsTaq Master Mix 购自北京全式金生物技术有限公司,马铃薯葡萄糖琼脂培养基(PDA)购自美国BD 公司(Becton, Dickinson and Company),其他试剂均为国产分析纯。引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 根癌农杆菌介导的甘蔗镰孢菌遗传转化
参照文献[23]的方法进行遗传转化,并稍作修改。具体步骤: 将携带pTHR1-AH 质粒的农杆菌AGL-1 菌株在LBA 培养基(Rif、Amp 和Spec终浓度均为50 μg/mL)上划线,28℃培养2 d 后挑取单菌落接种到MM 液体培养基中(Rif、Amp和Spec 终浓度均为50 μg/mL),28℃条件下振荡培养(200 r/min)2 d,4500 r/min 室温离心5 min,用1 mL IM 培养基重悬菌体,并稀释至浓度OD600为0.1,加入AS(终浓度为200 μmol/L),28℃,振荡培养48 h(200 r/min);配制浓度为1×104个/mL 的新鲜甘蔗镰孢菌分生孢子悬浮液,与上述步骤获得的农杆菌菌液按1∶1 比例混合,涂布于IM 固体培养基表面的0.45 μm 孔径微孔滤膜上,25℃条件下共培养2 d;将微孔滤膜转移至筛选PDA 培养基上(含400 μg/mL Cef 和50 μg/mL HygB),并在微孔滤膜上加一层筛选PDA 培养基(含400 μg/mL Cef 和100 μg/mL Hyg B),25℃培养2~3 d 即有可见转化子长出,将转化子转移到新的筛选PDA 培养基上(Cef 400 μg/mL,Hyg B100 μg/mL),25℃培养2~3 d,再次转移到另一新的筛选PDA 培养基上(含Cef 400 μg/mL,Hyg B50 μg/mL),25℃培养4~5 d。经过3 次筛选可在含50 μg/mL Hyg B PDA 培养基上正常生长的转化子即认定为稳定遗传转化子,即可保存备用。
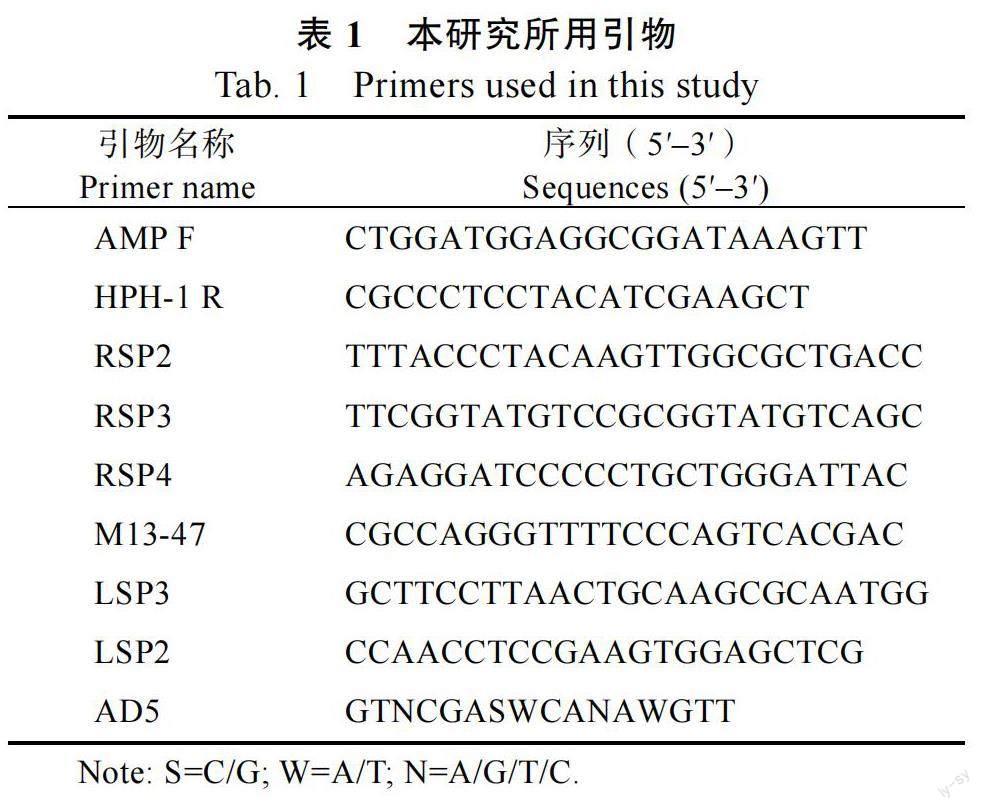
1.2.2 突变株总DNA 的提取及分子鉴定 用CTAB 法提取野生型菌株和突变株的基因组DNA。突变株的PCR 鉴定:以野生型菌株FF001和突变株的基因组DNA 作为模板,使用特异性引物AMP F/HPH-1 R(表1)进行PCR 扩增,反应体系总体积25 μL:2×Ex Taq Master Mix 12.5 μL;10.0 μmol/L 引物AMP F 1.0 μL;10.0 μmol/L 引物HPH-1 R 1.0 μL;DNA 模板(20~50 ng/μL)1.0 μL,ddH2O 9.5 μL。反应条件:95℃预变性5 min,94℃变性1 min,60℃退火1 min,72℃延伸1 min,运行30 个循环,72℃延伸10 min。Southern 杂交分析:大量提取野生型菌株和突变的基因组DNA(50 μg),分别用快速限制性内切酶Xba I 进行单酶切,在37℃恒温条件下反应过夜,酶切产物经氯仿抽提2 次后取上清加入2 倍体积的无水乙醇和3 mol/L 醋酸钠溶液,充分混匀,–80℃超低温冰箱放置30 min,4℃,12 000 r/min离心15 min,弃上清液;再加入500 μL 75%的乙醇溶液洗涤沉淀2 次,自然晾干,加入35 μLddH2O 溶解,取25 μL 进行琼脂糖凝胶电泳并转膜。以质粒pTHR1-AH 为模板,用引物AMPF/HPH-1 R 进行扩增获得的DNA 片段作为探针,参照罗氏公司地高辛试剂盒说明书进行标记,杂交。按照DIG Wash and Block Buffer Set 试剂盒说明书进行洗膜等。用LAS500 超灵敏化学发光成像仪成像分析杂交结果。
1.2.3 突变体致病力的测定 参照WANG 等[24]接种叶片的方法进行突变株的致病力测定。突变体及野生型菌株分别接种于PDA 平板上,28℃培养4~5 d,在菌落边缘取直径0.6 cm 的菌丝圆片;选取生长4~8 个月,健康甘蔗植株(‘中蔗9 号)完全展开的+1 或+2 位叶片,弃其基部约10 cm,依次剪取约6 cm 叶片(一张叶片约8 个叶片节段),从叶片边缘垂直中脉方向剪一切口(切口大约为1.0 cm),将菌丝圆片覆盖在切口上,保湿,28℃条件下培养3~4 d,记录病斑出现时间,测量病斑直径,每个突变株接种3 张叶片。经过3 次致病力测定获得遗传稳定的致病变异突变株:第一次初筛使用突变库所有突变株进行致病力测定,第二次复筛使用第一次初筛致病力有明显变化(增强或减弱)的突变株,第二次复筛获得的致病力有明显变化的突变株经过单孢分离后进行第三次致病力测定,当1 个突变株的3 个以上的单孢分离株均表现为致病力有明显变化且表现一致时(即所有单孢分离株致病力全部变弱或全部增强)确定为致病变异突变株,并用于插入位点序列扩增与基因定位分析。
1.2.4 致病变异突变体T-DNA插入位点侧翼序列的扩增与突变基因定位 使用AD5 随机引物和右边界(right border, RB)及左边界(left border,LB)序列的特异引物,参照文献[25-26]采用热不对称交错PCR(thermal asymmetric interlaced PCR,TAIL-PCR)方法对突变体的T-DNA 侧翼序列进行扩增。第一轮反应以突变株总DNA 作为模板,简并引物AD5 与特异引物RSP4(RB 侧翼序列)或M13-47(LB 侧翼序列)为引物;以第一轮反应的PCR 产物(稀释50 倍)作为模板进行第二轮反应,引物为AD5 与RSP3 或LSP3;以第二輪反应的PCR 产物(稀释50 倍)作为模板进行第三轮反应,引物为AD5 与RSP2 或LSP2。TAILPCR 结束后取5.0 μL 第二轮和第三轮PCR 的扩增产物,在1.5 %琼脂糖糖凝胶进行电泳分析,使用琼脂糖凝胶DNA 回收试剂盒对第二轮或第三轮PCR 产物进行纯化回收,与pEASY-T1 载体连接并转化大肠杆菌Trans1-T1 感受态,质粒小量提取试剂盒提取阳性克隆并测序。利用SNAP.GENE 软件上查找所获得序列的特异引物(RSP3 或RSP2、LSP3 或LSP2)及T-DNA 的RB 和LB 侧翼序列,并与甘蔗镰孢菌FF001 的基因组序列(尚未发表数据)比对,结合NCBI(https://www.ncbi.nlm.nih.gov)比对结果,确定插入位点基因及其功能。
2 结果与分析
2.1 农杆菌介导的甘蔗镰孢菌的遗传转化
使用携带潮霉素抗性基因pTHR1-AH 质粒的农杆菌AGL-1 菌株介导转化甘蔗镰孢菌分生孢子,在含Hyg B的筛选PDA 培养基依次进行3次筛选(前2 次Hyg B 浓度为100 μg/mL,第三次为50 μg/mL),获得3018 个稳定遗传的Hyg B抗性转化子,依次命名FsAT0001~FsAT3018。随机提取50 个转化子接种于不含Hyg B 的PDA 上,28℃条件下培养7 d 后进行培养性状观察。结果显示,大部分转化子的在PDA 上的生长速率和菌落形态与野生型菌株FF001 的未有明显区别,少数转化子表型与野生型相比表现很大的差异,表现为生长速率减慢、生长衰减和产生色素等(图1)。
2.2 转化子分子鉴定
为确定获得的转化子是否携带潮霉素抗性基因及其插入拷贝数,依据pTHR1-AH 双元表达载体的序列(图2A)设计引物AMP F/HPH-1 R,随机挑选12 个转化子提取总DNA 进行PCR 检测。结果显示,所有检测转化子和pTHR1-AH 阳性对照均能扩增出约1900 bp 特异性目标条带,而野生型菌株FF001 没有扩增任何可见条带(图2B);同样地,以AMP F/HPH-1 R 为引物,扩增pTHR1-AH 获得的DNA 作为探针进行Southern杂交,测试的4 个转化子均出现杂交条带,野生型菌株FF001 没有杂交条带(图2C),说明T-DNA片段已经整合在FF001 菌株基因组上。统计12个转化子的Southern 杂交结果,有9 个突变株的T-DNA 为单拷贝插入,3 个突变株为双拷贝插入,未观察到3 个及以上拷贝插入。
2.3 致病变异突变体的筛选
为获得甘蔗镰孢菌致病相关基因,采用叶片离体接种法进行3 次筛选,测定了所有3018 个转化子的致病力。接种野生型菌株FF001 3~4d后,甘蔗叶片表现出黄色的坏死斑,病斑长度在2.0~3.0 cm 之间;有21 个突变株表现为致病力下降(如图3 中FsAT1336、FsAT2953 和FsAT3001 菌株),接种3~4d后,病斑长度在1.0~2.5 cm 之间;此外,有9 个突变株表现为致病力增强(如图3 的FsAT0444 和FsAT1899 菌株),接种3 d 后即可产生明显的病斑,病斑长度超过3.5 cm;其余的大部分转化子致病力未有明显变化(图3 的FsAT0126菌株),病斑产生的时间其大小与野生型菌株相比无明显差异(图3)。
2.4 致病变异突变体插入位点侧翼序列扩增
为明确致病变异突变体T-DNA 插入位点的侧翼序列,提取所有30 个致病变异突变体总DNA,采用TAIL-PCR 的方法分别插入位点的侧翼序列进行3 轮PCR 扩增。分别取第二轮或第三轮PCR产物进行琼脂糖凝胶电泳检测。结果显示,共有27 个突变株在第二轮或者第三轮PCR 后获得清晰的特异条带,其中有12 个突变体的左右边界侧翼序列均能有效扩增,其余突变株只能单一的侧翼序列;3 个突变株(FsAT0007、FsAT0017和FsAT1019)未能有效扩增出侧翼序列片段;部分突变株第三轮TAIL-PCR 后仍有2~3 条清晰条带。图4 为部分突变株第二轮或第三轮反应后的PCR 产物的电泳凝胶图。
2.5 致病变异突变体插入位点T-DNA边界序列特点
将TAIL-PCR 产物回收纯化后测序,对扩增出2 条及以上条带的转化子,剔除片段较短或T-DNA 边界序列不完整的序列,最终获得39条有效序列,其中RB 侧翼序列24 条,LB 侧翼序列15 条。为确定T-DNA 整合到甘蔗镰孢菌基因组中的方式,将侧翼序列分别与载体pTHPR1-AH的T-DNA 序列比对,发现在24 条RB 侧翼序列中,RB 边界序列完整的有20 条,占比83.3%(未显示)。相反,在15 条LB 侧翼序列中,LB 边界序列完整的仅有5个,占比33.3%,其余序列的LB 边界均有不同程度的截短,其中FsAT0372 突变株LB 边界序列缺失片段最长,为64 bp(图5)。
2.6 致病变异突变体突变基因的定位及其功能
将侧翼序列与甘蔗镰孢菌FF001 菌株基因组序列进行比对,结合NCBI 比对结果,获得突变及其对应基因的功能注释。与FF001 基因组序列进行比对结果显示,FsAT2418 突变株RB 和LB侧翼序列分别与2 条不同contig(contig00006 和contig00011)上的序列对应,其余突变株的侧翼序列均对应于FF001 基因组的单一序列,分布在9 条contig 上;对同时获得RB 和LB 侧翼序列的12 个突变体的插入位点进一步分析,发现在突变体FsAT3008 中,T-DNA 插入为直接插入;在FsAT1780 和FsAT2324 中,T-DNA 插入造成22~23 bp 的小片段基因组缺失,而其余突变株中,TDNA插入均可造成基因组较大片段的缺失,其大小在2202~6129 bp 之间。此外,突变株FsAT0213 和FsAT1666 的RB 插入位点相同,FsAT1899 和FsAT2418 RB、FsAT0166 RB 和FsAT1899 LB 分别插入同一基因的不同位点(图6)。
将获得的39 条单一侧翼序列,在NCBI 上进行同源序列搜索,并进行插入位点分析,结果显示有19 个T-DNA 插入位点位于相应基因的编码区,16 个T-DNA 插入位点位于相应基因的启动子区域,2 个T-DNA 插入位点位于终止子区,另有2 个T-DNA 插入位点位于基因间隔区(表2)。甘蔗镰孢菌基因功能注释结果显示,插入位点的基因分别编码22 个已知功能蛋白和16 个未知功能蛋白,其中致病力减弱突变体的插入位点基因编码的蛋白功能可以分成6 类,第一类为参与物质转运与代谢相关的蛋白(7 个),包括 α-甘露糖苷酶(alpha-mannosidase)、中性氨基酸渗透酶(neutral amino acid permease)、寡聚高尔基复合体成分4(oligomeric golgi complex component 4)、寡肽转运蛋白(oligopeptide transporter, OPT)、酰基辅酶A 脱氢酶(acyl-CoA dehydrogenase)、乙酰乙酰-CoA 合成酶(acetoacetyl-CoA synthetase)和类驱动蛋白bimC(kinesin-related proteinbimC);第二类为转录因子(4 个),包括锌指蛋白ASD4(zinc finger protein ASD4)、转录起始因子TFIID(transcription initiation factor TFIID)、角质酶G-box 结合蛋白(cutinase G-box bindingprote in, CGBP)、吖啶黄素敏感性控制蛋白(acriflavine sensitivity control protein ACR-2);第三类为分子伴侣(2 个),NVL 蛋白(nuclearVCP-like protein)和热激蛋白HSP30(heat shockprotein 30);第四类为参与RNA 降解的核糖核酸外切酶(exoribonuclease),第五类为参与DNA损伤修复的DNA 聚合酶η(DNA polymerase eta),第六类为未知功能蛋白(10 个)(表2);此外,FsAT0082 缺失片段包含的基因编码存活因子1(survival factor 1, SVF1),FsAT1832 缺失片段包含 的 基 因 編 码 乙 醛 脱 氢 酶 ( aldehyde dehydrogenase, ALDH ), 其余突变株( FsAT0124 、FsAT0166、FsAT0372 和FsAT3001)缺失片段分别编码4 个未知功能蛋白基因。致病力增强突变株的插入位点基因则分别编码碳酐酸酶(carbonicanhydrase)、Bud 10 蛋白(Bud 10 protein)、硫氧还蛋白(thioredoxin)、硒蛋白(selenoprotein)、2C 型蛋白磷酸酶(type 2C protein phosphatase,PP2C)和2 个未知功能蛋白。T-DNA 插入基因的编码区或者引起基因的缺失,可以直接破坏基因的功能,而插入位点为基因启动子区和终止子区的突变体有可能是通过影响目标基因的表达从而影响突变体的致病力。
3 讨论
甘蔗镰孢菌是广西甘蔗梢腐病的优势病原菌[6],其致病分子机理研究鲜有报道。本研究以强致病力菌株FF001 为出发菌株,采用ATMT 技术构建了库容量为3018 个突变株的突变体库,筛选获得30 个致病变异突变体,并对插入位点基因进行的定位与分析,获得一批可能的致病相关基因,为甘蔗镰孢菌致病基因功能研究,阐明其致病分子机理提供了直接、可靠的试验材料。
在构建突变体过程中,曾尝试完全参照王鑫等[23]描述的方法构建突变体库,甘蔗镰孢菌分生孢子与农杆菌共培养后将微孔滤膜转移到筛选PDA 培养基培养2 d,直接挑取转化子,转化多批次均未能获得真正的转化子。随后改为在微孔滤膜上加盖一层含Hyg B(100 μg/mL)的PDA筛选培养基,25℃条件下培养2 d 即有可见单个转化子长出,经过3 次Hyg B 抗性筛选获得遗传稳定的转化子。随机挑选转化子进行PCR 检测和Southern 杂交,结果显示全部为阳性转化子,说明改进后所获得的文库质量较好。
TAIL-PCR 技术是扩增插入序列T-DNA 未知侧翼序列的常用方法[26-27]。本研究采用TAIL-PCR对30 个突变株插入位点侧翼序列进行扩增,获得24 个RB 侧翼序列和15 个LB 侧翼序列,绝大多数RB 侧翼序列保留完整的右边界序列;相反,在15 个LB 侧翼序列中,只有5 个的T-DNA 左边界被完整保留下来,其余的均存在不同程度的截短,研究结果与其他真菌的ATMT 转化结果[28-29]相似。姚姿婷[25]使用特异引物与简并引物AD5对板栗疫病菌突变体的RB 和LB 侧翼序列进行TAIL-PCR 扩增,均有较好的扩增效果;本研究使用AD5 与特异引物对所有突变体进行TAIL-PCR 扩增,获得24 条RB 侧翼序列,成功率80.0%,说明AD5 同样适用于扩增甘蔗镰孢菌突变体的侧翼序列。
转录因子在植物病原真菌的生长发育和致病过程中发挥重要作用[30]。稻瘟病菌(Magnaportheoryzae)锌指蛋白ADS4 属于GATA 型转录因子,ADS4 基因的缺失导致突变体孢子萌发后不能膨大形成附着胞[31] 。稻曲病菌( Ustilaginoideavirens)角质酶G-box 位点结合蛋白UvCGBP1 则属于C2H2型转录因子,通过介导MAPK 途径相关基因的表达调控其致病力[32]。生存因子SVF1最早在酿酒酵母(Saccharomyces cerevisiae)中被鉴定,与人类抗凋亡基因Bcl-XL 存在一定功能互补,是酿酒酵母在氧化应激下生存所必需[33]。在禾谷镰刀菌(Fusarium graminearum)中SVF1 同源基因FgSVF1 缺失会导致其致病力完全丧失[34],将核盘菌(Sclerotinia sclerotiorum)SsSVF1 基因沉默也降低其致病力[35]。氨基酸渗透酶也称氨基酸转运蛋白(amino acid transporter),主要参与生物体的氨基酸进行吸收和转运,直接调节细胞内氨基酸种类和浓度,在细胞生长发育中起到重要调节作用[36]。有多种氨基酸渗透酶在新型隐球菌(Cryptococcus neoformans)致病过程起到重要作用[37];在稻瘟病菌中,单缺失3 个普通氨基酸渗透酶MoGAP1~MoGAP3 基因的突变株表现为生长速度减小、致病力下降[38-39]。寡肽转运蛋白广泛存在于真菌、植物和细菌中,主要转运3~6 肽或更长的寡肽。已有研究表明, CgOPT1 和CgOPT2 参与胶孢炭疽菌(Colletotrichum gloeosporioides)的生长发育和致病过程[40-41]。乙醛是多种基本代谢途径的中间体,其过高的生理浓度会对细胞生长、存活和膜完整性产生负面影响。乙醛脱氢酶是一类进化上保守的依赖酶NADP+多态性酶,可将乙醛不可逆氧化为乙酸,直接调节细胞内乙醛的浓度。在稻瘟菌中,通过RNAi(RNA interference)方法沉默3 个乙醛脱氢酶编码基因,其突变株的产孢量、抗逆性和致病力均明显降低[42]。本研究部分致病力减弱突变株插入位点基因或缺失基因分别编码乙醛脱氢酶、锌指蛋白ASD4、角質酶G-BOX 结合蛋白、寡肽转运蛋白、存活因子1 和氨基酸渗透酶等,推测可能是T-DNA 插入导致上述基因功能缺失或表达量降低。PP2C 是一个多成员蛋白家族,具有独特的N 端延伸,以单体酶形式存在,广泛存在于动物、植物、细菌及真菌中,参与调控生物体内的多个生命活动过程[43]。在灰葡萄孢菌(Botrytis cinereal)和尖孢镰孢菌中,PP2C 基因的缺失均可导致致病力减弱[43-44]。不同的PP2C 调控作用有一定的差异。如在酵母中的PTC1 负向调控HOG(high-osmolarity glycerol)信号途径,而其同源基因在灰葡萄孢菌中起到正向调控作用[43]。本研究突变株FsAT1923 T-DNA 的插入造成1 个PP2C基因的大片段缺失,其致病力增强,推测该基因在甘蔗镰孢菌的致病过程起到负向调控作用,使得基因缺失后其致病力增强。其他突变株的插入位点基因,如编码甘露糖苷酶、吖啶黄素敏感性控制蛋白和核类VCP 蛋白等基因在植物病原菌致病过程中的作用研究尚无报道,而编码未知功能蛋白的基因可能是甘蔗镰孢菌新的或特异的致病相关基因,今后将通过基因敲除、功能回补等遗传学试验对上述基因的功能进一步验证与分析。本课题组已经构建了编码碳酐酸酶和寡肽转运蛋白基因的缺失突变株,用菌饼进行离体接种,前者表现为致病力增强,后者表现为致病力减弱(数据另文发表),与T-DNA 插入突变株表现结果一致,说明本研究经过3 轮的致病力测定,获得的致病突变株遗传稳定,为甘蔗梢腐病的致病相关基因功能研究提供了切实可靠的研究材料。
本研究获得的致病变异突变体中没有完全丧失致病力的突变体,可能与本研究采用离体叶片接种方法有关。在田间,甘蔗梢腐病菌主要通过分生孢子进行传播,在适宜环境条件下萌发后才实现其侵染过程[45],而人工接种过程中,剪叶形成的伤口利于病原菌侵染,难于判断因分生孢子萌发不同进而影响病原菌侵染的突变体。此外,直接使用带有病原菌的菌饼接种,接种体包括菌丝体和分生孢子,接种量较大,野生型菌株和突变体接种后症状表现差异不明显,筛选不到致病力变化不显著的突变体,这结果与橡胶树胶孢炭疽菌T-DNA 致病缺陷转化子筛选中遇到的情况[46]相似。还需提到的是,在稻瘟菌中,硫氧还蛋白MoTrx2 与转录因子MoAP1 互作调控稻瘟菌在寄主植物细胞的穿透和侵染型菌丝生长,进而影响其致病力[47];一个定位于线粒体的β-CA 基因缺失后,其分生孢子萌发率和致病力均明显下降[48]。本研究的FsAT2324 突变株中插入位点为一个编码硫氧还蛋白基因的编码区,其致病力增强;突变株FsAT1899 和FsAT2418 的T-DNA 插入位点属于同一CA 基因的启动子序列,用菌饼接种也均表现为致病力增强。这是由于硫氧还蛋白和CA基因在不同物种中作用机制不同?还是因为如前所述剪叶形成伤口更利于菌丝侵染的结果?需要进一步研究证实。今后研究将改变接种方法,如在离体叶片或者甘蔗幼苗上接种不同浓度的分生孢子,通过病斑出现的时间及其大小来判断致病力。已经完成的基因组序列测定结果显示,甘蔗镰孢菌的基因组约50 Mb,可能编码15 000 余个基因(数据另文发表),本研究所构建的突变株库容量偏小,今后将应用所建立的转化体系继续进行转化,以期获得更多的突变体,为甘蔗镰孢菌的致病分子机理和生长发育机制提供基础材料。

