外源24-表油菜素内酯对花后苹果短枝叶片糖代谢和成花基因表达的影响
杨天一 马利萍 李凯 张满让

摘 要 以24-表油菜素内酯为外源处理剂,于盛花期后35 d和39 d对‘长富2号苹果树进行0.2 mg/L、0.4 mg/L和1.0 mg/L不同浓度2次叠加处理。为探究外源油菜素内酯处理对苹果花后当年生短枝叶片可溶性糖含量影响,测定分析当年生短枝叶片可溶性糖含量变化,并对其可溶性糖和成花相关基因进行实时荧光定量 PCR 分析。结果表明:不同浓度外源24-表油菜素内酯处理,各可溶性糖含量发生不同变化,浓度0.4 mg/L处理在所设浓度梯度效果较好。除花后50 d外,其他时间蔗糖含量均显著高于對照;葡萄糖和果糖含量在花后50~80 d均高于对照;经外源处理后山梨糖醇含量先增加,但在70~80 d含量降低。可溶性糖相关基因表达也发生相似变化。促花基因 MdSOC1、 MdFT 在花后50 d和70~80 d表达量均显著高于对照。以上结果表明:适宜浓度的外源油菜素内酯处理可增加当年生短枝叶片可溶性糖含量,累积源叶中碳水化合物,有利于营养物质运输,同时促花基因累积表达。
关键词 苹果;油菜素内酯;可溶性糖;成花;基因表达
苹果(Malus domestica Borkh.)是一种栽培广泛、具有营养价值的重要经济作物。花芽分化是开花结果的基础,是果树由营养生长向生殖生长转化的重要生命活动,如何促进花芽分化进而提高产量是生产实践中的重要环节。
苹果花芽分化以春梢停止生长前后为起点开始进行[1],可分为生理分化期、形态分化期和性细胞形成期。花芽分化是成花因素积累的过程,尤其花芽生理分化期是形成花芽的关键时期,促花措施应在花芽孕育临界期进行效果较好[2]。同时,有研究表明碳水化合物的代谢、累积和转化参与花芽分化过程,且二者显著相关[3-4]。短枝叶片营养水平的高低,与成花诱导关系密切。
以往研究表明:植物生长不但受内源激素调控,而且增施合理浓度外源激素可一定程度影响植株营养及生殖生长。近年来新型植物激素研究不断取得进展,油菜素内酯(Brassinolide,BR)、茉莉酸、水杨酸、独脚金内酯已逐渐成为热门研究的植物激素。油菜素内酯是一种新型的甾醇类植物激素,被称为第六大类植物激素[5]。其在促进细胞分裂伸长[6]、器官分化、维管组织发育[7]、种子休眠与萌发[8]、叶片伸展、开花时间[9]以及抗逆[10]等生长发育过程中起到重要调控作用。
油菜素内酯的研究多应用于模式植物拟南芥和1 a生作物,对调控苹果研究较少。本试验选择众多油菜素内酯中的一种,即24-表油菜素内酯(24-Epi),以8 a生‘长富2号苹果树为材料,于花芽生理分化期进行不同浓度外源喷施处理,研究其对当年生短枝叶片的可溶性糖含量及相关基因、成花相关基因相对表达量的影响,为油菜素内酯在苹果生产中的应用提供参考。
1 材料与方法
1.1 试验材料与处理
试验于2021年在陕西省西北农林科技大学宝鸡千阳苹果试验示范站进行。所用24-表油菜素内酯购自上海源叶生物科技有限公司,无水乙醇溶解后,水稀释至所需浓度。
选择生长健壮、无病虫害、树势接近的8 a生‘长富2号苹果树。为保证试验处理有效性,于盛花期后35 d(2021-05-15)与39 d(2021-05-19)在同一材料进行2次叠加喷施24-表油菜素内酯处理,浓度分别为0.2 mg/L、0.4 mg/L和1.0 mg/L。以喷施清水作为对照(CK),喷施程度为叶片和茎表面充分湿润但无液滴凝聚下落。每个处理重复喷施4棵树,共16棵树。以第2次处理完成后第2天(5月20日,花后40 d)为第1次采样时间,于花后50 d、60 d、70 d、80 d每隔10 d随机采集当年生饱满短枝(<5 cm)的叶片,锡纸包裹并标记后,液氮迅速冷冻带回,-80 ℃保存,用于后续指标测定。
1.2 可溶性糖含量的测定
可溶性糖的测定参照崔维芳[11]的研究,略有改动:称取鲜质量0.1 g样品于2 mL试管,立即用液氮冻存。加入75%色谱级甲醇(-20 ℃预冷) 1 400 μL,涡旋10 s后加入100 μL Ribitol核糖醇(4 mg/mL)为内标,充分涡旋。在70 ℃金属浴恒温震荡仪上950 r/min混匀30 min,13 000 g、 4 ℃离心15 min。将800 μL上清液转移到10 mL试管中加入750 μL色谱级CHCL3(-20 ℃预冷)和1 400 μL ddH2O(4 ℃预冷),充分振荡后2 200 g、4 ℃离心15 min。上清中取出1 mL放在2 mL离心管中-80 ℃冻存;取10 μL上清液到1.5 mL试管中,真空浓缩机干燥1 h。干燥后加入40 μL甲氧胺盐酸盐的吡啶液(吡啶溶解,5 mg/mL),金属浴恒温震荡仪950 r/min、37 ℃条件下振荡2 h。加入60 μL N-甲基三甲基硅基三氟乙酰胺(MSTFA)衍生剂,金属浴恒温震荡仪300 r/min、37 ℃振荡30 min。转入上样瓶,使用气相色谱和质谱联用仪(GCMS- QP2010,岛津,Japan)测定后并计算各种糖含量。
1.3 可溶性糖和成花相关基因荧光定量表达分析
参照秦玲[12]方法提取样品中总 RNA,分光光度计检测所提 RNA 浓度,琼脂核糖凝胶电泳验证所提 RNA 的完整性和纯度。使用 Evo M-MLV 反转录试剂盒进行反转录为 cDNA。
设计引物,如表1所示。根据上述 cDNA 为模板,参照试剂盒 SYBR[HT5”SS]○R Green Pro TaqHS预混型说明书在 QuantStudio5 定量仪上进行 qRT-PCR 反应。以苹果 MdACTIN 基因为内参。反应体系为10 μL(其中 SYBR[HT5”SS]○R Premix Ex TaqTM II 2×为5 μL,上、下游引物共0.5 μL,cDNA为1 μL,dd H2O为3.5 μL)。反应程序参照秦玲[12]所描述的方法,为95 ℃预变性3 min,94 ℃变性15 s,60 ℃退火20 s,72 ℃延伸20 s,40 次循环,均设置3次重复,通过2-ΔΔCt方法[13]计算基因的相对表达水平。
1.4 数据处理
使用IBM SPSS Statistics 26.0,对所有数据(表示为3次重复的平均值)进行单因素方差分析(ANOVA),显著性分析采用Duncan氏多范围检验(P<0.05)。使用Excel 2010制作相关图表。
2 结果与分析
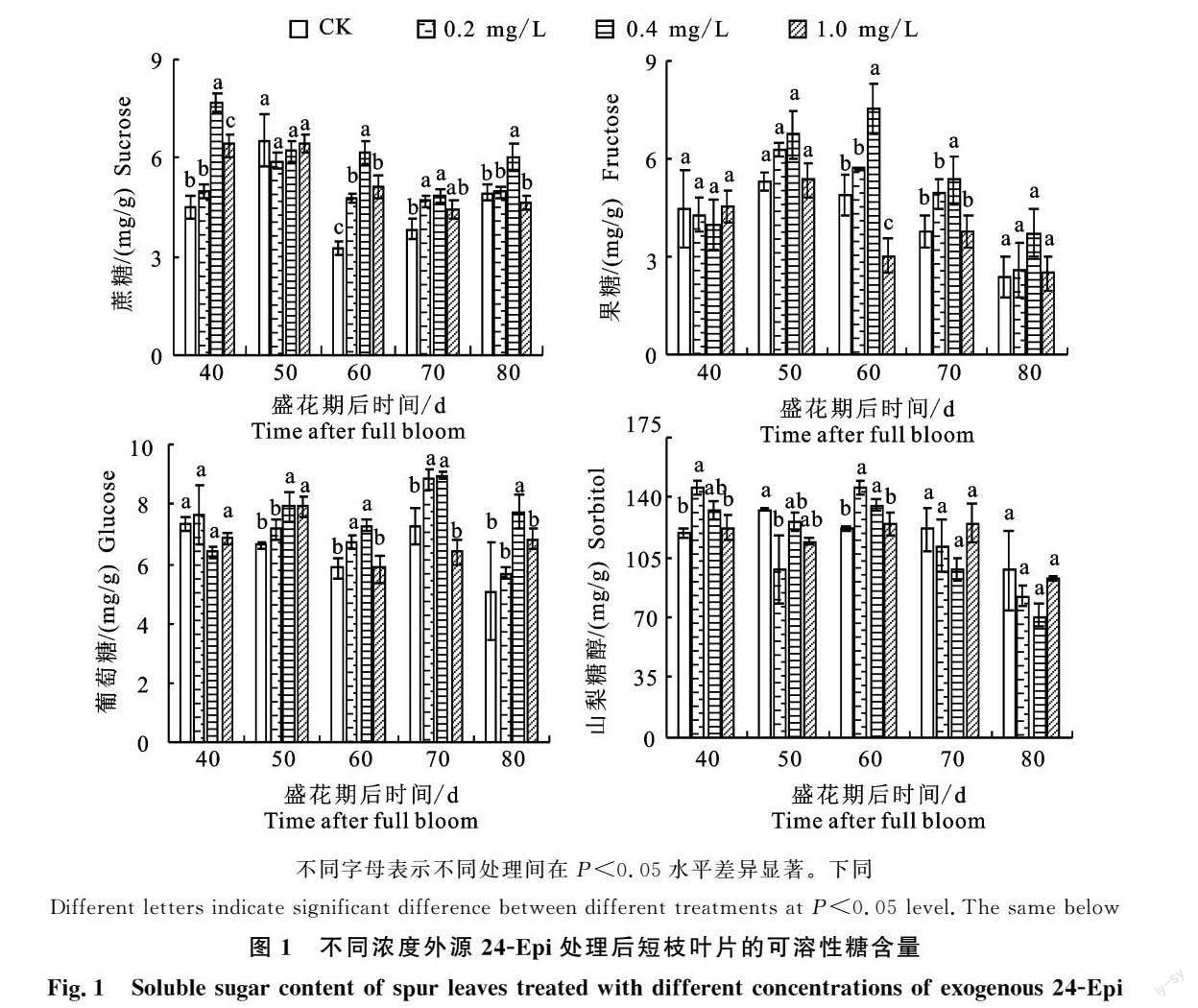
2.1 外源24-Epi对当年生短枝叶片可溶性糖含量的影响
对外源24-Epi处理后当年生短枝叶片的可溶性糖含量研究发现(图1),蔗糖含量在处理后随即响应处理,花后40 d时发生显著变化;花后50 d时各种浓度处理均降低了短枝顶芽毗邻叶蔗糖含量,除此外其他4个采样时间的0.4 mg/L处理后的叶片蔗糖含量均高于对照。花后40 d,处理0.4 mg/L和1.0 mg/L与对照相比显著提高了蔗糖含量,分别增加70%和42%,此期0.2 mg/L浓度处理对蔗糖含量仅有少量增加。花后60 d时,各浓度处理叶片的蔗糖含量均显著高于对照,同时处理0.4 mg/L显著高于其他浓度处理。花后70 d处理0.2 mg/L和0.4 mg/L显著增加叶片蔗糖含量。花后80 d时,0.4 mg/L处理的蔗糖含量显著高于对照和其他处理,相较于对照增加了22%。
外源处理对叶片葡萄糖含量影响自花后50 d开始有显著变化。处理0.4 mg/L在花后自响应起至末期(花后50~80 d)均增加短枝叶片葡萄糖含量且显著高于对照。处理0.2 mg/L于花后60~70 d相较于对照显著增加了叶片葡萄糖含量。处理1.0 mg/L在花后50 d时提高了葡萄糖含量,显著高于对照。短枝叶片果糖含量对处理的响应时间最晚,且只在60 d和70 d发生了显著变化。花后60 d时,处理0.4 mg/L葡萄糖含量显著高于对照和其他处理,处理1.0 mg/L却使叶片的葡萄糖含量相较于对照和其他处理显著降低。花后70 d处理0.2 mg/L和0.4 mg/L显著高于对照和处理1.0 mg/L。综合变化趋势来看,处理使叶片中果糖含量在花后40 d时先有所降低,50~70 d不同程度升高后,花后80 d时又下降。
同蔗糖一样,在花后40 d时短枝叶片山梨糖醇含量已经发生变化。此时各浓度处理均上调了叶片中山梨糖醇含量,其中处理0.2 mg/L的山梨糖醇含量显著高于对照和1.0 mg/L;在花后50 d时该浓度处理显著降低了山梨糖醇含量,60 d时又有所提高。处理0.4 mg/L在花后50 d和60 d时均分别显著高于对照。在所有采样时间内,处理1.0 mg/L对山梨糖醇含量影响变化与对照间没有显著差异。山梨糖醇含量呈现规律性变化,花后40 d时各处理增加了短枝叶片中山梨糖醇的含量,花后50 d时呈不同程度下调趋势,60 d上升后60~80 d对照和各处理的山梨糖醇含量在逐渐降低。
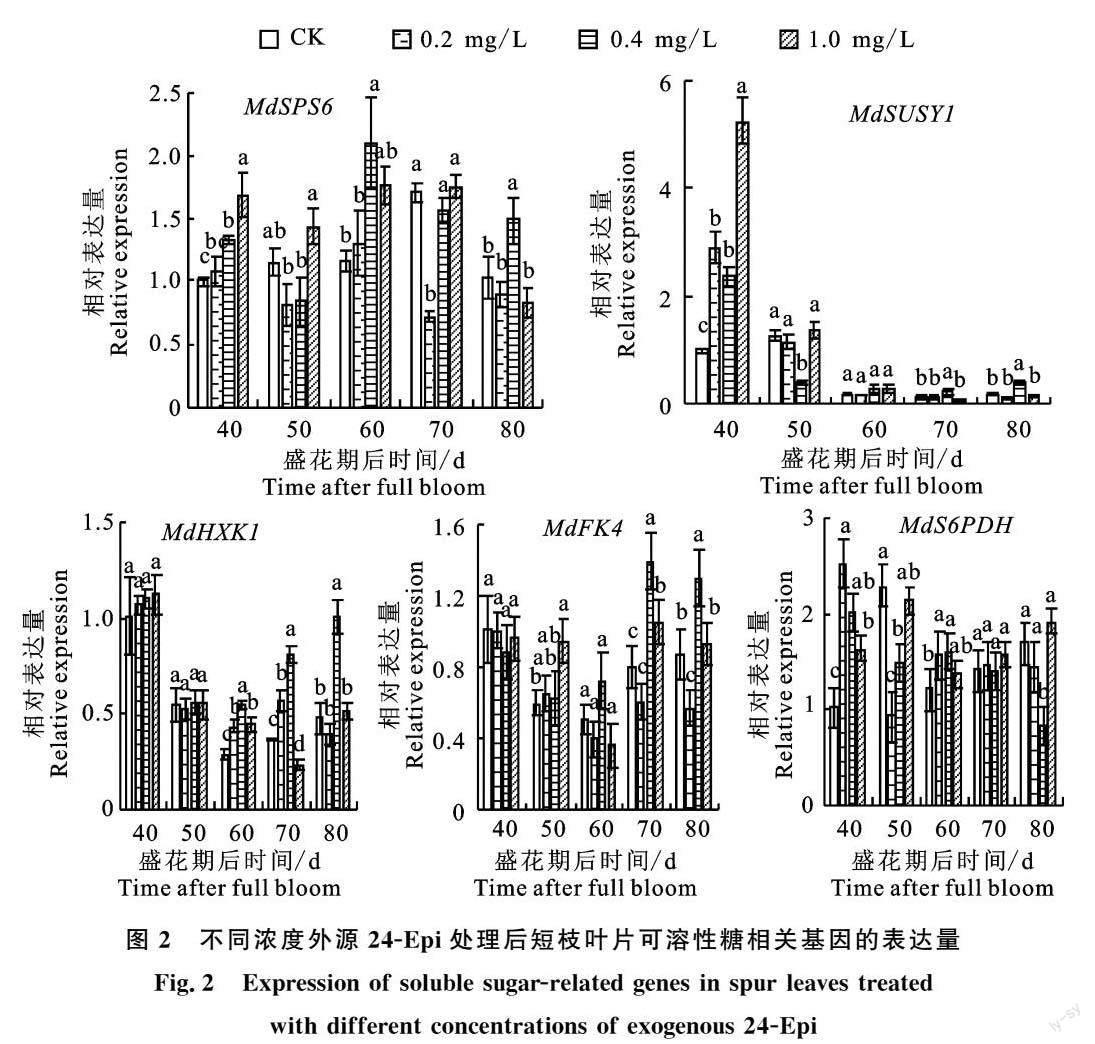
2.2 外源24-Epi对当年生短枝叶片糖代谢相关基因表达量的影响
与蔗糖合成相关联的基因蔗糖合酶基因 MdSUSY1、蔗糖磷酸合成酶基因 MdSPS6 在外源24-Epi处理后发生显著变化(图2)。 MdSUSY1 表达量在花后40 d均呈现不同程度增加,且处理0.4 mg/L和1.0 mg/L显著高于对照。处理0.4 mg/L在花后50 d显著下调了基因 MdSUSY1表达,但花后70 d和80 d时该浓度处理使其表达显著高于对照。花后40 d处理0.4 mg/L和1.0 mg/L上调基因 MdSPS6 表达且显著高于对照。花后60 d和80 d时,0.4 mg/L显著增加基因 MdSPS6 表达量,但在花后70 d处理0.2 mg/L显著下调该基因表达水平。
己糖激酶基因 MdHXK1 在花后60~80 d发生显著变化,在此期间处理0.4 mg/L均显著上调表达。同时在花后60 d和70 d处理0.2 mg/L也显著增加了基因 MdHXK1 的表达量。处理1.0 mg/L在花后60 d相较于对照显著上调 MdHXK1 表达,但70 d时却又显著下调。处理1.0 mg/L在花后50 d和70 d显著上调果糖激酶基因 MdFK4 表达水平。0.4 mg/L在花后70~80 d显著上调 MdFK4 表达。0.2 mg/L处理仅在花后80 d对 MdFK4 基因表达产生影响,显著低于对照和其他两个浓度处理。
山梨糖醇合成关键基因6-磷酸山梨醇脱氢酶 MdS6PDH 在外源处理后的前期变化较明显。花后40 d(即處理12 h),3种浓度处理显著上调 MdS6PDH 表达。花后50 d处理0.2 mg/L和0.4 mg/L促使基因 MdS6PDH 表达显著低于对照,但在花后60 d此两种浓度处理使基因表达显著高于对照。花后80 d处理0.4 mg/L,基因 MdS6PDH 相对表达量显著低于对照和1.0 mg/L。
2.3 外源24-Epi对当年生短枝叶片成花相关基因表达量的影响
由图3可见,基因 MdSOC1 相对表达量在花后50 d响应处理发生显著变化,此时外源0.4 mg/L处理显著增加了其表达量,同浓度处理在花后70~80 d也显著上调 MdSOC1 表达;且在花后50 d和80 d时,0.4 mg/L浓度处理后基因 MdSOC1 表达量显著高于对照和其他两个浓度处理。花后60 d时处理0.2 mg/L和1.0 mg/L显著下调了 MdSOC1 表达,但处理1.0 mg/L在花后70 d时显著上调了该基因表达。
花后40 d时基因 MdFT 表达量已发生显著变化,外源0.2 mg/L处理显著降低该基因表达水平,1.0 mg/L却使表达量显著升高,但此时0.4 mg/L处理的基因表达量与对照较接近无明显变化。花后50 d时处理0.4 mg/L 和1.0 mg/L上调了 MdFT 表达显著高于对照。在60~80 d仅有处理0.4 mg/L对 MdFT 表达水平产生显著影响,处理0.4 mg/L在花后50 d和70~80 d显著上调了基因表达。
同 MdSOC1 一样,基因 MdFLC 表达于花后50 d才开始变化,0.2 mg/L和1.0 mg/L显著上调了表达;处理0.4 mg/L在此期显著下调了基因表达。花后80 d,0.4 mg/L和1.0 mg/L显著上调 MdFLC 表达。
外源0.2 mg/L处理在花后40 d显著下调 MdSVP 表达;但花后50 d起均使表达量增加,尤其50 d和70~80 d显著高于对照。0.4 mg/L处理在花后40 d和50 d显著下调表达水平。1.0 mg/L在花后50 d和60 d显著上调了基因 MdSVP 表达水平。
3 讨 论
3.1 外源24-Epi对当年生短枝叶片可溶性糖含量及相关基因表达的影响
在花芽分化研究过程中,研究普遍认为碳水化合物的积累有利于花芽分化。糖作为主要能源来源参与植物开花过程[14],可溶性糖的累积是花芽分化的营养基础。糖通过光合作用在成熟叶片中合成,最终由韧皮部输送到需养部位加以贮藏利用,实现从源到库的转运[15]。借助 RNA 测序技术发现‘长富和‘烟富苹果花期短枝顶芽差异表达的基因与糖信号通路存在关联[16]。本研究发现不同浓度的外源24-表油菜素内酯处理影响了当年生短枝叶片的可溶性糖含量。
外源处理后(花后40 d),蔗糖含量得到显著增加。虽然在花后50 d时各浓度处理降低蔗糖含量,但在花芽生理分化期后期各浓度处理仍增加叶片蔗糖含量,尤其处理0.4 mg/L促使叶片蔗糖含量显著高于对照。苹果叶片中蔗糖合成的主要 SPS 家族基因蔗糖磷酸合成酶 MdSPS6,与蔗糖相关的基因蔗糖合成酶 MdSUSY1 表达量也明显升高。花后40 d时, MdSUSY1 表达量的增加较为明显。处理0.4 mg/L对这两个基因表达水平影响变化较为明显。李天来等[17]对番茄幼苗叶喷施epi-BL,发现叶片蔗糖含量下降,这与本研究结果有相似之处,但处理明显提高了番茄叶片 SUSY 的 mRNA 水平促进转录水平的积累。Petzold等[18]在对蚕豆的研究中也有类似发现,外源24-Epi显著增加了蚕豆叶片对蔗糖的吸收。蔗糖代谢是调控花芽分化的代谢枢纽之一,虽然目前尚不清楚蔗糖是作为信号分子还是作为能源物质影响花芽分化,但可以肯定的是蔗糖的积累有利于花芽分化。在本研究中发现以浓度0.4 mg/L处理,除花后50 d外其他时间蔗糖含量均显著高于对照,外源24-Epi增加了‘长富2号当年生短枝叶片蔗糖累积。山梨糖醇含量也在花后40 d亦开始响应处理发生变化,但此时只有0.2 mg/L浓度处理显著提高了叶片中山梨糖醇含量。外源24-Epi对山梨糖醇影响在花芽生理分化期后期不显著,处理诱导变化发生在40~60 d,在此期间0.2 mg/L和0.4 mg/L的外源24-Epi显著增加了山梨糖醇含量。6-磷酸山梨醇脱氢酶基因 S6PDH主要在叶片表达,其参与的反应是山梨糖醇合成的关键调控步骤[19]。对基因 MdS6PDH 定量分析发现,花后40 d各浓度处理的该基因表达均显著高于对照,变化与山梨糖醇含量变化相一致。 MdS6PDH 在花后80 d表达显著下调,此期山梨糖醇含量虽也有所下调但未达到显著水平。
相较于蔗糖和山梨糖醇,葡萄糖和果糖对外源24-Epi处理的响应较晚。在花后50 d时,0.2 mg/L和0.4 mg/L外源24-Epi处理显著增加叶片中葡萄糖含量,同时在花后60~80 d处理0.4 mg/L叶片中葡萄糖含量显著高于对照。张丽之等[20]研究发现喷施葡萄糖可作为一种调控‘富士苹果成花的有效手段。本研究发现外源24-Epi处理增加了当年生短枝叶片葡萄糖含量,这可能是外源24-Epi有利于苹果花芽生理分化的又一原因。果糖在花后60 d时才发生显著变化。葡萄糖和果糖在处理后没有立即响应外源处理,可能是其本身对油菜素内酯响应较晚,还存在另一可能,即前期累积的蔗糖通过蔗糖合成酶或转化酶转化分解形成了较多的葡萄糖和果糖,致使二者在叶片中含量增加。己糖激酶(HXK)已被证明是拟南芥中的葡萄糖感受器[21],本研究同时对葡萄糖感应因子己糖激酶基因 HXK1进行了定量分析,其结果与葡萄糖含量变化较为一致,然而果糖激酶基因 MdFK4 与叶片中果糖含量变化一致性却不是很高。
不同浓度外源24-Epi处理对短枝顶芽毗邻叶的可溶性糖含量变化有一定影响,且不同浓度处理存在不相一致的变化。有关 BR 浓度与其效应的关系,Tong 等[22]认为外源处理的 BR 浓度不同,会造成不同甚至相反的生理效应。在本研究中浓度0.4 mg/L外源24-Epi处理促进叶片中蔗糖、葡萄糖和果糖含量增加,较为明显地积累了源叶中碳水化合物,这可为后期短枝顶芽发育需要较多的可溶糖能量积累做好“源”端准备,可以促进输送较多同化物。同时糖也是高等植物叶片光合作用的产物[23],当年生短枝叶片中可溶性糖含量增多也恰从另一方面证明外源24-Epi对光合作用起到积极促进作用。
3.2 外源24-Epi对当年生短枝叶片成花相关基因表达的影响
在拟南芥中已有研究表明,BR通过调控 FLC 表达从而影响开花时间[24]。SVP 可能是受 BR 的直接调控[25]。并且有研究表明 SVP、 FT 和 SOC1 间存在关联直接作用[26]。同时鉴于前人研究结果 FLC 作为参与春化和自主途径的关键开花抑制因子,在苹果花芽分化阶段几乎没有在芽中表达[27]。在本研究中为了探究 BR 如何影响苹果成花相关基因,对当年生短枝叶片中的 MdFT、 MdSOC1、 MdFLC、 MdSVP 基因相对表达量进行了实时荧光定量分析。结果表明 MdFT 和 MdSVP 在处理第2天(花后40 d)就已對外源处理产生显著响应, MdSOC1 和 MdFLC 相较于对照虽均有不同程度下调但此期未达显著变化。但苹果成花诱导是一个较长时间的持续性过程,在本研究中 MdFT 和 MdSOC1 的表达量于花后50 d、70 d和80 d有一致的转录水平,均被0.4 mg/L外源24-Epi显著上调,这可能是有利于‘长富2号苹果花芽生理分化的因素。本研究仅对部分成花关键基因进行了 RT-qPCR 相对表达量的分析,但未证明外源24-表油菜素内酯是如何直接或间接影响具体哪个成花相关基因从而调控整个苹果成花途径,尚需后续的研究给予解答。
4 結 论
综上所述,于苹果盛花期后2次叠加施用0.4 mg/L外源24-表油菜素内酯有利于可溶性糖含量积累,促进成花基因表达,对果树光合作用起到一定促进作用。在实际生产中可以参考这一手段调控苹果树体生长。
参考文献 Reference:
[1] MONSELISE S P,HALEVY A H.Chemical inhibition and promotion of citrus flower bud induction[J].Procamersochort,1964,84(5):141-146.
[2] 曹尚银.苹果花芽发育过程及其内源激素变化规律的研究[D].南京:南京农业大学,2000.
CAO SH Y.Studies on the developmental process of apple flower buds and the changes of endogenous hormones[D].Nanjing:Nanjing Agricultural University,2000.
[3] BUBAN T,FAUST M.Flower Bud Induction in Apple Trees:Internal Control and Differentiation[M].UK:Palgrave Macmillan,1982.
[4] GARCIA L A,FORNES F,GUARDIOLA J L.Leaf carbohydrates and flower formation in citrus[J].Jamersochortsci,1995,120(2):222-227.
[5] SANTNER,AARON,CALDERON V,et al.Plant hormones are versatile chemical regulators of plant growth[J].Nature Chemical Biology,2009,5(5):301-307.
[6] CLOUSE S D.Molecular genetic studies confirm the role of brassinosteroids in plant growth and development[J].Plant Journal,2010,10(1):1-8.
[7] MITCHELL J W,MANDAVA N,WORLEY J F,et al.Brassins-a new family of plant hormones from rape pollen[J].Nature,1970,225(5237):1065-1066
[8] STEBER C M,MCCOURT P.A role for brassinosteroids in germination in Arabidopsis[J].Plant Physiology,2001,125(2):763-769.
[9] NAKAMOTO D,IKEURA A,ASAMI T,et al.Inhibition of brassinosteroid biosynthesis by either a dwarf4 mutation or a brassinosteroid biosynthesis inhibitor rescues defects in tropic responses of hypocotyls in the Arabidopsis mutant nonphototropic hypocotyl 41[J].Plant Physiology,2006,141(2):456-464.
[10] HAO J J,YIN Y H,FEI S Z.Brassinosteroid signaling network:implications on yield and stress tolerance[J].Plant Cell Reports,2013,32(7):1017-1030.
[11] 崔维芳.生长素对苹果糖代谢的影响及苹果MdARP功能的初步研究[D].陕西杨凌:西北农林科技大学,2019.
CUI W F.Effects of auxin on sugar metabolism in apples and a preliminary study on the function of MdARP in apples[D].Yangling Shaanxi:Northwest A&F University,2019.
[12] 秦 玲.喷施亚精胺对‘长富2号苹果花芽成花的影响及多胺氧化酶基因家族的鉴定与分析[D].陕西杨凌:西北农林科技大学,2020.
QIN L.Effects of spermidine spraying on flower bud formation of apple ‘Nagafu 2 and identification and analysis of polyamine oxidase gene family[D].Yangling Shaanxi:Northwest A&F University,2020.
[13] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T)) method[J].Methods,2001,25(4):402-408.
[14] GIBSON S I.Control of plant development and gene expression by sugar signaling[J].Current Opinion in Plant Biology,2005,8(1):93-102.
[15] ROLLAND F,SHEEN J.Sugar sensing and signalling networks in plants[J].Biochemical Society Transactions,2005,33(1):269-271.
[16] LI Y M,ZHANG D,ZHANG X,et al.A transcriptome analysis of two apple (Malus×domestica) cultivars with different flowering abilities reveals a gene network module associated with floral transitions[J].Scientia Horticulturae,2018,239:269-281.
[17] 李天来,赵聚勇,崔 娜,等.苗期喷施表油菜素内酯对番茄叶中蔗糖代谢的影响[J].植物生理学报通讯,2008,44(3):417-420.
LI T L,ZHAO J Y,CUI N,et al.Effects of spraying epibrassinolide at seedling stage on sucrose metabolism in tomato leaves[J].Plant Physiology Journal,2008,44(3):417-420.
[18] PETZOLD U,PESCHEL S,DAHSE I,ADAM G.Stimulation of source-applied 14 C-sucrose export in Vicia faba plants by brassinosteroids,GA 3 and IAA[J].Plant Biology,1992,41(4):469-479.
[19] 杨国婵,谢银鹏,马锋旺,等.苹果6-磷酸山梨醇脱氢酶基因启动子的转化及其转录活性[J].西北农林科技大学学报(自然科学版),2016,44(9):8.
YANG G CH,XIE Y P,MA F W,et al.Transformation of apple sorbitol 6-phosphate dehydrogenase gene promoter and its transcriptional activity[J].Journal of Northwest A&F University (Natural Science Edition),2016,44(9):8.
[20] 張丽之,张 昕,左希亚,等.2019.外源葡萄糖对‘长富2号苹果花芽生理分化期可溶性糖和相关基因表达的影响[J].园艺学报,2019,46(1):11-24.
ZHANG L ZH,ZHANG X,ZUO X Y,et al.Effects of exogenous glucose on the expression of soluble sugar and related genes during physiological differentiation of apple flower buds in ‘Nagafu 2[J].Acta Horticulturae Sinica,2019,46(1):11-24.
[21] JYAN-CHYUN J,PATRICIA L,LI Z,et al.Hexokinase as a sugar sensor in higher plants[J].The Plant Cell Online,1997,9(1):5-19.
[22] TONG H N,XIAO,Y H,LIU D P,et al.Brassinosteroid regulates cell elongation by modulating gibberellin metabolism in rice[J].The Plant Cell,2014,26(11):4376-4393.
[23] ELENA L,LUIGI D,AMEDEO A,et al.Why and how do plant cells sense sugars?[J].Annals of Botany,2001,(5):803-812.
[24] DOMAGALSKA M A,SCHOMBURG F M,AMASINO R M,et al.Attenuation of brassinosteroid signaling enhances FLC expression and delays flowering[J].Development (Cambridge,England),2007,134(15):2841-2850.
[25] 李计红.拟南芥内源油菜素内酯对开花时间的影响及机理研究[D].兰州:兰州大学,2011.
LI J H.Effect of endogenous oleuropein lactones of Arabidopsis thaliana on flowering time and the mechanism[D].Lanzhou:Lanzhou University,2011.
[26] SEARLE I,HE Y H,TURCK F,et al.The transcription factor FLC confers a flowering response to vernalization by repressing meristem competence and systemic signaling in Arabidopsis[J].Genes & Development,2006,20(7):898-912.
[27] XING L B,ZHANG D,LI Y M,et al.Transcription profiles reveal sugar and hormone signaling pathways mediating flower induction in apple (Malus domestica Borkh.)[J].Plant Cell Physiol,2016,56(10):2052-2068.
Abstract In order to explore the effect of exogenous brassinosteroids on the soluble sugar content in the annual spur leaves,24-Epicastasterone was used as exogenous treatment agent,‘Nagafu 2 apple trees were treated with 24-Epi at 35 and 39 days with two overlapping concentrations of 0.2 mg/L,0.4 mg/L and 1.0 mg/L after full bloom. The changes of soluble sugar content in the annual spur leaves were measured,and the quantitative real-time PCR analysis of soluble sugar and flowers related genes was conducted.The results showed that different concentrations of exogenous 24-Epicastasterone had different changes in soluble sugar content,and the concentration of 0.4 mg/L treatment had better effect in the set concentration gradient.The content of sucrose was significantly higher than the control at other times except for 50 days after full bloom; the content of glucose and fructose was higher than that of the control from 50-80 days after full bloom.The content of sorbitol increased after exogenous treatment,but decreased at 70-80 days.Similar changes occurred in soluble sugar-related gene expression.The expression of the flower-promoting genes MdSOC1 and MdFT were significantly higher than those of the control at 50 days and 70-80 days after full bloom.The above results indicated that exogenous oleuropein lactone treatment at appropriate concentrations could increase the soluble sugar content of annual spur leaves,accumulate carbohydrates in the leaves,facilitate nutrient transport,and the accumulate the expression of flower-promoting genes.
Key words Malus domestica; Brassinolide; Soluble sugar; Flowering; Gene expression

