Macamide B 促进缺氧缺血性脑损伤新生小鼠神经元的PGRN 表达
周倩,李莉霞,杨晓夏,杨俊华,文锦坤,李朋飞,罗利,李国营
1.广东药科大学生命科学与生物制药学院人体解剖学与组织胚胎学系,广州 510006;2.南方医科大学南方医院妇产科,广州 510515
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是由于脐带绕颈、宫内感染等引起的新生儿脑组织损伤[1]。该疾病常导致新生儿死亡或神经后遗症,例如脑瘫、癫痫、听力视觉异常及认知行为障碍等[2],目前唯一有效的亚低温治疗存在界定困难、时间窗短、难以普及等问题[3,4],因此亟需安全有效的神经保护类药物治疗新生儿HIBD。研究发现玛咖酰胺B(Macamide B)具有神经营养作用[5]。Macamide B 在MPP+诱导的神经元损伤模型中可增加神经递质浓度从而发挥神经保护作用[6]。本课题组前期研究发现Macamide B 可促进HIBD 新生小鼠细胞自噬,抑制细胞凋亡进而发挥神经保护作用[7],但其具体机制尚不明确。颗粒蛋白前体(Progranulin,PGRN)是一种分泌型糖蛋白,在细胞自噬、凋亡等多种生命活动中发挥重要作用[8,9]。研究表明PGRN 可促进孤独症中AKT/GSK-3β 通路激活从而减少神经元凋亡[10];在神经病理性疼痛疾病中PGRN 可增强感觉神经元自噬减轻疼痛[11]。而Macamide B 是否会促进HIBD 新生小鼠脑内PGRN 的表达尚缺乏直接的证据。本实验体内建立HIBD 新生小鼠模型,体外培养小鼠海马神经元细胞系(HT22)细胞并制备氧糖剥夺(oxygen-glucose deprivation,OGD)模 型,检 测Macamide B 对HIBD 新生小鼠大脑及OGD 模型中HT22 细胞的PGRN 蛋白表达变化,初步探究Macamide B 发挥神经保护作用的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞 SPF 级7 日龄C57 幼鼠60只,购自南方医科大学实验动物中心,许可证号:SCXK(粤)2021-0059。HT22 细胞购自上海富衡生物科技有限公司。
1.1.2 主要试剂 Macamide B(上海源叶公司);兔抗小 鼠Granulins antibody多克隆抗体(Omnimabs 公司);兔抗小鼠GAPDH 多克隆抗体(Abcam 公司);Dylight 594 标记的山羊抗兔IgG、Dylight 488 标记的山羊抗兔IgG(Earthox 公司);SDS-PAGE 凝胶配置试剂盒、含DAPI 抗荧光淬灭剂(碧云天公司);飞克特超敏ECL 液(大连美仑生物技术有限公司);DMEM、EBSS、青霉素链霉素双抗、胎牛血清(Gibco 公司)。
1.2 实验方法
1.2.1 体内实验分组及HIBD 模型建立 将7 d 的C57 幼鼠随机分为3 组,假手术组(Sham 组,n=20)仅暴露颈部皮肤、不电凝,腹腔注射生理盐水;模型组(HIBD 组,n=20)于HIBD 模型前30 min 腹腔给予生理盐水;药物处理组(Macamide B 组,n=20)于HIBD模型前30 min 腹腔给予Macamide B(60 mg/kg)。采用改良Rice-Vannucci 法建立新生小鼠HIBD 模型,将幼鼠仰卧固定,以2%~3%浓度的异氟烷麻醉生效后碘伏消毒皮肤,持剪在颈部正中开口,手术镊进行钝性分离,逐步分离皮肤、肌肉、筋膜,打开动脉鞘,暴露左颈总动脉,电凝离断左颈总动脉,缝合皮肤,将幼鼠放到32 ℃恒温垫上,待温度恢复后放入母鼠身边哺乳,恢复1 h 后放入缺氧箱中3 h(8% O2,92% N2,37 ℃温度,1.5 L/min 流速,60%~80%湿度)。
1.2.2 体外实验分组及OGD 模型建立 取对数生长期HT22 细胞随机分为3 组,对照组(Control 组)加入含0.1% DMSO 的DMEM 培养基,置于正常培养箱培养(5% CO2,37 ℃,95%湿度);OGD 模型组(OGD 组)于造模前30 min 加入0.1% DMSO 的DMEM 培养基,置于正常培养箱培养,造模时将培养基换为含0.1%DMSO 的EBSS 培养基,置于三气培养箱培养(5%CO2,1% O2,94% N2);药物处理组(Macamide B 组)于造模前30 min加入含Macamide B(10 μmol/L)的DMEM 培养基,置于正常培养箱培养,造模时将培养基换为含Macamide B(10 μmol/L)的EBSS 培养基,置于三气培养箱培养。OGD 后将细胞培养液换为含有10%胎牛血清及1%青霉素链霉素双抗的DMEM 培养液置于正常培养箱中恢复4 h。
1.2.3 免疫荧光染色 体内实验:使用4%戊巴比妥钠腹腔注射麻醉小鼠(n=10),4%多聚甲醛经心灌注后取小鼠大脑组织,4%多聚甲醛固定24 h 后经梯度酒精脱水、二甲苯透明、梯度熔点的蜡浸蜡、包埋后制作为5 μm 厚石蜡组织切片;选取制好的石蜡切片,60 ℃烘片30 min,经二甲苯脱蜡、梯度酒精水化,在0.01 mol/L 枸橼酸钠缓冲液中进行抗原组织修复,取出放置到室温,0.5% TritonX-100 破膜,滴加免疫荧光封闭液封闭10 min,滴加兔抗小鼠Granulins antibody多克隆抗体(1:200)过夜,复温30 min 回收一抗,滴加Dylight 488 标记的山羊抗兔IgG 二抗(1:300)37 ℃避光孵育1 h 后,滴加兔抗小鼠NeuN antibody 多克隆抗体(1:200)一抗过夜,复温30 min,滴加Dylight 594标记的山羊抗兔IgG 二抗(1:300)37 ℃孵育1 h,用含DAPI 的抗荧光淬灭剂封片,置于荧光显微镜下观察并拍摄。体外实验:用多聚赖氨酸处理带有爬片的24 孔板备用。选取对数生长期细胞以3×104密度种植于24 孔板中,24 h 后进行给药及OGD 模型构建,恢复4 h 后弃去培养基,用4%多聚甲醛固定30 min。清洗后经免疫荧光封闭液封闭10 min,滴加兔抗小鼠Granulins antibody 多克隆抗体(1:200)过夜,复温30 min 后,滴加Dylight 594 标记的山羊抗兔IgG 二抗(1:300)37 ℃孵育1 h,用含DAPI 的抗荧光淬灭剂封片,置于荧光显微镜下观察并拍摄。
1.2.4 Western blot 以4%戊巴比妥钠腹腔注射麻醉小鼠(n=10),取小鼠大脑组织。称重按200 μL/0.1 g比例加入含蛋白酶抑制剂的裂解液,研磨后离心取上清,采用BCA 法对蛋白上清进行浓度检测,制备相同蛋白浓度的上清并加入上样缓冲液100 ℃煮沸10 min,取40 μg 蛋白在SDS-PAGE 凝胶中进行分离,转膜、封闭、孵育兔抗小鼠Granulins antibody 多克隆抗体过夜(1:1000)、孵育HRP 标记的山羊抗兔IgG 二抗、超敏ECL 发光液显影。
1.2.5 CCK-8 检测 选取对数生长期细胞,以6×103密度种植于96 孔板中,24 h 后给药并进行OGD 模型建造,恢复4 h 后每孔加入10 μL 的CCK-8 试剂,37 ℃烘箱孵育30 min,用酶标仪测定在450 nm处的吸光度。
1.3 统计学分析
采用SPSS 24.0 软件对实验数据进行统计分析。实验数据用()表示,多组间差异采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 Macamide B 促进新生小鼠HIBD脑内PGRN 蛋白表达
采用TTC 染色观察新生小鼠大脑梗死体积,结果显示,与Sham 组相比HI 组缺血侧脑组织发白,出现梗死;与HI 组相比Macamide B 组脑梗死体积下降,说明模型构建成功且Macamide B 具有神经保护作用,见图1。随后对新生小鼠大脑皮质同时进行NeuN 和PGRN 的免疫荧光染色以检测PGRN 在新生小鼠脑内的表达及定位,结果显示,PGRN 大部分在NeuN 阳性细胞表达。NeuN 是脊髓动物神经元特异核蛋白,常用于标记成熟神经元。这说明PGRN 主要在新生小鼠神经元内表达。其中,Sham 组PGRN 阳性表达较多,主要表达细胞质;同Sham 组相比,HIBD新生小鼠大脑中PGRN 阳性表达显著减少;同HIBD组相比,Macamide B 组PGRN 阳性表达显著增加,见图2。
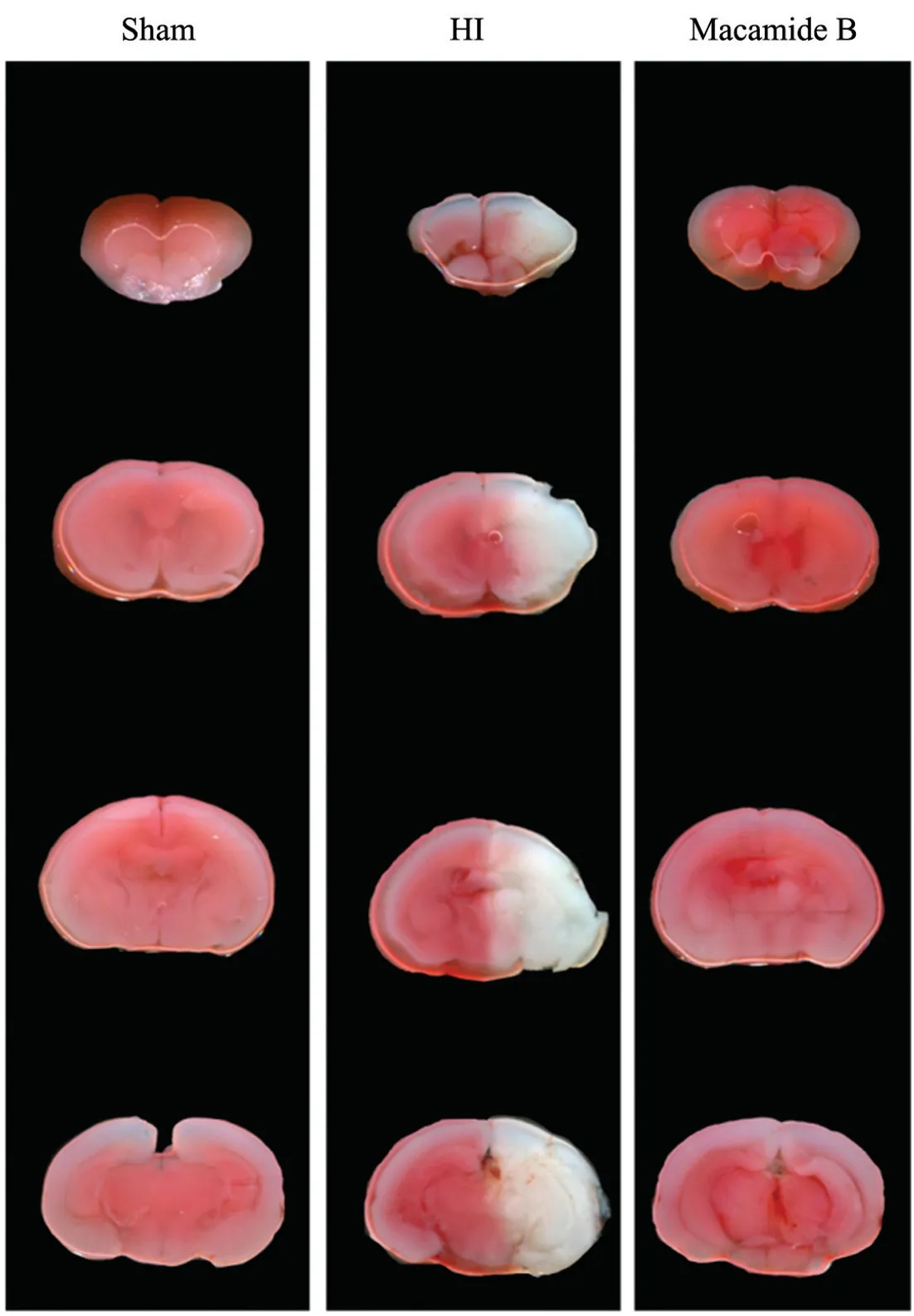
图1 TTC 染色显示HIBD 新生小鼠脑梗死体积Fig.1 The volume of cerebral infarction of HIBD neonatal mice by TTC staining

图2 免疫荧光染色显示HIBD 新生小鼠脑PGRN 蛋白表达(标尺=100 μm)A1~A4:假手术组B1~B4:HIBD 组C1~C4:Macamide B 处理组A1、B1、C1:新生小鼠脑内PGRN 染色A2、B2、C2:新生小鼠脑内NeuN 染色A3、B3、C3:细胞核DAPI 染色A4、B4、C4:新生小鼠脑内PGRN、NeuN 与DAPI 共定位Fig.2 The expression of PGRN in brain of HIBD neonatal mice by immunofluorescence stainingA: Sham group; B: HIBD group; C: Macamide B group A1-C1: PGRN staining in the brain of neonatal mice;A2-C2: NeuN staining in the brain of neonatal mice;A3-C3: DAPI staining in the brain of neonatal mice;A4-C4: Colocalization of PGRN,NeuN and DAPI in the brain of neonatal mice (scale=100 μm)
为进一步验证上述结果,对HIBD 新生小鼠损伤侧大脑进行Western blot 检测,结果显示,与Sham 组相比,HIBD 组PGRN 蛋白表达量显著下降,P<0.001;与HIBD 模型组相比,Macamide B 组PGRN 蛋白表达含量显著上升,P<0.001,见图3。
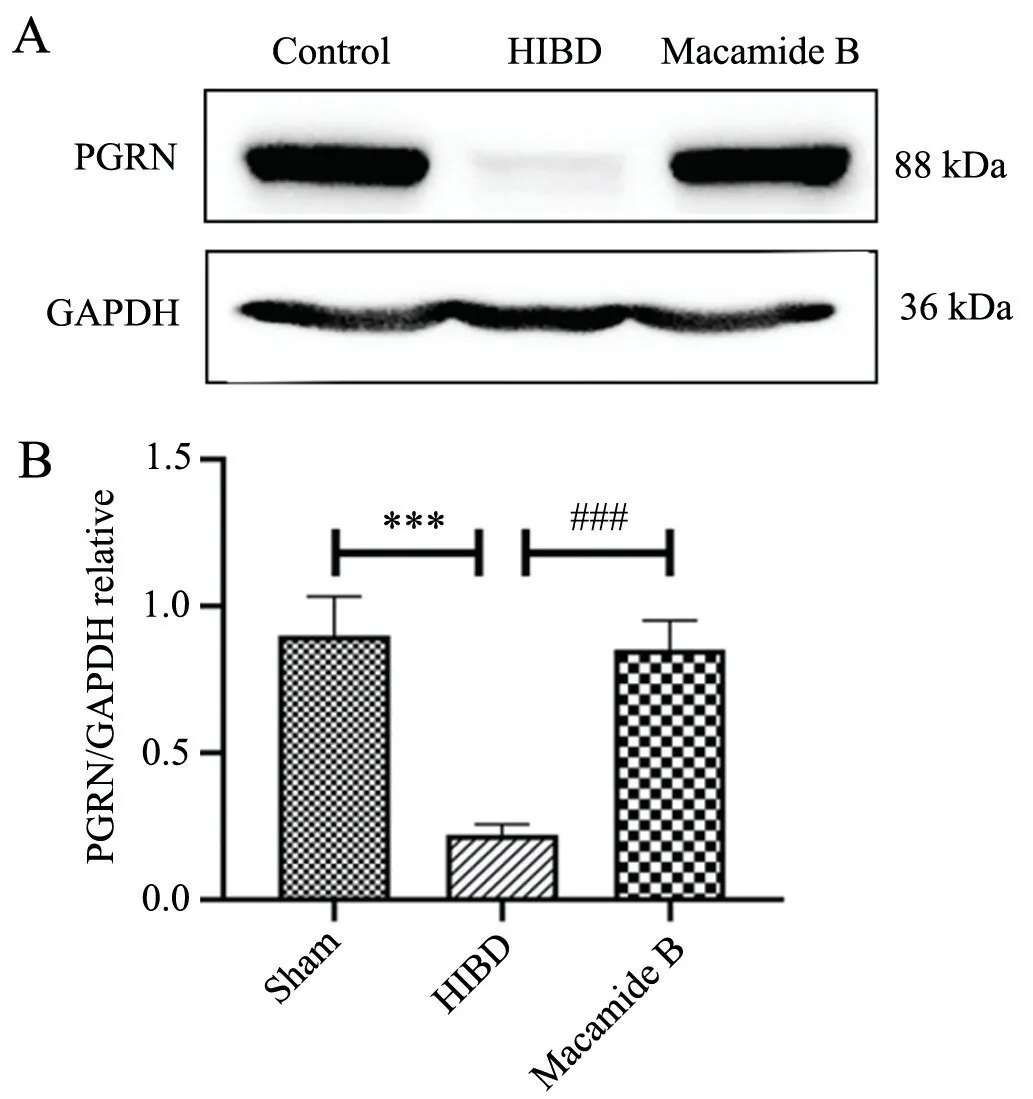
图3 Western blot 检测HIBD 新生小鼠脑PGRN 蛋白表达A:HIBD 新生小鼠脑PGRN 蛋白Western blot 条带 B:PGRN蛋白表达含量统计图 *** P<0.001,与Sham 组比较 ### P<0.001,与HIBD 组比较Fig.3 The expression of PGRN in brain of HIBD neonatal mice by Western blotA: Western blot bands of PGRN protein in HIBD neonatal mice;B: Statistical diagram of PGRN protein expression content;***P<0.001 vs Sham group;###P<0.001 vs HIBD group
2.2 OGD 模型建造及药物浓度选定
本研究体外构建OGD 模型以验证体内实验结果,与Control 组相比,OGD 模型后HT22 细胞存活率为50%左右,初步说明造模成功。为筛选Macamide B 对OGD 模型中HT22 细胞的有效作用浓度,采用CCK-8检测不同浓度(0.01、0.1、1、10 μmol/L)Macamide B 对OGD 后HT22 细胞活性。结果显示,OGD模型给 予1 μmol/L 和10 μmol/L 的Macamide B存活率有明显上升,P<0.01,且10 μmol/L 促进作用最明显,由此选择10 μmol/L 作为后续药物处理浓度,见图4。

图4 CCK-8 检测不同浓度Macamide B 对OGD后HT22 细胞活性影响**P<0.01,与OGD 组比较*P<0.05,与OGD 组比较Fig.4 The effect of different concentrations of Macamide B on the activity of HT22 cells after OGD was detected by CCK-8 assay**P<0.01 vs OGD group;*P<0.05 vs OGD group
2.3 Macamide B 促进OGD 后HT22细胞PGRN蛋白表达
通过细胞免疫荧光检测Macamide B 对OGD 后HT22 细胞PGRN 蛋白表达的影响,结果显示,与Control 组相比,OGD 模型后HT22 细胞PGRN 蛋白表达含量显著下降,P<0.001;与OGD 模型组相比,Macamide B 组PGRN 蛋白表达含量显著上升,P<0.001,见图5。
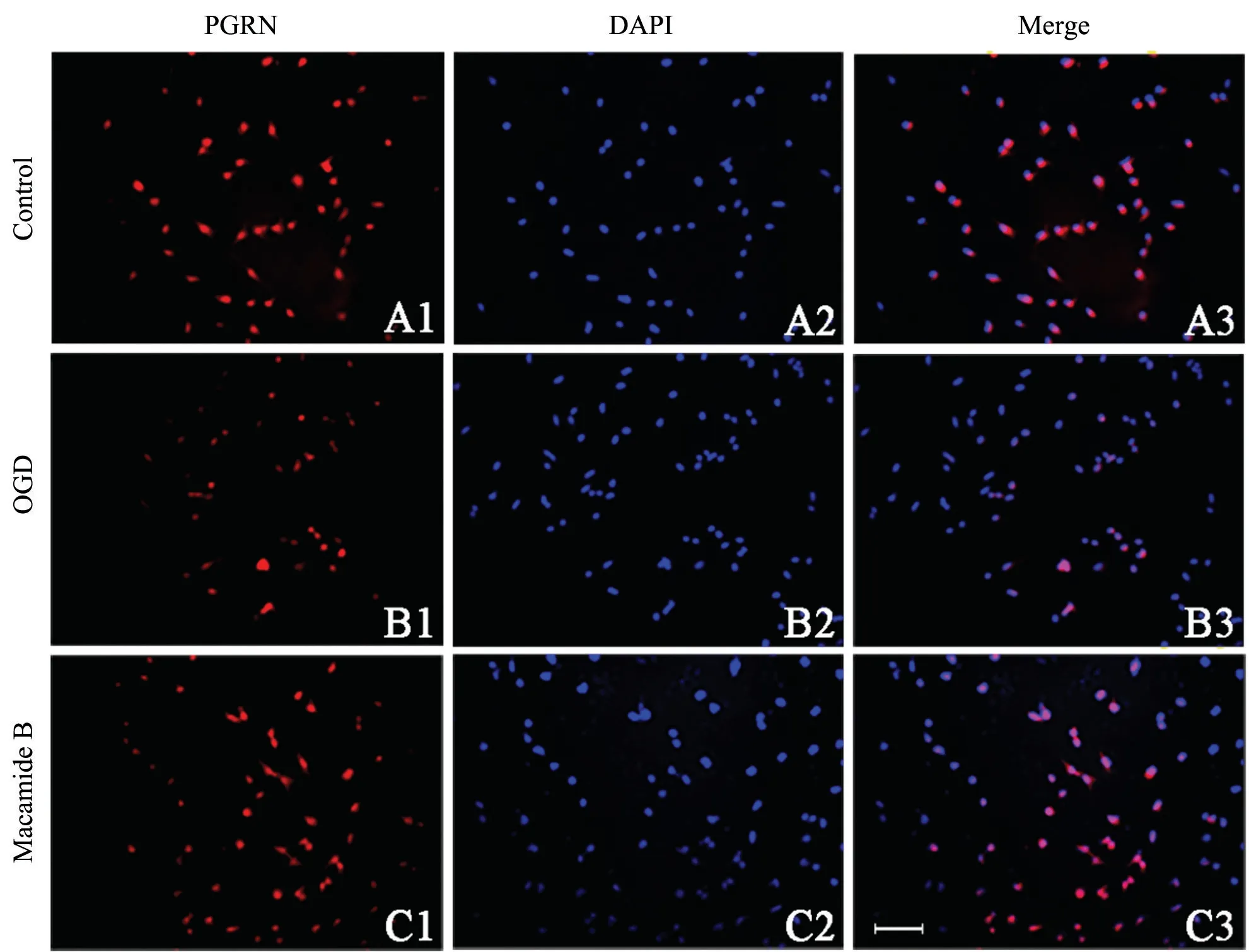
图5 细胞免疫荧光染色显示OGD 模型HT22 细胞PGRN 蛋白表达(标尺=100 μm)A1~A3:对照组 B1~B3:OGD 模型组 C1~C3:Macamide B 处理组A1、B1、C1:HT22 细胞内PGRN 染色 A2、B2、C2:细胞核DAPI 染色A3、B3、C3:HT22 细胞内PGRN 与DAPI 共定位Fig.5 The expression of PGRN in HT22 cells after OGD by immunofluorescence stainingA: Control group; B: OGD group; C: Macamide B group;A1-C1: PGRN staining in the HT22 cells;A2-C2: DAPI staining in the HT22 cells;A3-C3: Colocalization of PGRN and DAPI in the HT22 cells (scale=100 μm)
为进一步验证体外结果,本研究再次通过Western blot检测OGD 后HT22细胞的PGRN 表达,统计结果显示,与Control 组相比,OGD 组PGRN 蛋白表达量显著下降,P<0.001;与OGD 模型组相比,Macamide B 组PGRN 蛋白表达含量显著上升,P<0.001,见图6。

图6 Western blot检测OGD 后HT22细胞PGRN蛋白表达A:OGD 后HT22细胞PGRN蛋白Western blot 条带 B:PGRN 蛋白表达含量分析图 ***P<0.001,与Control组比较 ### P<0.001,与OGD 组比较Fig.6 Western blot detection of PGRN protein expression in HT22 cells after OGDA:The image of Western blot bands of PGRN protein in HT22 after OGD; B:Statistical diagram of PGRN protein expression content;***P<0.001 vs Control group;### P<0.001 vs OGD group
3 讨论
近年来,随着对新生儿的护理加强,新生儿HIBD的病死率有所下降。但由于该病发展迅速及复杂的机制对患儿的神经系统损伤难以避免,因此大多患儿遗有终身神经系统缺陷,包括脑瘫(10%~20%),听觉和视觉问题(约40%)以及运动障碍等[2]。神经元凋亡是HIBD 神经功能损害的主要病理过程之一[12]。因此,减少神经元凋亡,增加神经元存活是治疗新生儿HIBD 的有效治疗策略。
玛咖(Lepidium meyenii Walp),几个世纪以来常被用做营养药物,具有抗焦虑、抗疲劳、抗凋亡、抗氧化等效用[12]。Macamide B 是玛咖的重要次级产物,可以调节单胺类神经递质、磷脂酰胆碱(PCS)、磷脂酰乙醇胺(Pes)和神经酰胺(Cers)及与能量代谢相关的蛋白[6]。研究表明在斑马鱼受损神经元中Macamide B 具有神经保护作用[5];课题组前期证明Macamide B在新生小鼠HIBD 中抑制凋亡发挥神经保护作用[7]。但其机制尚不明确。
PGRN 是在中枢神经系统广泛表达的分泌性糖蛋白,参与多个生理和病理生理过程,如生长发育、代谢调节、细胞凋亡、细胞自噬等[13],可以调节典型的细胞增殖和凋亡信号通路,如JNK 和ERK 等[14]。PGRN 可在多个疾病中发挥神经保护作用,它的过度表达可逆转初级运动神经元受损的发育[8],促进体外神经元增殖、存活、促进轴突生长及突触形成[15]。那么,Macamide B 是否通过增加PGRN 表达抑制细胞凋亡发挥神经保护作用?本实验免疫荧光结果发现体内HIBD 模型中PGRN 在神经元内广泛表达,与Sham 组相比,HIBD 组PGRN 阳性表达显著下降;与HIBD 组相比,Macamide B 组PGRN 阳性表达显著升高。Western blot 结果同样显示与HIBD 组相比,Macamide B 组PGRN 表达含量显著上调。体内实验结果表明Macamide B 发挥作用可能与增加PGRN 表达有关。为进一步验证这一结果,本研究在体外采用HT22 细胞构建OGD 模型,通过细胞免疫荧光染色和Western blot检测发 现,与OGD模型组相比Macamide B 组PGRN 表达含量显著上调。
综上所述,本研究发现Macamide B 能够显著上调HIBD 后脑神经元内PGRN 的表达,提示Macamide B 可能通过增加PGRN 表达抑制神经元凋亡从而发挥神经保护作用。但具体的机制尚不明确,本课题组将继续探索Macamide B 促进PGRN 表达及保护神经的具体机制,为治疗新生儿HIBD 提供理论依据。