防控甜瓜枯萎病病菌的生防菌筛选及其根际定殖
李青 谢昶琰 张苗 孙春梅 陈川 章安康

摘要: 为了开发在农业实践中能够稳定发挥功能的生防菌资源,本研究从甜瓜根际挖掘具有良好根际定殖能力的抗甜瓜枯萎病病菌生防菌株。通过继代培养法、平板对峙法、发芽率测试和盆栽试验筛选出对甜瓜枯萎病有较强防控作用的生防菌株R1-3,经该菌发酵液处理的甜瓜植株对甜瓜枯萎病病菌的防效达50.04%,且菌株发酵液处理能够促进甜瓜植株的生长。根际定殖相关因素的测试结果表明,菌株R1-3能形成强健的生物膜结构且对不同质量浓度的甜瓜根系分泌物均具有显著趋化性,具备良好的根际定殖能力。该菌株对不同植物专化型尖孢镰刀菌和蔓枯病病菌也有一定的抑制作用,且具有分泌吲哚乙酸(IAA)、溶解无机磷及耐盐能力。通过菌株16S rDNA序列分析,将R1-3初步确定为芽孢杆菌属细菌(Bacillus sp.)。
关键词: 甜瓜枯萎病;生防菌;防病和促生作用;根际定殖;趋化性
中图分类号: S652 文献标识码: A 文章编号: 1000-4440(2023)02-0336-08
Screening of antagonistic bacteria against muskmelon Fusarium oxysporum and their colonization on rhizosphere
LI Qing, XIE Chang-yan, ZHANG Miao, SUN Chun-mei, CHEN Chuan, ZHANG An-kang
(Huaiyin Institute of Agricultural Sciences of Xuhuai Region in Jiangsu Province, Huaian 223001, China)
Abstract: To explore antagonistic bacterium materials that can play a stable role in agricultural practice, this research aimed to screen antagonistic bacteria against muskmelon Fusarium oxysporum which were easy to colonize in the rhizosphere. Strain R1-3 with strong antagonistic effect against muskmelon F. oxysporum was screened by using successive transfer culture method, plate confrontation method, germination rate test and pot experiment. Muskmelon treated by fermentation solution of R1-3 showed 50.04% control efficiency to muskmelon Fusarium wilt and the treatment could promote the growth of muskmelon. Test results of rhizosphere colonization-related factors showed that, strain R1-3 had fine rhizosphere colonization ability because it could form strong biofilm structure and had significant chemotaxis to musk melon root exudates with different mass concentrations. This strain had inhibitory effects on different plant specialized F.oxysporum and Stagonosporopsis spp., it also had the abilities of secreting indole-3-acetic acid (IAA), dissolving inorganic phosphorus and salt tolerance. Based on the phylogenetic analysis of 16S rDNA, strain R1-3 was preliminary identified as Bacillus sp..
Key words: muskmelon Fusarium wilt;antagonistic bacteria;disease prevention and growth promotion effect;rhizosphere colonization;chemotaxis
甜瓜属于中国广泛栽种的经济作物,近年来其产业经济效益较高,在种植业中的地位不断提升[1-2]。但是长年连续种植甜瓜会导致农田土壤病原微生物积累,造成土传病害频发,连作障碍已成为甜瓜可持续生产的重要限制因素之一[3]。特别是尖孢镰刀菌(Fusarium oxysporum)导致的甜瓜枯萎病、蔓枯病病菌(Stagonosporopsis spp.)引起的甜瓜蔓枯病等,在连作地发生的概率很高,严重影响甜瓜的产量和品质[4]。目前这些土传病害的防治主要依赖化学药剂,但化学药剂的长期使用易使病原菌产生抗药性,且易造成安全隐患[5]。相比之下,生物防治因其环境友好和经济投入较少等优点而受到广泛的关注和认可[6]。许多芽孢杆菌属细菌不仅能够产生抗菌活性物质拮抗病原菌,还具有植物促生特性,在生物防治中发挥着重要作用[7]。然而,尽管多数生防菌在室内条件下具有良好的防病效果,但它们在农业生产应用中对病害的实际防效依然有限,效果往往不稳定[8-9]。首先,许多生防菌是在富营养的培养基中被分离筛选出来的[10-12],未必能适应土壤中较贫瘠的营养条件。其次,很多研究在筛选过程中多以平板对峙试验中生防菌对病原菌的抑制率作为主要筛选指标[12-14],而平板抑制率仅能表征菌株产生拮抗物质的活性与能力。菌株充分发挥生防功能的重要前提是其在植物根际能够有效定殖[15]。影响细菌根际定殖的关键因素包括菌株对植物根系分泌物的趋化性和自身生物膜的形成能力[16]。根系分泌物中包含的信号物质能够调控细菌向根表趨化运动[17],停留在根表的细菌群体分泌胞外基质(主要成分为蛋白质、多糖和胞外DNA等),将自身包裹而形成膜样的细菌群体聚合物,细菌群体聚合物被称为生物膜,可为其提供一种受保护的、竞争力更强的生存模式[18-19],因而有益细菌向根表趋化并聚集成膜是其发挥抑病促生功能的关键。为获得在植物根际能够稳定发挥功能的微生物,本研究在贫营养条件下采用传统的生防菌筛选方法,同时结合菌株生物膜形成能力和对根系分泌物趋化性的评估,分离筛选获得1株具有防病促生效果和良好根际定殖能力的芽孢杆菌属细菌R1-3,并探索了其潜在的促生因子、耐盐能力以及拮抗多种病原菌的特性。研究结果能够为生防菌株的筛选应用提供新的思路及资源,有助于减少对农用化学品的依赖以及促进甜瓜产业健康和可持续发展。
1 材料与方法
1.1 试验材料
供试样品采集:甜瓜植株及其根际土壤样品采自江苏省淮安市甜瓜枯萎病发生地块,于甜瓜收获期随机选取靠近枯萎病发病株附近的健康植株,连根带土采集其根系用于菌株分离。
供试病原菌:甜瓜枯萎病病原菌尖孢镰刀菌(Fusarium oxysporum f. sp. melonis),菌种编号为ACCC36102,购自中国农业微生物菌种保藏管理中心。尖孢镰刀菌西瓜专化型(Fusarium oxysporum f. sp. niveum)、蔓枯病病菌(Stagonosporopsis spp.)由淮安市农业科学院蔬菜中心提供。尖孢镰刀菌黄瓜专化型(Fusarium oxysporum f. sp. cucumerinum)由南京农业大学资源与环境科学学院提供。
供试培养基:细菌的分离筛选参照Sun等[20]的方法,采用贫营养的1/10胰酪大豆胨(TSA)培养基(胰蛋白胨1.5 g,大豆蛋白胨0.5 g,氯化钠0.5 g,琼脂20.0 g,用蒸馏水定容至1.0 L)。拮抗效果鉴定使用平板对峙培养法,采用PDA培养基[11]。生物膜测试参照张楠[21]的方法,采用MSgg培养基。IAA产量测定的样品制备参照陈小娟[22]的方法,采用添加L-色氨酸的Landy培养基。溶磷能力的测定参照刘娜[23]的方法,使用蒙金娜无机磷培养基。菌株耐盐能力检测参照李晋等[24]的方法,使用添加不同质量浓度氯化钠的牛肉膏蛋白胨培养基。
1.2 试验方法
1.2.1 根际及内生细菌的分离纯化 抖落植物根部松散的附着土,剪成长约3 cm的小段,称量植物根及其根际土10 g倒入盛有90 ml无菌水和灭菌玻璃珠的三角瓶内振荡30 min,取1 ml土壤悬液经系列梯度稀释后涂布于1/10 TSA平板上。30 ℃倒置培养1~2 d后,挑取形态不同的菌落,经划线纯化后制备甘油管,保存至-80 ℃冰箱。内生菌分离时需对根进行表面消毒(用2%次氯酸钠浸泡15 min,用70%乙醇浸泡5 min,用无菌水冲洗干净),然后剪成1 cm左右的碎块,立即转移至无菌研钵中研磨,最后转移至上述三角瓶内,其余操作和根际细菌分离纯化步骤相同。
1.2.2 生防菌的初步筛选 以甜瓜枯萎病病原菌尖孢镰刀菌作为指示菌,采用对峙培养法[14],测试保存菌株的拮抗效果。先活化病原菌,再沿菌落边缘打孔获取直径为5 mm的菌饼,接种于PDA平板中央。28 ℃培养2 d后,将分离得到的细菌按1%的接种量在1/10 TSA液体培养基中过夜活化并点接2 μl至病原菌菌片两边,点接处距离病原菌中心2.5 cm,对照为单独接种尖孢镰刀菌菌饼的平板,28 ℃培养7~8 d,观察是否有抑制效果,参照文献[14]计算其抑制率,选择抑制效果明显的菌株用于后续研究。菌株对不同病原菌的平板拮抗效果试验与此步骤相同。
将上述获得的菌株在1/10 TSA液体培养基中进行20次传代培养,选取第1、第5、第10、第15和第20代的菌液进行平板对峙试验,测量病原菌被抑制的菌落半径(r),筛选出在传代过程中对甜瓜尖孢镰刀菌的拮抗效果较稳定的菌株[25]。
将拮抗效果稳定的菌株分别接种至TSA液体培养基中,振荡(30 ℃,170 r/min)培养24 h制成含量约为1×108CFU/ml的菌悬液用于种子发芽率测试,对照为空白TSA培养基。挑取外观一致的甜瓜种子,用体积分数70%的乙醇溶液对种子进行表面消毒后使用无菌水冲洗干净。分别将种子放入上述生防菌菌悬液和空白TSA培养基中浸泡2 h,取出种子后置于灭菌培养皿内的湿润无菌滤纸上,每个处理50粒种子,3次重复。30 ℃条件下催芽36 h,统计并计算种子的发芽率[25]。
1.2.3 盆栽防效及促生试验 甜瓜种子催芽后在灭菌基质中播种育苗14 d,生防菌菌悬液制备参照方法1.2.2,在每株甜瓜根围分别接种3 ml含量为1×108CFU/ml的生防菌菌悬液,每个处理21株甜瓜,重复3次,空白对照设置为添加等量无菌TSA培养基。参照张美君等[12]的方法制备甜瓜枯萎病病原菌孢子悬液,生防菌菌悬液接种5 d后,在每株甜瓜根围接种2 ml甜瓜枯萎病病原菌孢子悬液(含量为1 ml 1×106个),于病原菌接种20 d后统计植株发病情况,参照郝芳敏等[11]的方法计算病情指数和防病效果。
甜瓜种子催芽后在灭菌基质中播种育苗14 d,挑选长势一致的幼苗,参照上述方法进行生防菌菌悬液接种,接种18 d后统计不同处理甜瓜苗的株高和鲜质量。
1.2.4 菌株生物膜形成试验 将过夜活化的生防菌菌株振荡培养,待其OD600达到1.0时,离心(5 000 r/min,5 min)收集菌体并用等体积的无菌水重悬。生物膜形成试验采用48孔细胞培养板,每孔接种1 ml MSgg培养基[21]和10 μl菌悬液,每处理设8个重复,以无菌水为对照,30 ℃条件下静置培养,在培养24 h和48 h時观察不同处理的生物膜形成情况。选取培养48 h形成的生物膜用于定量测定,将培养孔中的浮游生物膜及液体培养基在无菌条件下转移至细胞滤器(滤膜孔径为100 μm)中过滤,留在细胞滤网上的生物膜连同细胞滤器一起放置于超净工作台内吹干并称质量。
1.2.5 甜瓜根系分泌物的收集 甜瓜播种育苗30 d后轻轻拔起幼苗,将根部杂质冲洗干净,放入装有100 ml无菌去离子水的三角瓶中,每瓶2棵幼苗,培养24 h后收集三角瓶中的液体,置于冷冻干燥机中抽干,用去离子水将冻干物溶解,使其质量浓度为1 mg/ml,用滤膜(孔径为0.22 μm)过滤,保存于-80 ℃冰箱备用。
1.2.6 菌株对甜瓜根系分泌物的趋化试验 趋化定量试验参照文献[26],采用1 ml注射器作为毛细管,分别吸取100 μl不同质量浓度梯度(0.03 mg/ml、0.10 mg/ml、0.30 mg/ml、1.00 mg/ml)的甜瓜根系分泌物溶液,以无菌水为对照。待测菌株菌悬液制备参照方法1.2.4。使用无菌移液枪头(规格为200 μl)吸取菌悬液100 μl,将注射器的针头轻轻装入200 μl移液枪头内,放置于超净台内30 min,梯度稀释注射器中的溶液并进行平板涂布计数,获得注射器溶液中的菌落数,每个处理3次重复。趋化性指数(RCI)=处理菌落数的平均值/相应对照菌落数的平均值,一般当RCI≥2时[26],则认为与对照相比,处理的趋化性具有显著差异。
1.2.7 菌株的根际定殖试验 分别将菌株R1-3和R1-6接种至TSA液体培养基中,振荡培养(35 ℃,180 r/min)30 h左右,使菌株发酵液含量为1×109CFU/ml。将各菌株发酵液按照5%(体积比)的比例接种至灭菌基质中,混合均匀。甜瓜种子催芽后播种于基质中育苗16 d,轻轻拔起幼苗并将根上的基质抖落,称取1 g根放置于含9 ml无菌水的离心管中,使用涡旋仪剧烈振荡,吸取悬液进行梯度稀释和平板涂布计数,菌株数量以每克根质量计,用CFU/g表示。
1.2.8 菌株促生、耐盐特性研究 按照细菌IAA检测试剂盒(上海朗顿生物科技有限公司产品)说明书测定菌株IAA的产量。菌株溶磷能力的测定参照文献[23]。使用NaCl将牛肉膏蛋白胨培养基平板分别调至不同的盐含量(3%、5%、8%、11%和13%,质量体积比),将菌株划线接种至这些平板上并观察其生长状况,测试菌株的耐盐能力。
1.2.9 菌株的分子鉴定及系统发育树的构建 参照陈小娟[22]的方法,提取菌株R1-3的总基因组DNA,使用通用引物27F和1492R[22]进行16S rDNA序列扩增,对PCR扩增产物进行清洁回收并委托生工生物工程(上海)股份有限公司测序。测序结果在美国国家生物技术信息中心(NCBI)数据库中进行BLAST同源性比对,选取同源性较高且具有代表性的序列下载。使用MEGA 11.0内置ClustalW命令进行多序列比对,去除间隔后,通过自动分析找到最佳核酸替换模型为Kimura 2+Gamma分布,基于该模型构建Bootstrap为500的最大似然进化树,进化树采用FigTree 1.4.4制作。
1.3 数据分析
数据处理采用Microsoft Excel 2016软件,统计分析采用SPSS 19软件。
2 结果与分析
2.1 生防菌株的分离与初筛
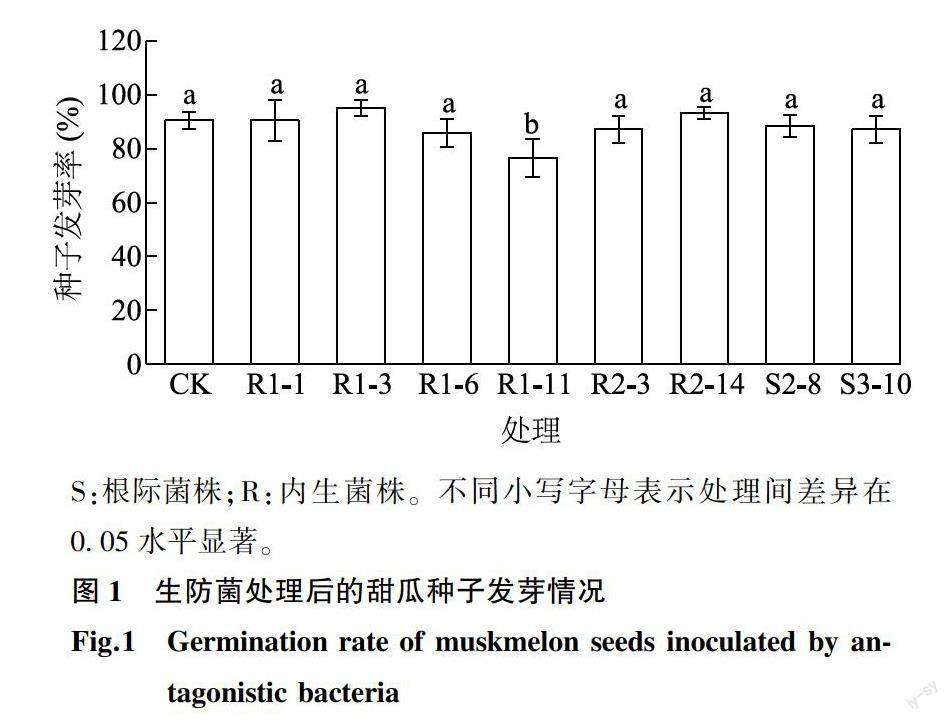
本试验从供试样品中分离获得根际菌株(用S表示)及内生菌株(用R表示)共122株,通过PDA平板对峙试验,发现其中12株菌株对甜瓜枯萎病病原菌尖孢镰刀菌有拮抗能力。在继代培养试验中,当在1/10 TSA液体培养基中连续培养至20代时,只有8株菌株仍对病原菌有一定的拮抗能力(表1)。因此推断这些菌株抑制甜瓜枯萎病病原菌的能力具有较好的稳定性,在农业实践中具有持续发挥作用的潜力。甜瓜种子发芽率测试结果(图1)表明,除了菌株R1-11外,其余7株菌株处理后的甜瓜种子发芽率为86.0%~95.3%,与对照的种子发芽率(90.7%)相比差异不显著(P>0.05),表明這7株菌株不影响甜瓜种子的发芽情况,可用于进一步试验。
2.2 生防菌对甜瓜的防病和促生效果
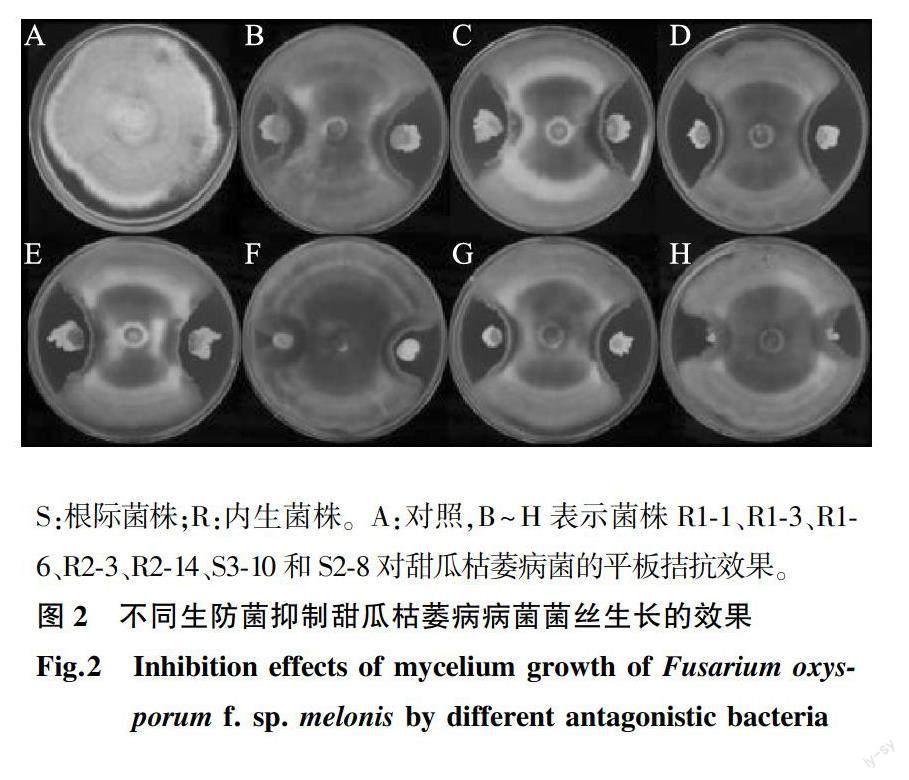
在平板对峙培养试验中,5株菌株的抑制率大于50%,其中菌株R1-6对甜瓜尖孢镰刀菌的平板抑制效果最强,抑制率达到59.2%(图2、表2)。在温室盆栽防效试验中,当病原菌接种20 d后,病害防控效果突出的菌株为R1-3和R1-1,病情指数分别下降50.2%和48.3%,防病效果分别达50.04%和48.41%(表2)。在促生试验中,生防菌接种18 d后,发现R1-3菌悬液处理可以显著提高盆栽甜瓜植株的株高和鲜质量,与对照相比,甜瓜苗株高增加了12.4%,鲜质量增加了25.0%(表2),表明菌株R1-3对甜瓜幼苗具有一定的促生作用。综上所述,经菌株R1-3处理的甜瓜苗发病最轻且具有促生效果,综合表现最佳。试验还发现,生防菌的实际防治效果和平板上的抑制率并不具有相对应的关系。
2.3 生防菌株的生物膜形成能力、对根系分泌物的趋化性及其根际定殖研究
由上述分析可知,平板抑制率最高的菌株R1-6,其实际防效却并不理想,而菌株R1-1和R1-3尽管平板抑制率不是最佳,却有更好的实际防效。为了进一步探索其中的原因,以菌株R1-1、R1-3和R1-6为研究对象,分别测试不同菌株的生物膜形成能力及其对甜瓜根系分泌物的趋化能力。在静态培养条件下3株菌株的生物膜逐渐成熟,培养时间达到48 h时,生物膜呈现出褶皱复杂且致密的状态(图3)。定量试验结果表明,3株菌株的生物膜质量(24孔细胞培养板中1个孔的生物膜质量)分别为20.55 mg、21.32 mg和22.31 mg,三者之间差异不显著(P>0.05),说明3株菌株都能够形成强健的生物膜结构。趋化定量试验结果(图3)表明,在0.01~1.00 mg/ml甜瓜根系分泌物质量浓度范围内,随着根系分泌物质量浓度的升高,3株菌株的趋化性指数都呈现先升高再降低的趋势。菌株R1-1表现出对低质量浓度根系分泌物(0.01~0.03 mg/ml)的趋化性不显著(RCI<2),对较高质量浓度的根系分泌物(0.10~1.00mg/ml)趋化性显著(RCI≥2)。而菌株R1-3在测定范围内对任意质量浓度的根系分泌物都具有显著趋化性,表明该菌对甜瓜根系分泌物的趋化性较强,可推测其在土壤环境中更容易向甜瓜根际趋化从而实现在根表的定殖成膜。在根系分泌物质量浓度为0.10 mg/ml和0.30 mg/ml时,3株菌株的趋化性都具有显著性差异,但菌株R1-6的趋化性指数(RCI)最低,且R1-6对其他质量浓度的根系分泌物趋化性都不显著,表明菌株R1-6对甜瓜根系分泌物的趋化现象较弱,这很可能造成其根际定殖能力较差并导致其实际防效不佳。为了验证推测,选取菌株R1-3和R1-6为研究对象,测试其根际定殖数量。结果表明,育苗16 d后,菌株R1-3在甜瓜根际的定殖数量达1.84×107CFU/g,而菌株R1-6的定殖数量显著低于R1-3,仅有2.2×106CFU/g,说明其根际定殖能力较差。
2.4 菌株R1-3的其他生物学特性
菌株R1-3与不同植物(西瓜、黄瓜)专化型尖孢镰刀菌及蔓枯病病菌的平板对峙试验结果(图4)表明,该菌也能够抑制这3种供试病原菌的生长。促生因子的定量测定结果表明,菌株R1-3具有一定的产吲哚乙酸(IAA)、溶解无机磷的能力,其分泌IAA的量为1.27 mg/L,溶磷量为39.65 mg/L,这可能是该菌促进植物生长的原因。耐盐能力检测结果表明,菌株R1-3最高可耐受11%(质量分数)的NaCl,达到中度的耐盐水平[24],推测其在连作条件导致的盐渍化土壤中具有一定的生存能力。综上,可将菌株R1-3作为防控植物病害和促进植物生长的功能菌进行开发和利用。
2.5 菌株系统鉴定
将菌株R1-3的16S rDNA序列提交到NCBI中进行比对,利用FigTree 1.4.4软件构建系统发育树,如图5所示,R1-3与贝莱斯芽孢杆菌(Bacillus velezensis)FZB42在同一分支,相似性最高,初步鑒定R1-3为芽孢杆菌属细菌(Bacillus sp.)。
3 讨论
芽孢杆菌具有生长速度快、环境友好以及抗逆性强等特点,在防控植物病害和促进作物生长等方面都具有良好的表现,应用前景广阔[27-29]。本研究首先在贫营养条件下分离细菌,然后初筛出能够稳定拮抗甜瓜枯萎病病菌且不影响种子发芽率的生防菌株,进一步利用温室盆栽试验复筛出对甜瓜幼苗枯萎病防控效果较好且具有促生作用的菌株R1-3。该菌被鉴定为芽孢杆菌属细菌,与贝莱斯芽孢杆菌的同源性较近,在以后的工作中需要进一步确定其具体到种的分类地位。
生防芽孢杆菌可通过多种机制帮助植物抵御病原菌侵染,例如产生抗生素抑制病原菌生长、与病原菌竞争养分和生态位及诱导植物系统产生抗性等[16,30-34],也可通过产植物激素IAA、溶磷增加养分获取等促进植物生长的方式间接发挥其生防功能[35]。菌株R1-3能够抑制不同植物专化型尖孢镰刀菌和蔓枯病病菌的生长,可通过产IAA、溶磷等方式提高甜瓜幼苗株高及鲜质量,兼具抵御病害和促生功能,然而其具体防病机制还有待更深入的研究。
研究中发现不能简单地将生防菌的平板抑菌能力直接等同于该菌的病害防控能力。杨迪等[36]在筛选鉴定香蕉枯萎病拮抗菌过程中发现拮抗菌盆栽防效强弱与其平板测试的抑菌活性高低并不一致。说明在筛选过程中,如果仅以实验室条件下的平板抑制率对菌株进行取舍,很可能会遗漏一些实际防效好的菌株。王亚娇等[37]的研究也充分证实这一点,所以,提倡将平板对峙试验和温室生物学指标测定(包括菌株对植物生长的影响及防病效果测定)结合起来,才能够更准确地评估拮抗菌的生防能力。本研究中的菌株筛选思路与此一致,然而此方法在筛选对象数目较多时,大量候选菌株的温室生物学指标测定会产生较大的工作量。相关研究结果表明,微生物功能的稳定发挥还要依赖于其在植物根际能够有效定殖[15],菌株在植物根际的定殖能力又与其对根系分泌物的趋化性和生物膜形成能力紧密相关[16]。因此,本研究进一步探索了试验中获得的代表性菌株的生物膜形成能力、趋化性及根际定殖能力,试验结果与上述观点一致。实际病害防控能力最好的菌株R1-3对不同质量浓度的甜瓜根系分泌物都具有显著趋化性,还能形成强健的生物膜,并且具有较强的根际定殖能力。而在平板上表现出最强抑制能力的菌株R1-6,虽然生物膜形成能力与R1-3没有显著差异,但其对根系分泌物的趋化性较弱,其根际定殖能力也相应较差,这很可能是其在盆栽试验中防效不佳的原因。由此可见,生物膜形成能力相当的前提下,对根系分泌物趋化性强的菌株拥有更有效的根际定殖能力和对病害的实际防控能力。鉴于部分植物促生菌能够有效利用根系分泌物从而实现根际定殖,崔晓双等[38]在根际促生菌的筛选工作中将菌株对根系分泌物竞争能力的强弱作为初筛标准,在一定程度上减少了工作量且筛选出对根系分泌物中的营养物质具有高竞争能力的菌株。本研究结果表明,可以将平板对峙试验结果和根际定殖能力结合起来考量菌株特性,即把候选菌株对根系分泌物的趋化性和生物膜形成能力纳入初筛标准,选择综合表现较好的生防菌株进行温室生物学试验验证。
综上,生防芽孢杆菌R1-3是一株有着较强根际定殖能力的多功能生防菌株,下一步将探索该菌的规模化培养条件和田间防效,以期为开发防控甜瓜土传病害的生物肥料及微生物制剂奠定基础。
参考文献:
[1] 孙兴祥,周 峰,倪 玮,等. 江苏省西/甜瓜地的土壤养分状况及其对种植年限的响应[J]. 中国农学通报,2018,34(31):106-111.
[2] 刘 广,徐锦华,张 曼,等. 江苏省西甜瓜产业现状与发展对策[J]. 中国蔬菜,2021(11): 6-11.
[3] 彭 云,齐英杰,姜桂翠,等. 甜瓜连作障碍研究进展[J]. 安徽农学通报,2019,25(12): 55-56.
[4] 陈开端,韩翠婷,戴峥峰,等. 浅谈西甜瓜蔓枯病和枯萎病的诊断与防治[J]. 中国蔬菜,2019(8): 104-105.
[5] 顾美玲. 西甜瓜枯萎病化学防治和生物防治初步研究[D]. 长春:吉林农业大学,2019.
[6] BUBICI G, KAUSHAL M, PRIGIGALLO M I, et al. Biological control agents against Fusarium wilt of banana[J]. Frontiers in Microbiology,2019,10. DOI: 10.3389/fmicb.2019.00616.
[7] FIRA D, DIMKIC' I, BERIC' T, et al. Biological control of plant pathogens by Bacillus species[J]. Journal of Biotechnology,2018,285: 44-55.
[8] 王卫雄,沈 博,贾洪柏,等. 根际生防菌群的应用及其防病增效的潜在机制[J]. 生物技术通报,2020,36(9): 31-41.
[9] RAZA W, LING N, ZHANG R F, et al. Success evaluation of the biological control of Fusarium wilts of cucumber, banana, and tomato since 2000 and future research strategies[J]. Critical Reviews in Biotechnology,2017,37(2): 202-212.
[10]李彩虹,杨志辉,张 岱,等. 马铃薯枯萎病拮抗菌的筛选与鉴定[J]. 江苏农业科学,2018,46(13): 92-95.
[11]郝芳敏,臧全宇,马二磊,等. 甜瓜多种真菌病害拮抗细菌NBmelon-1的鉴定及其促生和生防效果[J]. 中国瓜菜,2021,34(7): 14-19.
[12]张美君,吴 庆,尹 翠,等. 尖镰孢黄瓜专化型枯萎病菌拮抗菌的筛选、鉴定及培养条件优化[J]. 生物技术通报,2020,36(9): 125-136.
[13]马 兴,董星晨,张 健,等. 黄瓜枯萎病拮抗菌的拮抗促生因子检测及生物效应研究[J]. 干旱地区农业研究,2018,36(3): 130-138.
[14]李晓芳,田叶韩,彭海莹,等. 防治苦瓜枯萎病的拮抗放线菌分离筛选及鉴定[J]. 应用生态学报,2020,31(11): 3869-3879.
[15]张瑞福. 根际微生物:农业绿色发展中大有作为的植物第二基因组[J]. 生物技术通报,2020,36(9): 1-2.
[16]NOMAN M, AHMED T, IJAZ U, et al. Plant-microbiome crosstalk: dawning from composition and assembly of microbial community to improvement of disease resilience in plants[J]. International Journal of Molecular Sciences,2021,22(13): 6852.
[17]朱曉艳,沈重阳,陈国炜,等. 土壤细菌趋化性研究进展[J]. 土壤学报,2019,56(2): 259-275.
[18]EVEN C, MARLI?RE C, GHIGO J M, et al. Recent advances in studying single bacteria and biofilm mechanics[J]. Advances in Colloid and Interface Science,2017,247: 573-588.
[19]CHEN Y, YAN F, CHAI Y R, et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation[J]. Environmental Microbiology,2013,15(3): 848-864.
[20]SUN X L, XU Z H, XIE J Y, et al. Bacillus velezensis stimulates resident rhizosphere Pseudomonas stutzeri for plant health through metabolic interactions[J]. ISME Journal,2022,16(3): 774-787.
[21]张 楠. 根际有益芽孢杆菌N11及SQR9与植物根系的互作研究[D]. 南京:南京农业大学,2012.
[22]陈小娟. 增强作物耐盐胁迫能力的根际促生菌筛选及田间应用效果研究[D]. 南京:南京农业大学,2019.
[23]刘 娜. 解磷解钾促生微生物肥料用菌株的分离[D]. 沈阳:沈阳农业大学,2020.
[24]李 晋,普 倩,张帅帅,等. 西瓜枯萎病多功能生防细菌的筛选和抗病效果[J]. 浙江理工大学学报(自然科学版),2021,45(5): 685-690.
[25]余小兰,邹立飞,邹雨坤,等. 甜瓜枯萎病拮抗菌的筛选及鉴定[J]. 南方农业学报,2018,49(6): 1118-1124.
[26]冯海超. 根系分泌物组分与SQR9基因转录的相关性分析及其趋化与成膜的影响[D]. 南京:南京农业大学,2015.
[27]王 静,赵廷昌,孔凡玉,等. 枯草芽孢杆菌SH7抑菌物质及其特性[J]. 植物保护学报,2007,34(4):443-444.
[28]陈志杰,谢江辉,陈宇丰,等. 一株植物病原拮抗细菌的分离筛选及拮抗物质[J].生态学杂志,2018,37(5):1595-1604.
[29]杨 璐,周蓓蓓,侯亚玲,等. 枯草芽孢杆菌菌剂对盐胁迫下冬小麦生长与土壤水氮分布的影响[J]. 排灌机械工程学报,2021,39(5):517-524.
[30]杨 威,闫海霞,刘雨昕,等. 芽孢杆菌1JN2产胞外多糖协助寄主植物缓解镉胁迫[J]. 江苏农业科学,2022,50(6):211-216.
[31]黎燕珊,崔文艳,张陈芳,等. 抗金银花白粉病菌贝莱斯芽孢杆菌HC-8菌株培养基及发酵条件优化[J]. 南方农业学报,2021,52(8):2148-2157.
[32]张文韬,杨 皓,毛国豪,等. 一株高地芽孢杆菌的鉴定与促生能力研究[J]. 江苏农业科学,2022,50(5):225-229.
[33]王丽萍,陈 涛,方石桂,等. 广西剑麻黑斑病病原菌鉴定及其生防菌筛选[J]. 南方农业学报,2021,52(7):1912-1922.
[34]方 佩,罗远婵,田 黎,等. 1株海洋芽孢杆菌对黄瓜灰霉病的防治效果及防治机制研究[J]. 江苏农业科学,2022,50(2):91-96.
[35]马 兴,董星晨,张 健,等. 黄瓜枯萎病拮抗菌的拮抗促生因子检测及生物效应研究[J]. 干旱地区农业研究,2018,36(3): 130-138.
[36]杨 迪,杜婵娟,张 晋,等. 香蕉枯萎病拮抗菌贝莱斯芽胞杆菌的筛选鉴定及其生物学特性[J]. 中国生物防治学报,2021,37(1): 165-171.
[37]王亚娇,栗秋生,纪莉景,等. 一株西瓜枯萎病生防菌的鉴定与田间防效[J]. 微生物学通报,2021,48(6): 1976-1984.
[38]崔晓双,王 伟,张 如,等. 基于根际营养竞争的植物根际促生菌的筛选及促生效应研究[J]. 南京农业大学学报,2015,38(6): 958-966.
(责任编辑:陈海霞)

