CaSR激动剂R568灌胃对小鼠摄食影响及机制
韩冰,郭亚杰,金婷婷,孙向荣
(青岛大学基础医学院生理学与病理生理学系,山东 青岛 266071)
钙离子敏感受体(CaSR)是典型的G蛋白偶联受体,主要通过调节甲状旁腺激素的释放来控制钙稳态[1-2]。研究表明,CaSR在胃基底膜细胞、G细胞及肠神经系统内均有表达[3-4]。近年来CaSR在调节胃肠功能中的作用逐渐被重视。CaSR作为营养感受器,可以被Ca2+和蛋白质代谢产物L-氨基酸激活,参与肠道液体转运和炎症反应的调控[5-6]。动物实验显示,CaSR激动剂 R568已被普遍应用于CaSR功能学的研究[7]。胃肠道是机体最大的内分泌器官[8],刺激胃肠道可产生多种肽类激素,包括胆囊收缩素(CCK)、胰高血糖素样肽-1(GLP-1)、酪酪肽(PYY)等[9-10],这些肽类激素通过脑肠轴将信号传向中枢,使机体产生饱腹感,从而终止摄食。空腹时胃肠道可释放胃饥饿素 (Ghrelin),促进进食[11]。以往的研究结果显示,胃肠道摄食调节激素的分泌与CaSR密切相关[12]。此外,下丘脑为摄食调节的中心,包括弓状核(ARC)、室旁核(PVN)、外侧区(LHA)[13-14]等脑区,这些脑区的神经元对摄食功能的调控由多种神经递质参与完成,包括一些肽类神经递质(如CCK和Ghrelin)以及一些胺类神经递质(如多巴胺(DA)和5-羟色胺(5-HT))[15]。有研究显示,在下丘脑神经元上有大量的CCK、Ghrelin、DA和5-HT受体[15-16],进一步说明这些神经递质参与下丘脑功能的调节。本文研究探讨CaSR激动剂R568对小鼠摄食的影响,并从调控胃肠激素分泌、对中枢摄食相关脑区神经元兴奋性的影响和相关神经递质释放的角度揭示其调控机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 健康成年雄性KM小鼠60只,体质量25~30 g, 购于青岛大学动物实验中心。动物饲养间室温(22±2)℃,相对湿度40%~50%,光照12 h/12 h昼夜循环,室内提供充足的食物和水。所有动物实验方案均由青岛大学医学系动物保护与使用委员会批准。
1.1.2实验药物和试剂 CaSR激动剂R568(Tocris bioscience,英国);CaSR拮抗剂NPS-2143(Glpbio,美国);胆囊收缩素A(CCKA)受体拮抗剂L-364,718(Tocris bioscience,英国);多聚甲醛(Sigma-Aldrich,美国);鼠抗c-fos抗体(Abcam,英国);荧光素Cy3标记的二抗(Jackson Immunoresearch,美国)。
1.2 检测指标及方法
1.2.1外周给药R568对小鼠摄食量的影响 将小鼠随机分为二甲基亚砜(DMSO,1 mg/kg)对照组(A组)、R568(3.0 μg/g)给药组(B组)、CCKA受体拮抗剂L-364,718(50 mg/kg)+R568(3.0 μg/g)组(C组)、NPS-2143(20 μg/g)+R568(3.0 μg/g)组(D组),每组8只小鼠。实验从18:00开始,笼子里放置预先称质量的标准饲料,各组小鼠灌胃给药0.3 mL后,分笼单独饲养,收集每个笼子剩余的饲料,称量后记录,计算出给药后0~、1~、2~、4~24 h小鼠的摄食量。
1.2.2摄食相关肽表达检测 选取14只小鼠随机分为R568组(3.0 μg/g)、 DMSO对照组(1 mg/kg)(n=7),灌胃给药1 h后,眼球取血,室温下放置2 h凝聚后取血清;同时脱臼处死小鼠,取出胃肠组织,剪开冲洗干净,称质量,按1∶9加入相应体积的0.01 mol/L PBS进行研磨,之以3 000 r/min速度离心20 min,取上清液。采用酶联免疫吸附试验(ELISA)方法,检测小鼠血清、胃肠道CCK、Ghrelin、PYY、GLP-1和下丘脑CCK、Ghrelin含量,严格按照试剂盒说明书进行操作。
1.2.3免疫荧光染色法检测下丘脑内参与摄食的相关脑区c-fos的表达 小鼠静脉注射戊巴比妥(100 mg/kg)麻醉,断头取脑,在40 g/L甲醛溶液中固定6~8 h,再置于300 g/L蔗糖溶液中脱水。按照小鼠脑图谱,找到下丘脑,冷冻切片,厚度10~15 μm,放入-40 ℃冰箱保存。按相关文献方法[4],将组织处理之后滴加抗鼠c-fos抗体(1∶1 000),4 ℃孵育过夜;滴加Cy3标记的二抗(羊抗鼠,1∶300),室温孵育2 h。封片,BX53荧光显微镜下观察核团内c-fos免疫阳性细胞的表达,并拍照。每张切片选择4~6个不重叠的0.01 mm2视野,使用CellProfiler-3.1.8软件进行细胞计数。
1.2.4高效液相色谱(HPLC)检测相关神经递质的含量 将14只小鼠分别灌胃给药3.0 μg/g R568或10 g/L DMSO,1 h后经颈椎脱臼处死,分离下丘脑,存放在-80 ℃冰箱。①神经递质提取:准确称量样品,按1∶5的比例加入高氯酸溶液(0.6 mol/L),超声匀浆,4 ℃离心(10 000 r/min, 20 min)。取上清与1.4倍体积的混合液体(20 mmol/L柠檬酸钾,300 mmol/L磷酸氢二钾,2 mmol/L EDTA二钠盐,双蒸水配制),4 ℃离心(10 000 r/min, 20 min),取上清液进行色谱分析。②色谱条件为:色谱柱为Kinetex C18 100A 2.6 μm,50.0 mm×2.1 mm,流动相为甲醇∶双蒸水=90∶10,0.45 μm微孔膜过滤,超声波脱气,流量1.0 mL/min,注入量10 μL/min;发射波长330 nm,激发波长290 nm;柱温30 ℃。③样品含量测定:将20 μL样品溶液注入液相色谱仪,在上述色谱条件下测定下丘脑肽类神经递质Ghrelin、CCK和胺类神经递质DA和5-HT的含量。
1.3 统计学处理
2 结 果
2.1 R568灌胃对小鼠摄食量的影响
重复测量设计的方差分析显示,各组小鼠摄食量比较,组别差异有显著性(F组别=165.800,P<0.01),时间差异无显著性(F时间=1.147,P>0.05),时间与组别无交互作用(F组别×时间=1.263,P>0.05)。与DMSO组相比,R568给药组摄食量在0~、1~时段明显减少(F=5.274、5.225,P<0.01),而2~24 h内小鼠摄食量差异无显著性(P>0.05);L-364,718+R568组和NPS-2143+R568组0~、1~时段小鼠摄食量差异均无显著性(P>0.05)。与R568组相比,0~、1~时段的NPS-2143+R568组摄食量明显增加(P<0.05),而0~2 h内L-364,718+R568组小鼠的摄食量也有增加的趋势,但差异无统计学意义(P>0.05)。各组组内不同时间小鼠摄食量差异均有显著性(F=55.000~250.900,P<0.001)。见表1。

表1 R568灌胃对小鼠摄食量的影响
2.2 R568灌胃对小鼠血清、胃及小肠内摄食相关肽类激素含量的影响
ELISA检测结果显示,与DMSO组相比,R568组血清和胃内Ghrelin的含量显著降低(t=2.995、4.939,P<0.05),而血清和近端小肠CCK的含量显著增高(t=3.223、4.971,P<0.05),血清和远端小肠PYY、GLP-1的含量无明显变化(P>0.05)。见表2、3。

表2 两组小鼠血清摄食相关肽类激素含量比较

表3 两组小鼠胃及小肠摄食相关肽类激素含量比较
2.3 R568灌胃对小鼠下丘脑摄食相关核团c-fos免疫阳性神经元表达的影响
荧光免疫组化染色显示,与DMSO组相比较,R568组下丘脑PVN、LHA、ARC中c-fos免疫阳性神经元的数量均明显增加,差异均具有显著性(t=3.508~6.169,P<0.05)。见图1、表4。
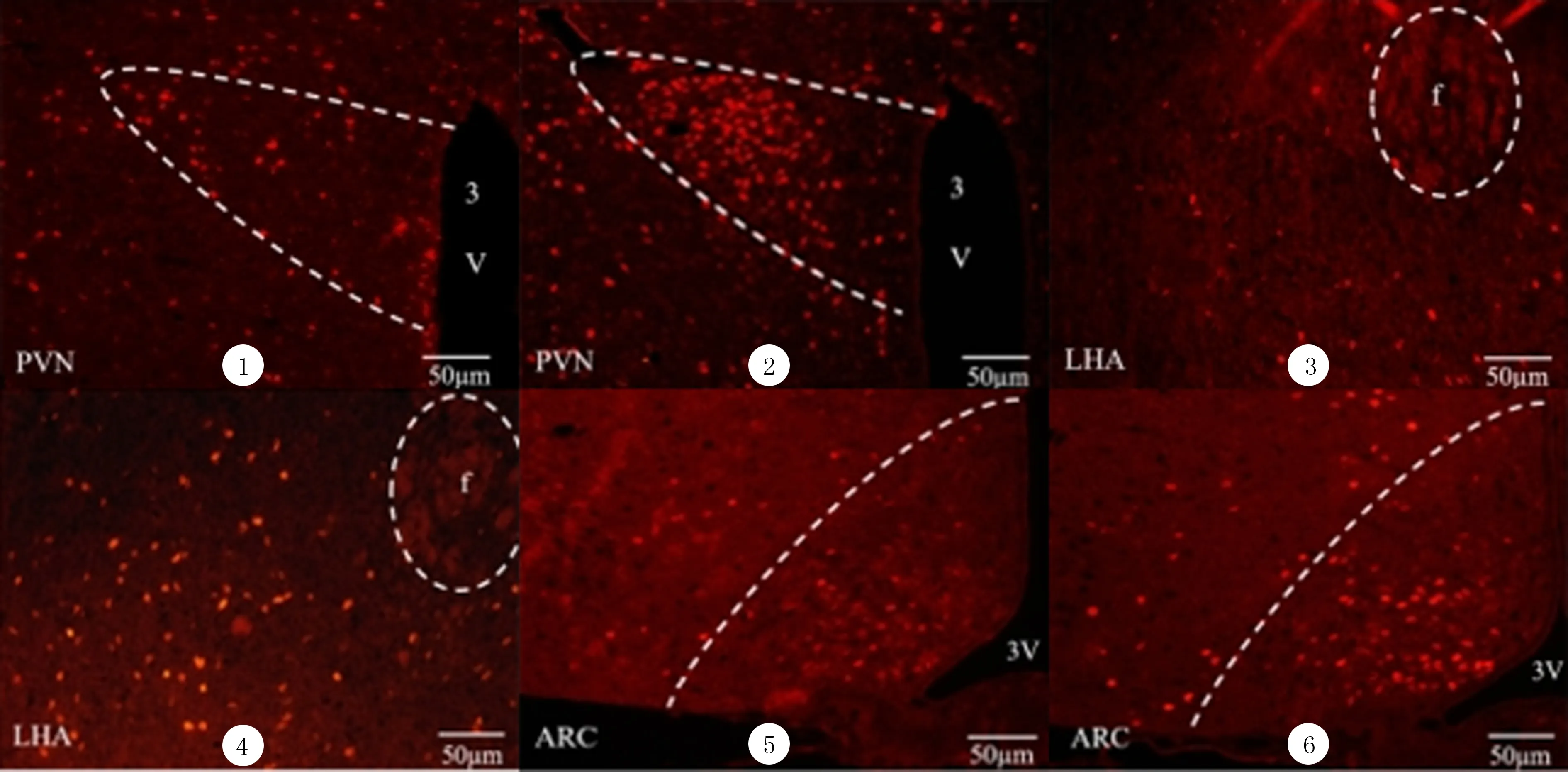
①、③、⑤:DMSO灌胃后下丘脑PVN、LHA、ARC中c-fos的表达;②、④、⑥:R568灌胃后下丘脑PVN、LHA、ARC中c-fos的表达。
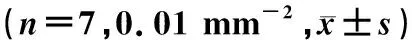
表4 两组中枢摄食核团c-fos免疫阳性神经元的数量
2.4 R568灌胃对小鼠下丘脑肽类和胺类神经递质表达的影响
HPLC结果显示,与DMSO组相比,R568组小鼠下丘脑Ghrelin、CCK、5-HT含量差异无显著性(P>0.05),而DA的含量明显减少(t=3.288,P<0.05)。见表5。
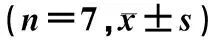
表5 两组下丘脑肽类和胺类神经递质含量比较
3 讨 论
胃肠肽类激素通过刺激机体产生饥饿或者饱腹信号而促进摄食或停止进食,从而使机体达到能量平衡[17],这些肽类激素包括CCK、GLP-1、PYY等具有抑制摄食功能的脑肠肽及Ghrelin等促摄食因子[11]。WANG等[18]研究发现,L-精氨酸(L-Arg)能够通过诱导猪十二指肠内CCK的分泌来减少食物的摄入,而CaSR拮抗剂NPS-2143能使CCK分泌减少。ACAR等[19]研究发现,大鼠十二指肠内给予L-色氨酸(L-Phe)后,可以诱导GLP-1的分泌,但是并不能影响PYY的分泌,而且其分泌是通过CaSR介导的。本文研究表明,R568灌胃给药0~2 h内小鼠的摄食量明显减少,该作用可以被NPS-2143阻断;ELISA结果显示,小鼠血清和胃内Ghrelin的分泌减少,而CCK的分泌增加,与相关文献结果一致[18]。提示R568通过激活胃肠道的CaSR,调控分泌Ghrelin的X/A样[20]内分泌细胞以及分泌CCK的I细胞[21]的活性,诱导Ghrelin和CCK分泌,从而起到抑制摄食的作用。本文研究结果还显示,R568灌胃并不能影响远端小肠GLP-1的分泌,这与相关文献结果不一致[19],考虑是由于给药剂量或者给药方式的不同所造成的;但是R568灌胃不影响PYY的分泌,与相关文献结果一致[19]。
胃肠道合成和释放的肽类激素可以通过血液或者迷走神经途径作用于中枢相关摄食核团,从而影响食欲[22]。本文免疫荧光染色观察结果显示,灌胃给药R568后,下丘脑PVN、LHA、ARC中c-fos免疫阳性神经元的数目增加,说明外周CaSR激活后影响到下丘脑摄食相关核团神经元的兴奋性,从而引起小鼠摄食量的改变。本研究R568灌胃给药对小鼠摄食量的影响是否与这些核团内摄食肽的分泌相关?本文对其进行了研究,结果显示,R568灌胃给药后,下丘脑Ghrelin、CCK和5-HT的含量并无明显变化,而DA表达量明显减少。大脑内的DA能神经元主要集中在腹侧被盖区(VTA)、下丘脑及中脑黑质致密区,下丘脑中DA主要起促进摄食的作用,而VTA中的DA活动与奖赏摄食相关[23]。由此推测,R568对下丘脑神经元兴奋性的影响以及对DA合成的影响可能是由外周肽类激素合成的改变,通过神经或内分泌作用引起的。另一种可能的机制是,下丘脑摄食相关核团也有CaSR的表达,而R568呈脂溶性,因此可能透过血-脑脊液屏障,直接进入中枢激活CaSR从而引起下丘脑神经元兴奋性及中枢递质合成的变化。
综上所述,R568灌胃给药起厌食作用,该作用和其调节消化道肽类激素Ghrelin和CCK的分泌,以及抑制下丘脑DA的合成有关。而这些肽类激素和神经递质的改变进一步参与下丘脑相关摄食核团神经元的兴奋性的调节,最终起到抑制摄食的作用。本文研究为深入了解CaSR在能量代谢调节方面的作用提供重要的实验依据,为能量代谢性疾病的治疗提供新的研究靶点。

