鲜切花采后衰老分子特征与保鲜技术研究进展
王冰 黄安琪 王雷
摘要:鲜切花是花卉产业的重要组成部分。鲜切花在剪切后的生理变化导致了其衰老进程的加快,极大影响切花的品质,尤其对于商业性花卉,贮藏保鲜技术更是限制其产业发展。针对此现象,综述了鲜切花采后衰老分子特征,包括水分代谢、呼吸代谢、大分子物质代谢、细胞膜的变化、内源激素变化及细胞的超微结构变化。归纳整理各类不同的保鲜方法,从化学保鲜方法(保鲜剂、液膜剂、1-MCP)、物理保鲜(包装保鲜、低温贮藏、气调贮藏、减压贮藏、抗蒸腾剂、辐射保鲜)以及基因调控技术三方面进行概括,为研究鲜切花采后衰老分子特征与贮藏保鲜技术提供了解决方法。
关键词:鲜切花;采后衰老;分子特征;保鲜技术
中图分类号:S680.9+3文献标志码:A
文章编号:1002-1302(2023)10-0030-09
鲜切花是指从活的植株上,切取其具有观赏价值的部位,如叶、枝、花果等,制作成花卉装饰的植物材料。花卉产业被称为朝阳企业,目前的发展正处于蓬勃向上时期,近几年来,我国的鲜切花产业不断发展,出口量不断增加,出口额总体稳步上升,出口创汇能力不断提高。鲜切花的消费现在已经不局限于经济发达城市,在三四线城市中,鲜切花的市场也是尤为庞大,人们的需求量开始剧增。
我国最常用的鲜切花有唐菖蒲、月季、玫瑰、菊花、康乃馨、非洲菊、剑兰、红掌、马蹄莲、百合等。截至2018年,我国主要出口的鲜切花仍然是以传统名花为主,例如玫瑰、康乃馨、菊花、百合等,其种植面积在我国的花卉种植面积上占绝对优势,导致我国鲜切花出口存在品种老化、产品质量不高、附加值低、难以占据高端市场等困境。在切花的育种上我国取得一定进展,在2000—2016年育成月季新品种多达139个[1]。切花的种类和品种也愈加丰富,出现一些新型切花,例如切花向日葵等也占有了一定市场[2],满足了一定人群的审美需求。
切花是脱离植株但具有生命力的花枝,但其不易贮藏且生命期相对较短,在销售环节上依赖切花的保鲜技术水平。造成切花瓶插寿命缩短的主要原因可能是微生物侵染致使维管束堵塞致使水分胁迫引起枯萎,大分子物质代谢导致株体营养缺乏,细胞膜通透性增加,发生氧化以及植物细胞内源激素发生变化加速衰老进程。切花的贮藏保鲜是花卉生产的重要环节,尤其相对于商品性花卉,延长鲜切花的瓶插寿命,保证其在运输和销售时的品质,是鲜切花保鲜的重要研究方向。关于切花保鲜技术一直都有报道,不同试剂组合对非洲菊鲜切花的保鲜效果具有差异性[3],微波预处理和化学保鲜剂相结合的复合保鲜技术对马蹄莲的保鲜效果最佳[4],但对于鲜切花衰老分子特征的研究鲜有报道。本文综述鲜切花采后衰老分子特征,为进一步探究鲜切花衰老机制奠定基础。
1鲜切花的采后衰老分子特征
1.1水分代谢
切花的花瓣只有保持一定程度的膨压,吸水量与失水量达到水分平衡,才不会出现萎蔫状态。当鲜切花采收后进行瓶插水养时,会发生水分失衡,这对于切花的衰老有着重要影响。其原因主要有以下两点,一是由于花枝与母体根系发生割裂,无法再从根系获得水分供应,导致其吸水量与失水量不能保持平衡;二是木质部导管部分或者全部被堵塞,从而减少了水分的运输。木质部导管被堵塞的主要原因为微生物的堵塞、物理堵塞、生理堵塞[5]。相对于绝大部分切花来说,在瓶插水养的早期,其花枝的吸水量是相对较多的,这就导致保卫细胞开始膨胀,从而打开气孔,随着时间推移花枝吸水量也随之减少,切花开始发生水分胁迫,保卫细胞因为水分亏缺的原因,开始关闭气孔,减少水分的丧失,顾菁菁等对不同绣球切花品种采后的水分变化研究[6]也证实了这一点。尽管切花的叶片会关闭气孔,来减少蒸腾作用带来的水分丧失,但是并不能完全使水分蒸发被限制,气孔密度大小和其蒸腾作用的水分丧失成正比。水通道蛋白存在于不同物种木质部周围的薄壁组织中,并已被证明参与了薄壁细胞与木质部导管之间的水分运动[7]。水通道蛋白(AQPs)有4个亚家族,即质膜内源蛋白(PIPs)、液泡膜内源蛋白(TIPs)、类NOD26内源蛋白(NIP)和小碱性内源蛋白(SIPs),其中PIPs和TIPs在植物细胞中发挥着控制水分平衡的作用[8]。水通道蛋白是生物膜上水分运输的主要通道,能够促进水分通过生物膜,有研究表明乙烯通过抑制一个质膜水通道蛋白基因Rh-PIP2;1的表达,显著降低了月季花瓣的大小,抑制了花瓣背轴下表皮细胞的膨大,降低了花瓣含水量[9]。有研究表明,克隆的水通道蛋白基因Rh-TIP1;1在月季快速开花过程中保持着较高的表达量,在花朵开放时开始呈现下降趋势,乙烯和水分亏缺都会降低其表达[10]。
1.2呼吸代谢
切花寿命的长短与其在采后的呼吸代谢变化是紧密相联的。切花采后依旧是以活体的形式存在,呼吸作用会消耗切花本身所贮藏的营养物质,从而维持自身生命活动。但切花在采收后被切断与母体根系的联系及外界环境因素的改变,几乎没有进行光合作用,无法正常继续累积营养物质。通过对各类切花的呼吸速率的研究发现,随着花的生长发育,呼吸速率也随之升高直至达到最高值,伴随着切花的衰老,其呼吸速率也开始下降,史田等对牡丹切花呼吸速率的测定也证实了这一点,切花开始萎蔫后呼吸速率呈现逐步下降再升高的趋势,与ATP合成密切相关的SnRK1基因表达量也呈现出先快速增加然后下降再增加的趋势[11]。
1.3大分子物质代谢
研究切花衰老时,可溶性蛋白质和可溶性糖的含量随着瓶插时间的推移逐渐降低是其一个生理指标。周琦等的研究表明,不同花色的香水莲花中,花瓣的可溶性蛋白质呈现先升后降的趋势[12]。蛋白水解酶通过内肽键降解蛋白质,是植物中最具特性的细胞死亡蛋白之一,例如半胱氨酸蛋白酶。研究发现转基因矮牵牛在乙烯处理后,6个半胱氨酸蛋白酶基因在乙烯诱导的花瓣衰老过程中显示出转录丰度的增加,总蛋白含量降低、蛋白水解活性增强[13]。有报道关于萱草硫醇蛋白酶(SEN11)的cDNA克隆,发现其基因的表达模式表明它们参与了花被片在衰老后期发生的蛋白质水解作用[14]。可溶性蛋白质的大量降解往往随着切花的衰老和氨基酸的生成進行,但同时也会产生一些新的蛋白质[15]。在切花衰老过程中,脱氧核糖核酸(DNA)、核糖核酸(RNA)发生降解,脱氧核苷酸和游离核苷酸明显增加[16]。姜微波研究发现当乙烯处理香石竹花瓣促进衰老时,花瓣中游离氨基酸的含量是增加的[17]。
1.4细胞膜的变化
切花在瓶插水养的过程中,伴随着时间的推移,切花的细胞膜相对透性也呈逐步增大趋势,脂氧合酶(LOX)活性的增加可引发脂质过氧化,丙二醛(MDA)的含量逐步增加,其含量的高低代表着膜脂的过氧化程度。细胞膜由于磷脂酶和酰水解酶的作用,导致磷脂减少,中性脂增加。花瓣在衰老的过程中,通过电导率仪测量得知其电导率也是随之增加的,可以用相对电导率来表示细胞膜的相对透性[18]。在动植物衰老过程中,活性氧(ROS)会导致膜的降解,生物膜过氧化的原因与活性氧的产生和清除系统的平衡失调有必然联系,也是造成切花衰老现象发生的主要原因,过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等,在切花瓶插水养的过程中,这几种酶的活性会发生变化,不能维持抗氧化稳态并造成氧化胁迫[19]。彭强等的研究表明,随着瓶插时间的推移切花的相对电导率及MDA含量等指标基本呈上升趋势,SOD和POD的活性也由逐步升高转变为逐步下降[20]。迟博文等对失水胁迫下百合切花施用γ-氨基丁酸,切花中SOD、CAT、APX和POD的活性相比对照组显著升高,能够减轻失水下的氧化胁迫[21]。
1.5内源激素变化
切花花瓣中含有乙烯(ETH)、脱落酸(ABA)、细胞分裂素(CTK)、赤霉素(GA)、生长素(IAA)五大内源激素,乙烯和ABA可加快其衰老进程,CTK、GA会延迟花瓣的衰老,而IAA不仅有促进衰老还兼具延迟花瓣衰老的作用,这五大内源激素之间含量极其平衡状态与切花的衰老密切相关。根据花朵衰老对外源乙烯的响应情况,可将切花分为乙烯敏感型和乙烯不敏感型两大类别。在乙烯敏感型花卉衰老过程中,乙烯起着重要调节作用,其他内源激素可作为其产生和活动的促进剂或抑制剂;而在乙烯不敏感型花卉中,乙烯的作用很小,甚至沒有作用。在乙烯不敏感型花卉中,ABA是衰老的主要激素调节因子,ABA能够引起许多衰老相关的变化,例如离子渗漏、脂质过氧化、蛋白酶活性以及DNA酶和RNase的表达[22]。在一些乙烯敏感型切花中,例如月季、牡丹,乙烯的生成会加快花瓣的衰老进程,但没有乙烯生物合成的正反馈调节,柱头中乙烯的产生是由于切花在衰老时触发了乙烯生物合成基因、1-氨基环丙烷-1-羧酸合成基因(ACSS)和1-氨基环丙烷羧酸(ACC)氧化酶基因(ACOs)的表达,乙烯可以通过诱导RhETR3和信号转导RhCTR基因来促进花瓣衰老[23]。切花在被剪切下来以后,失去了根部合成的CTK,同时随着切花衰老的进行,乙烯、ABA等激素的代谢是不断增加的[24]。研究表明切花瓶插期间IAA、GA、CTK含量下降,而ABA、乙烯含量上升,使切花的衰老进程加快,萎蔫状态加剧[25]。叶迪等研究发现花瓣基因PsYUCCA10调控着IAA的合成与运输,在瓶插过程中IAA合成酶基因PsYUCCA10表达量呈现先上升后快速下降的趋势[26]。
1.6细胞的超微结构变化
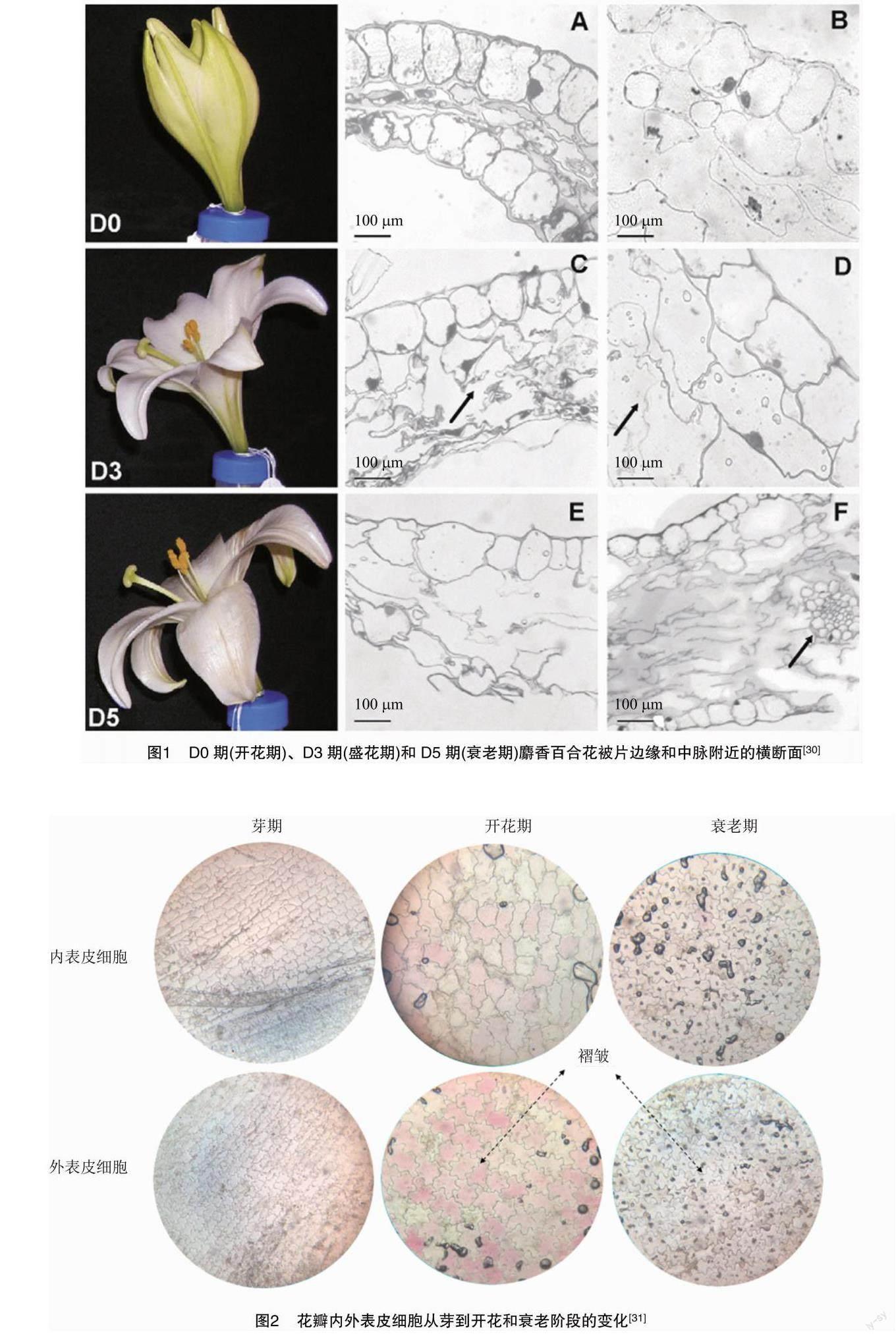
在切花衰老进程中,细胞内会发生各种结构和生理变化。在叶片衰老时,由于叶绿体中含有近70%的叶片蛋白,使得叶绿体的变化最为显著。花朵衰老时,则是伴随着叶肉细胞的降解[27]。但有时叶肉细胞与表皮细胞的死亡会同时进行,肉眼可见的衰老只与表皮细胞的死亡相关,Hoeberichts等对满天星花瓣细胞死亡的研究[28]也证实了这一点。在花瓣衰老过程中,花瓣细胞表现出与细胞程序性死亡(PCD)相关的形态学变化,液泡膜破裂和细胞质迅速被破坏[29]。Battelli等在对麝香百合衰老时细胞结构的超微变化研究中发现在接近自溶的细胞中,细胞质稀释导致质膜从细胞壁脱落,液泡与细胞质混为一体(图1)[30]。Zhang等对百合切花采后发育形态的研究发现,从蕾期到开花衰老期,花瓣内外表皮细胞的变化是由小增大再减小,且花瓣内外表皮细胞壁上的褶皱逐渐增加,花期中细胞吸收水分并膨胀(图2)[31]。研究表明花朵的衰老与许多水解酶基因丰度增加有关,包括天冬氨酸和半胱氨酸蛋白酶、液泡加工酶和核酸酶[19]。
2常用化学保鲜技术
2.1预处液、催花液、瓶插液
木质部导管由于微生物堵塞造成切花水分失衡是切花衰老的主要原因之一。在切花瓶插水养期间,采用保鲜剂溶液进行杀菌,可改善切花的吸水状态,增加营养物质进而增加切花鲜质量,极大程度上缓解微生物堵塞引起的水分失衡。在切花采后和运输前,可用预处液(由蔗糖和硝酸银或硫代硫酸银组成),减少其弯茎率和鲜质量损失率。研究表明一定浓度的蔗糖、硫酸铝、次氯酸钠组成的预处液,使紫罗兰切花花茎增发变大,鲜质量损失率降低,延长了其瓶插寿命[32]。
在切花销售前,可用催花液,一般由蔗糖、杀菌剂和有机酸组成,让处于花蕾期采摘的花朵正常开放。李思瑾等研究发现,一定比例的蔗糖、8-羟基喹琳硫酸盐、硫酸铝、赤霉素、6-苄氨基嘌呤混合的催花液,可使蜡梅切枝MDA含量降低,POD活性升高,可缓解可溶性糖含量的降低,增加细胞膜的稳定性,提前开花且开花率较高[33]。
在切花的观赏时期,采用瓶插液,来维持切花的绽放状态,延长瓶插寿命。鲜花保鲜剂的主要作用是抑制乙烯生成、保证切花水分平衡、减少ABA含量、增加切花所需营养物质等。司仕英等报道,一定浓度的蔗糖、8-羟基喹啉(8-HQ)、硫代硫酸银(STS)、6-苄氨基嘌呤(6-BA)等可作为芍药切花的保鲜剂[34]。不同切花的保鲜剂配方、浓度各有差异,但糖、杀菌剂、有机酸及乙烯抑制剂仍是其主要构成成分。糖类物质是切花在瓶插过程中用来维持自身生命活动的必需大分子物质,也是呼吸作用的底物,能够保证线粒体正常运转,维持细胞膜结构的完整性,组织蛋白质分解,还可在切花瓶插水养的过程中增加其细胞的渗透浓度,增加吸水量,保持花瓣维持一定程度的膨压,延缓萎蔫现象的出现时间,从而保证切花的品质、延长切花的寿命。研究发现蔗糖显著促进了切段茎表面木质部的堵塞,降低了相对鲜质量、抗氧化活性和半胱氨酸
蛋白酶抑制基因(DcCPi)的表达[35]。于晓萌等研究发现,以蔗糖与6-BA、CaCl2、柠檬酸等为组合优化配方的保鲜剂对玉蝉花具有良好的保鲜效果,该处理可增加其花枝鲜质量,减缓其花瓣中的可溶性蛋白质降解的速度,提高SOD活性,抑制MDA含量的升高[36]。Bayanati等的研究表明,以NaBH4和葡萄糖、NaOH为还原剂制备的含银离子的保水凝胶可以有效控制保鲜液中锡(Sn)的毒性,提高切花相对含水量、稳定膜透性,且在其溶液中切花叶绿素含量与对照相比较高,明显提高了切花的寿命[37]。蔗糖已被证明能抑制与ACC合成酶和ACO活性降低相关的乙烯产生,从而延缓康乃馨花的衰老[38]。
常用于复合保鲜液的保鲜物质有纳米银(NAg)、6-苄氨基嘌呤(6-BA)、植物精油等。NAg是一种新型的保鲜物质,抗菌活性高,抗菌谱广,且效力稳定持久,安全性较高,广泛用于食品储藏方面,对于切花的保鲜作用也有所报道[39]。王依等的研究表明纳米银处理牡丹切花后,乙烯释放峰值降低,提高了可溶性蛋白含量,延长了瓶插寿命,增加了最大花茎,提高了切花品质[40]。细胞分裂素在植物的生长发育过程中具有重要的调节作用,通过促进水分吸收,抑制蛋白质分级,可以延缓植物衰老。研究表明,NAg通过抑制乙烯生物合成基因、花瓣衰老相关基因以及花瓣和雌蕊中正向调节乙烯信号的基因,有助于显著抑制乙烯的产生,延缓康乃馨花瓣的衰老[41]。6-BA是第一个人工合成的细胞分裂素,能够抑制植物叶内叶绿素、核酸、蛋白质的分解。研究表明含有氯化钙与6-BA的复合保鲜液,能够提高芍药花瓣中可溶性蛋白及可溶性糖的含量,增加SOD活性,降低MDA含量,进而使得切花瓶插寿命得到提高[42]。
精油是一种从花、种子、水果、果皮、叶、茎、树皮、木材和根中提取的芳香性油质液体,是一种安全环保的天然植物产品,可用作香料、调味剂和药物成分。精油对某些病原体具有很强的抗菌作用。目前多種植物精油应用于果蔬保鲜之中,如迷迭香、百里香、芫荽、薄荷和蒿属植物等,大蒜和迷迭香精油具有较好的杀菌效果,可大幅降低草莓果实炭疽病的发病率及腐烂程度,提高草莓品质[43]。在切花保鲜中,可将精油添加至保鲜液中增强其保鲜效果,在切花保鲜液中加入适量百里香精油和丁香精油,延长了切花的瓶插寿命,改善了切花的含水率、相对鲜质量等采后性状,提高了叶绿素a、叶绿素b和类胡萝卜素的含量,显著提高了切花瓶插寿命[44]。Koushesh等的研究表明,使用印度藏茴香精油能够提高切花瓶插液的吸收量,减少花瓣萎蔫率和茎末端微生物数量,提高瓶插寿命[45]。
2.2涂膜保鲜剂
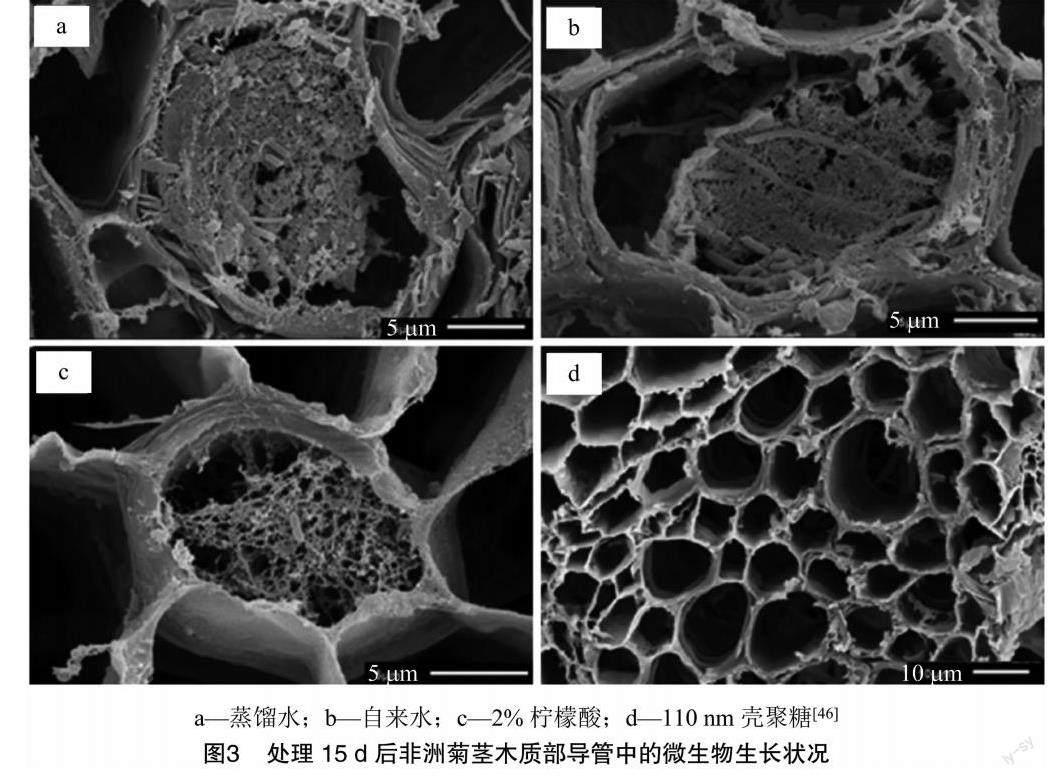
在切花采收后应该对呼吸作用采用一定抑制手段,避免其呼吸作用过于强烈,营养物质消耗过快,加速其衰老过程。涂膜保鲜是选择天然、无毒、无害的大分子多糖蛋白、脂类物质等作为被膜剂,通过浸渍、涂抹等方式,常用于果蔬保鲜方面,能够增加果实表皮的防护作用,覆盖其表皮开孔,进而抑制呼吸作用,减少营养物质消耗,同时也能减少水分蒸发,延缓萎蔫状态,抑制微生物侵入。果蔬的腐败与切花的衰老有一定相通之处,壳聚糖是一种新型切花保鲜剂,具有良好的杀菌抑菌性和成膜性,其衍生物羧甲基壳聚糖(CMCS)已被应用到切花的保鲜上。Spricigo等在非洲菊瓶插液中加入壳聚糖纳米颗粒,能够促进水分平衡,降低弯茎率,抑制微生物增殖,进而延长切花的瓶插寿命(图3)[46]。王茹华等的研究表明,用一定浓度羧甲基壳聚糖喷涂处理,可以减缓切花菊叶绿素分解及切花失水,延缓切花菊衰老[47]。
2.31-甲基环丙烯处理
1-甲基环丙烯(1-MCP)是一种含双键的环状碳氢化合物,常温情况下以气体状态存在,无气味,无生理毒性,较低浓度就具有明显的生理效应,具有水溶性,它是一种新型乙烯作用抑制剂,能有效地抑制植物对内源或外源乙烯的敏感性,在切花方面应用一般采用密封蒸熏法。Almasi等的研究表明,适宜浓度的1-MCP能明显延缓兰花衰老,降低鲜质量损失,抑制乙烯的产生[48]。1-MCP处理与保鲜液一起使用能够增强保鲜效果,但要注意搭配浓度,例如以1-MCP、柠檬酸、蔗糖和8-羟基喹啉的复合溶液能够增加非洲菊切花鲜质量、花茎及花瓣蛋白质含量,可以降低花瓣中丙二醛含量,延缓花瓣细胞膜透性增加,延长切花寿命,保鲜效果要优于单一处理方式[49]。
3物理保鲜技术
3.1包装保鲜
切花在采后运输过程中,容易造成鲜切花断头、断枝等现象,导致切花花朵、叶片萎蔫,损耗极高。为此国内鲜切花运输中常采用瓦楞纸箱、保鲜
薄膜、泡沫塑料箱和保鲜薄膜的组合形式。在原有纸基包装材料的基础上添加保鲜剂,来抑制果蔬生理代谢、避免有害微生物侵袭的功能性保鲜纸袋也成为果蔬保鲜的一种重要举措,能否广泛用于切花保鲜还有待考证[50]。聚乙烯薄膜包裹可以降低呼吸作用带来的消耗,同时抑制乙烯的生成,防止蒸腾作用的水分散失,从而延长切花的寿命。将月季用0.35mm的聚乙烯薄膜包装,维持在8℃条件下用浸水的棉纱布包扎茎基部,可明显降低其呼吸强度,并抑制乙烯的生成,延长切花寿命[51]。
3.2低温贮藏
环境温度对切花的瓶插寿命也有影响。切花采后最主要的生理活动即呼吸代谢,在不造成低温伤害的前提下,降低温度可以抑制切花的呼吸作用,抑制切花的蒸腾作用,降低失水速度,减少干物质的消耗,抑制乙烯的合成,有效延缓切花的衰老进程,但对于某些热带切花,低温反而会造成冷害的发生[52]。低温处理有效地保持了牡丹花瓣的花色、形态,延长了观赏期,4℃处理下牡丹瓶插寿命最长,观赏性最佳[53]。湿藏和干藏是常用的低温冷藏方法,湿藏即将切花放在水中贮藏,适合短期贮藏,Chore等通过对唐菖蒲脉冲湿藏处理,发现其可溶性糖减少,同时淀粉含量增加,瓶插寿命延长[54]。干藏适用于长时间贮藏,但一些品种切花在干藏过程中,反而很快出现了花冠萎蔫现象。Kumar等通过对香石竹干藏研究发现,干藏4d时,其瓶插寿命最长,随着干藏时间的延长,瓶插寿命及其采后生理指标也随之受到负面影响,导致瓶插寿命显著下降[55]。不同种类的切花,其低温贮藏温度也不同,例如红掌最适宜冷藏温度为13℃,玫瑰最适宜冷藏温度为1~3℃,非洲菊最适宜冷藏温度为4℃[56]。
3.3气调贮藏
气调贮藏是改变贮藏环境中的气体组成成分,一般是提高二氧化碳(CO2)的含量,降低氧气(O2)的含量[57],还可以提高氮气(N2)含量降低氧气含量来调节切花贮藏环境的气体组成成分。这样可以降低切花的呼吸作用,抑制内源激素的产生,进一步延长其保鲜寿命。气调贮藏往往还需要结合温度和湿度进行综合调控。常用的气调方法有分子筛制N2降氧、膜分离制N2降氧、消石灰吸收法去CO2、活性炭吸附法去CO2等。
3.4减压贮藏
减压贮藏是集真空速冷、气调贮藏、低温保存和减压技术为一体的保鲜方法,在果蔬保鲜上应用较多,采用减小密闭贮藏空间的大气压力达到保鲜目的,使贮藏空间维持在一个低氧或超低氧的状态,并保持一定的空气湿度[58]。气压一般控制在5320~7890Pa之间,能够抑制切花的呼吸作用及乙烯的合成,且使得植物體内不同气体进行对外外扩散,延缓切花的衰老。但减压贮藏条件要求较高,尤其体现在气密性和耐压性的要求上,导致其贮藏成本高,技术条件不易达到。
3.5抗蒸腾剂
鲜切花剪切后由于失去植株根系的供水,但蒸腾作用却未停止,导致切花供水量与吸水量失衡,在采后贮藏前使用石蜡、高级醇、硅树脂等抗蒸腾剂处理,可抑制切花气孔张开,减少失水量,延长切花寿命[59]。8-HQ作为一种抗蒸腾剂,可以影响切花气孔关闭,促进水分平衡,从而延长切花的寿命[60]。Fanourakis等的研究表明,抗蒸腾剂可通过切花气孔关闭降低蒸腾速率,以延长玫瑰瓶插寿命[61]。
3.6辐射保鲜
辐射保鲜采用适宜辐射剂量和剂量率照射鲜切花,可改变其生理活性,抑制呼吸强度和蒸腾作用,减少营养物质的消耗,增强抗逆能力,延迟衰老进程,从而提升切花寿命[62]。应用于辐射保鲜的射线主要有β射线、γ射线、电子束、微波、紫外光等,其中γ射线能量较高,穿透力较强,能够均匀辐照需要处理的材料,所以一般情况下以γ射线应用最多。Bajpay的研究表明2.58×10-4C/kgγ射线处理的菊花切花,其瓶插寿命、最大花茎、鲜质量都得到提高[63]。不同种类切花对γ射线耐受性不同,Kikuchi认为300Gy的剂量是切花辐射耐受的最小值,百合可以耐受500Gy剂量的γ射线;紫花山姜可耐受400Gy剂量,大剂量会出现褐变现象;洋桔梗可耐受700Gy剂量,大剂量则会导致花瓣枯萎[64]。
4基因调控技术
随着分子生物学的发展,基因调控技术下的转基因植株具有更优良的性状,相比非转基因植株具有更强的抗逆能力。MYB类转录因子参与植物各种生物和非生物胁迫过程,提高植物抗逆能力,包颖等通过月季MYB类转录因子RcWER-like的克隆及表法分析,发现R2R3-MYB类转录因子RcWER-like参与了月季盐胁迫响应和对水杨酸和茉莉酸甲酯的应答过程,在月季抗逆方面有重要作用[65]。乙烯对切花的衰老有着重大影响,基因技术的发展为鲜切花的保鲜技术开辟了新途径,可利用切花基因控制和抑制乙烯的合成与释放,延长切花的寿命。罗江会等研究发现,乙烯参与了蜡梅花朵开放和衰老的调控,影响其进程和相关乙烯受体基因的表达[66]。吴林的研究表明RhPR10.1基因通过调节细胞分裂素含量及其信号途径拮抗乙烯诱导的花瓣衰老[67]。在参与乙烯生物合成的关键酶中,ACC合成酶(ACS)、ACC氧化酶(ACO)以及参与乙烯信号传递酶的基因,尤其是在编码乙烯受体蛋白基因(ETR)分离方面已经有了很大进展[68]。Sornchai等的研究表明,携带反义ACC氧化酶的转基因石斛兰,可使乙烯生产率降低,ACO活性降低,影响了部分花瓣、萼片的形态,但延缓了花蕾的脱落,推迟了切花的衰老进程[69]。Luo等发现LoNAC29和LoSAG39在百合花被片中的瞬时过表达显著加速了花的衰老,这为百合衰老分子机制提供了新的证据,为基因调控技术延缓百合衰老提供了新的可能[70]。有报道表明1个NAC(NAM/ATAF1,2/CUC2)转录因子在日本牵牛花的花瓣衰老过程中控制着PCD进程,同时说明其花瓣衰老并不依靠乙烯[29]。
5展望
切花品质直接决定着切花的观赏价值和商业价值,切花的保鲜技术就尤为重要。随着时代的发展,切花的保鲜方法层出不穷,无论化学保鲜方法还是物理保鲜方法,都需要采取更为便捷、高效、安全的方法。保鲜剂中可添加的调控切花衰老的物质也在不断被探索发现,如纳米银、植物精油等较安全的物质。应用于果蔬的保鲜方法,是否能够使用于鲜切花保鲜中还有待考证。尽管对于切花的保鲜研究在不断发展,但能否大规模应用于产业之中,还需进一步探索。本文综述切花衰老的生理分子变化及各类保鲜技术的研究进展,为进一步探索切花衰老分子特征研究与新型保鲜剂的研发提供了思路。
参考文献:
[1]贺蕤,杨希,刘青林.月季育种的国内现状和国际趋势[J].中国园林,2017,33(12):35-41.
[2]ShortK,EtheredgeCL,WaliczekTM.Studyingthemarketpotentialforspecialtycultivarsofsunflowercutflowers[J].HortTechnology,2017,27(5):611-617.
[3]娄喜艳,王桂青,丁锦平,等.不同试剂组合对非洲菊鲜切花保鲜效果的影响[J].南方农业学报,2018,49(9):1811-1815.
[4]吴中军,夏晶晖,吴夏.复合保鲜技术对马蹄莲切花保鲜效果的影响[J].北方园艺,2015(23):142-145.
[5]JedrzejukA,RochalaJ,ZakrzewskiJ,etal.IdentificationofxylemocclusionsoccurringincutClematis(ClematisL.,fam.RanunculaceaeJuss.)stemsduringtheirvaselife[J].TheScientificWorldJournal,2012,2012:749281.
[6]顾菁菁,张敬丽,高俊平,等.不同绣球切花品种采后水分变化及其影响因子分析[J].南方农业学报,2020,51(11):2781-2788.
[7]deBoerAH,VolkovV.Logisticsofwaterandsalttransportthroughtheplant:structureandfunctioningofthexylem[J].Plant,Cell&Environment,2003,26(1):87-101.
[8]XueJQ,HuangZ,WangSL,etal.Drystorageimprovesthevasequalityofcutpeonybyincreasingwateruptakeefficiencythroughaquaporinsregulation[J].PlantPhysiologyandBiochemistry,2020,148:63-69.
[9]MaN,XueJQ,LiYH,etal.Rh-PIP2;1,aroseaquaporingene,isinvolvedinethylene-regulatedpetalexpansion[J].PlantPhysiology,2008,148(2):894-907.
[10]XueJQ,YangF,GaoJP.IsolationofRh-TIP1;1,anaquaporingeneanditsexpressioninroseflowersinresponsetoethyleneandwaterdeficit[J].PostharvestBiologyandTechnology,2009,51(3):407-413.
[11]史田,孔秋真,秦紹玲,等.牡丹切花能荷水平及能量代谢与瓶插品质的关系[J].西北植物学报,2020,40(9):1558-1565.
[12]周琦,赵峰,汤鹏,等.不同花色香水莲花花期花瓣生理指标变化分析[J].南方农业学报,2021,52(10):2797-2804.
[13]JonesML,ChaffinGS,EasonJR,etal.Ethylene-sensitivityregulatesproteolyticactivityandcysteineproteasegeneexpressioninpetuniacorollas[J].JournalofExperimentalBotany,2005,56(420):2733-2744.
[
[28]HoeberichtsFA,deJongAJ,WolteringEJ.Apoptotic-likecelldeathmarkstheearlystagesofgypsophila(Gypsophilapaniculata)petalsenescence[J].PostharvestBiologyandTechnology,2005,35(3):229-236.
[29]ShibuyaK,YamadaT,IchimuraK.Morphologicalchangesinsenescingpetalcellsandtheregulatorymechanismofpetalsenescence[J].JournalofExperimentalBotany,2016,67(20):5909-5918.
[30]BattelliR,LombardiL,RogersHJ,etal.Changesinultrastructure,proteaseandcaspase-likeactivitiesduringflowersenescenceinLiliumlongiflorum[J].PlantScience,2011,180(5):716-725.
[31]ZhangYS,ZhongDX,LiuZF,etal.Studyonthephysiological,cellular,andmorphologicalaspectsofthepostharvestdevelopmentofcutlilyflowers[J].HorticulturalPlantJournal,2021,7(2):149-158.
[32]潘耕耘,雷俊玲,林萍.紫罗兰预处液及其保鲜机制研究[J].安徽农业科学,2010,38(23):12716-12719,12723.
[33]李思瑾,陈龙清.不同处理植物生长调节剂对‘素心蜡梅切枝催花保鲜效果的影响[J].西南林业大学学报(自然科学),2021,41(5):42-48.
[34]司仕英,牛立新,张延龙,等.不同保鲜剂对芍药切花衰老的影响[J].西北农林科技大学学报(自然科学版),2021,49(10):100-110,119.
[35]ParkDY,NaingAH,AiTN,etal.Synergisticeffectofnano-sliverwithsucroseonextendingvaselifeofthecarnationcv.Edun[J].FrontiersinPlantScience,2017,8:1601.
[36]于晓萌,杜钰,郝宏娟,等.基于响应面法优化玉蝉花切花保鲜剂配方的研究[J].中国农业科技导报,2017,19(10):121-131.
[37]BayanatiM,AhmadinejadE,KazemiF,etal.Nanosilver/hydrogel:synthesisandapplicationindelayingsenescenceofcutflower[J].SouthAfricanJournalofBotany,2021,138:415-423.
[38]VerlindenS,GarciaJJV.Sucroseloadingdecreasesethyleneresponsivenessincarnation(Dianthuscaryophylluscv.WhiteSim)petals[J].PostharvestBiologyandTechnology,2004,31(3):305-312.
[39]于子越,陳飞,董威杰,等.纳米银的抑菌机理及其在食品储藏方面的研究进展[J].食品工业科技,2019,40(19):305-309.
[40]王依,王凯轩,胡思源,等.乙烯代谢和能量状态对‘巴茨拉牡丹切花瓶插品质的作用研究[J].园艺学报,2021,48(6):1135-1149.
[41]NaingAH,SoeMT,KyuSY,etal.Nano-silvercontrolstranscriptionalregulationofethylene-andsenescence-associatedgenesduringsenescenceincutcarnations[J].ScientiaHorticulturae,2021,287:110280.
[42]刘萍,范琪琪,丁义峰,等.CaCl2+6-BA对芍药花瓣生理生化特性的影响[J].西南农业学报,2018,31(1):74-77.
[43]HosseiniS,AminiJ,SabaMK,etal.Preharvestandpostharvestapplicationofgarlicandrosemaryessentialoilsforcontrollinganthracnoseandqualityassessmentofstrawberryfruitduringcoldstorage[J].FrontiersinMicrobiology,2020,11:1855.
[44]El-SayedIM,El-ZiatRA.UtilizationofenvironmentallyfriendlyessentialoilsonenhancingthepostharvestcharacteristicsofChrysanthemummorifoliumRamatcutflowers[J].Heliyon,2021,7(1):e05909.
[45]KousheshSabaM,NazariF.Vaselifeofgerberacutflowercv.Pinkpoweraffectedbydifferenttreatmentsofplantessentialoilsandsilvernanoparticles[J].JournalofPlantProductionResearch,2017,24(2):43-59.
[46]SpricigoPC,PilonL,TrentoJP,etal.Nano-chitosanasanantimicrobialagentinpreservativesolutionsforcutflowers[J].JournalofChemicalTechnology&Biotechnology,2021,96(8):2168-2175.
[47]王茹华,张启发,李晔,等.羧甲基壳聚糖对切花菊瓶插保鲜的效果[J].北方园艺,2018(15):129-133.
[48]AlmasiP,MohamedMTM,AhmadSH.Efficacyof1-MCPoncontrollingethylenesensitivityandextendingvaselifeofsensitiveandlesssensitivecutorchidflowers[J].FundamentalandAppliedAgriculture,2019,4(2):759-768.
[49]张玲,秦华,孙珍.1-MCP复合保鲜液对非洲菊切花保鲜的影响[J].西南师范大学学报(自然科学版),2019,44(3):62-67.
[50]刘明华,张秀玲,肖曼玉,等.紫苏叶保鲜纸袋的研制及其基本性能分析[J].食品工业科技,2022,43(4):254-263.
[51]张延恒,钱丽华,傅巧娟.月季切花采后生理及保鲜技术研究进展[J].浙江农业科学,2001,42(6):295-298.
[52]DarrasAI.Thechillinginjuryeffectincutflowers:abriefreview[J].TheJournalofHorticulturalScienceandBiotechnology,2020,95(1):1-7.
[53]陈悦,刘会超,贾文庆,等.低温处理对牡丹花瓣细胞核形态及生理指标的影响[J].河南农业科学,2022,51(1):116-124.
[54]ChoreKJ,MwangiM,KaroriSM,etal.Changesincarbohydratesassociatedwithsenescenceofcutgladiolusspikesunderpulsingandwetcoldstoragedurations[J].AfricanCropScienceJournal,2020,28(s1):41-53.
[55]KumarA,BawejaHS,DiltaBS,etal.Effectoflowtemperaturedrystorageonvaselifeofcutcarnation(DianthuscaryophyllusL.)flowers[J].JournalofPharmacognosyandPhytochemistry2020;9(6):1923-1925.
[56]ThakurN.Areviewontheeffectofstoragemethodsandpackagingmaterialonthepost-harvestlongevityofcutflowers[J].InternationalJournalofChemicalStudies,2020,8(3):2375-2379.
[57]蔡继业,房祥军,韩延超,等.气调贮藏对东魁杨梅品质的影响[J].浙江农业学报,2022,34(2):352-359.
[58]趙悦菡,侯召华,纪海鹏,等.樱桃生理变化及保鲜机理研究进展[J].食品研究与开发,2021,42(23):197-203.
[59]王舒藜,吕英民.安祖花切花采后生理及贮运技术研究进展[J].北方园艺,2009(4):128-131.
[60]赵敏,姚建英,孟宪敏,等.百合切花无银保鲜液筛选及其保鲜效果[J].江苏农业科学,2017,45(21):223-225.
[61]FanourakisD,GidayH,LiT,etal.Antitranspirantcompoundsalleviatethemild-desiccation-inducedreductionofvaselifeincutroses[J].PostharvestBiologyandTechnology,2016,117:110-117.
[62]刘继红,徐小勇,邓秀新.我国园艺产品辐射保鲜研究进展[J].核农学报,2002,16(6):414-417.
[63]BaipayA,DwivediDH.Effectofvasesolutionsandgammaradiationonvaselifeofchrysanthemum(ChrysanthemummorifoliumR.)cv.Vasantika[J].InternationalJournalofPure&AppliedBioscience,2017,5(3):522-529.
[64]KikuchiOK.Gammaandelectron-beamirradiationofcutflowers[J].RadiationPhysicsandChemistry,2003,66(1):77-79.
[65]包颖,李泽卿,魏琳燕,等.月季MYB转录因子基因RcWER-like的克隆及表达分析[J].核农学报,2020,34(6):1144-1151.
[66]罗江会,马婧,刘道凤,等.乙烯对蜡梅切花开放衰老及乙烯受体基因表达的影响[J].植物生理学报,2015,51(2):253-258.
[67]吴林.月季RhPR10.1基因在乙烯介导花瓣衰老中的功能分析[D].北京:中国农业大学,2016:51-63.
[68]刘雅莉,王西平,赵明德.鲜切花保鲜相关调控基因研究进展[J].西北植物学报,2002,22(1):190-195.
[69]SornchaiP,vanDoornWG,ImsabaiW,etal.DendrobiumorchidscarryingantisenseACCoxidase:smallchangesinflowermorphologyandadelayofbudabortion,flowersenescence,andabscissionofflowers[J].TransgenicResearch,2020,29(4):429-442.
[70]LuoJ,LiRR,XuXT,etal.SMRTandilluminaRNAsequencingandcharacterizationofakeyNACgeneLoNAC29duringtheflowersenescenceinLiliumoriental‘Siberia[J].Genes,2021,12(6):869.

