一种铜配合物的制备及其对甲基橙的高效吸附
吴秋艳,汪鹏飞,2*
(1.池州学院 微纳粉体与先进能源材料安徽省普通高校重点实验室,安徽 池州 247000;2.南京大学 配位化学国家重点实验室,江苏 南京 210023)
由于印染、纺织、服装等行业的迅速发展,染料的使用种类和数量也日益增加,所产生的废水给生态环境系统造成了严重威胁[1-4]。甲基橙(Methyl Orange,MO)是一种含有偶氮结构和磺酸根的阴离子型染料,其使用较为广泛,是难以自然降解的常见有机染料。目前,去除水体中有机染料的方法较多,如光催化降解法、生物降解法、膜分离法、氧化法和吸附法等[5-8]。在上述方法中,吸附法因其操作简单、绿色环保、投入成本相对较低而受到广泛应用。吸附法需要采用吸附剂来有效吸附水体中的有机染料,开发合适的吸附剂就成为一项具有挑战性的工作。近年来,诸如活性炭、分子筛、石墨、层状双金属氢氧化物等无机材料被广泛应用于吸附水体中的各种染料[9]。虽然这些材料在水环境中对有机染料具有一定的吸附效果,但存在吸附容量小、选择性差、速率慢等不足之处,因此设计并制备新型吸附材料是一项具有重要理论意义和现实价值的研究工作。
配位聚合物(Coordination Polymers)是一类重要的有机-无机杂化材料,其是通过金属离子或金属簇单元与含有功能基团的有机配体依托化学键组装而成,从结构上可以分为一维链、二维层和三维框架等,可以利用改变金属离子类型、有机配体分子结构或合成条件等来调控产物结构。其中,配位聚合物中的一类重要材料为金属有机框架(Metal-Organic Frameworks,MOFs),这类材料一般具有比表面积大、孔隙率高、结构可调节以及三维结构等特点,其作为吸附剂在有机染料废水处理领域具有重要意义和潜在应用价值[10-13]。这些MOFs材料在吸附水环境中有机染料时的主要驱动力有静电相互作用、氢键作用、π-π作用等。通常,大部分MOFs材料在水环境中不够稳定,主要是因为其多孔结构特征,因此稳定性限制了该类材料在吸附染料领域中的进一步应用。而相对于具有三维骨架的MOFs 材料,很多具有低维结构的(一维链和二维层)配位聚合物多具有相对较高的稳定性。然而,具有低维结构配位聚合物作为吸附材料的研究相对较少,主要是这类材料无孔道结构以及较低的表面积,吸附效果普遍较差,因此探索这类材料作为吸附剂以有效去除水环境中的染料具有重要的实际应用价值[14]。
基于上述思路,本文运用配位化学基本原理并结合合成化学基础理论,设计组装了以二价铜离子(Cu2+)为中心离子、以1,2-二(4-吡啶基)乙烯为有机配体的铜配合物(Cu-CP),该配合物能够在水溶液中稳定存在,且在合成过程中引入了具有弱配位能力的硫酸根(SO42-)以作为配位单元和电荷平衡单元存在于该配合物中。同时,本文探讨了Cu-CP配合物对水溶液中甲基橙染料的去除性能。
1 实 验
1.1 实验材料
五水合硫酸铜(CuSO4·5H2O,CR)、1,2-二(4-吡啶基)乙烯(bpe,C12H10N2,98%)、甲基橙(MO,C14H14N3SO3Na,98%)、亚甲基蓝(MB,C16H18ClN3S,AR)、罗丹明B(RhB,C28H31N2ClO3,98%)、无机盐(氯化钠NaCl、硝酸钠NaNO3、氯化钾KCl、氯化钙CaCl2、无水硫酸钠Na2SO4、无水硫酸镁MgSO4,AR)、无水乙醇(C2H5OH,CR)。MO、MB和RhB分子结构如图1。上述试剂均购自上海麦克林生化科技有限公司。
利用Thermo Scientific Nicolet Is10型傅里叶变换红外光谱仪分析相关化合物的红外光谱(KBr压片,4 000 cm-1~400 cm-1);样品粉末XRD由Rigaku Ultima ⅣX-射线衍射仪测定(Cu Kα,λ=1.540 56 Å,扫描范围为5°~50°),其工作电压和电流分别为40 kV 和40 mA;样品热重性质在氮气氛围下由Thermo Gravimetric Analyzer Q500 测定,测试温度为25 °C~800 °C,升温速度为10 °C/min;采用Zeiss Sigma 500型场发射扫描电镜来表征产物吸附前后的表面形貌;X-射线光电子能谱(XPS)由Thermo ESCALAB 250Ⅺ测试完成;样品ζ电位由Anton Paar Litesizer 500测定完成;溶液中染料的吸光度由UH-5700型分光光度计测量,测量范围为200 nm~800 nm。
1.2 Cu-CP配合物制备
在250 mL三角瓶中称量1.000 g CuSO4·5H2O并加入120 mL去离子水,磁力搅拌呈淡蓝色透明液体A;再在小烧杯中称取0.728 g bpe并加入无水乙醇40 mL,搅拌呈淡黄色透明液体B;在室温搅拌条件下,将B溶液通过恒压滴液漏斗滴入A溶液中,立刻形成深蓝色不溶物,滴加完毕后继续搅拌3小时,通过减压抽滤得到深蓝色固体产物,并依次用去离子水和无水乙醇各洗涤3 次,冷冻干燥8 小时,最终得到1.456 g Cu-CP产物。
1.3 吸附实验
配制1 000 mL MO溶液(500 mg/L)备用。吸附实验均在气浴振荡器中进行,实验温度为(25±0.5)°C,振荡速率为200 r/min,三次平行。溶液pH值用0.1 M的HCl溶液和0.1 M的NaOH溶液调节。将干燥后的20.0 mg Cu-CP 样品置于125 mL 三角瓶中,加入某一浓度的MO 水溶液100 mL,取吸附后溶液离心(4 000 r/min,2 min)以得到上层清液,再用0.22 μm聚四氟乙烯滤膜过滤,用紫外-可见分光光度计检测液体在200 nm~800 nm范围的吸光度。
在水溶液中,Cu-CP配合物对MO染料的吸附量和去除率可以通过下列公式计算:
其中,qt(mg/g)是MO在某一固定时间的吸附量,c0(mg/L)和ct(mg/L)分别代表MO染料在初始和固定时间t的浓度,V (L)代表溶液体积,m(g)代表吸附剂Cu-CP质量。
准一级和准二级动力学模型的线性方程如[15]
式中,t 为吸附时间(min),k1(min-1)和k2(g/ (mg ⋅min))分别是准一级和准二级动力学模型常数,qe和qt分别是平衡时间和t时刻的吸附容量(mg/g)。
在(298.15~308.15)K范围内,研究Cu-CP配合物的MO吸附热力学,其热力学参数包括吉布斯自由能(ΔG)、焓变(ΔH),以及熵变(ΔS)可以通过下列方程计算:
式中,R(8.314 J/(mol·K)),T (K),ce和qe表示某一固定温度和固定吸附时间内MO 的平衡浓度和吸附量。
1.4 表面电荷测试
利用ζ电位仪测试Cu-CP配合物在水溶液中以及吸附MO染料后的电荷情况。将2.0 mg Cu-CP加入到装有10 mL 去离子水的离心管中并超声分散;同时,将20.0 mg 的Cu-CP 配合物加入到装有100 mg/L MO溶液的100 mL三角瓶中。将三角瓶和离心管置于气浴振荡器中,并于200 r/min、25 °C条件下振荡4小时,然后取样测试。
2 结果与讨论
2.1 Cu-CP配合物吸附剂的表征
本文的Cu-CP 配合物是采用直接沉淀法所制备,同时我们也将相同的原料和溶剂采用混合溶剂热方法处理(120 ºC 反应24 小时),后者得到的产物和直接沉淀法产物的物相一致。根据文献[16]可知,利用CuSO4·5H2O与bpe两种试剂在不同条件下反应可得到两种不同结构的铜化合物,即[Cu(bpe)2][Cu(bpe)(H2O)(SO4)2]·2H2O(1)和[Cu(bpe)(H2O)(SO4)](2),其中,化合物(1)中所含{Cu(bpe)2}2+单元具有矩形结构,同时{Cu(bpe)(H2O)(SO4)2}2-具有线性阴离子链结构,进而形成了一种相互穿插的三维结构。而化合物(2)是通过{Cu(bpe)(H2O)}2+一维阳离子链结构与SO42-阴离子形成另外一种三维结构化合物。将实验合成的Cu-CP配合物与上述两个化合物的XRD对比发现(图2),本文Cu-CP配合物不同于文献所报道的两种化合物。通过对Cu-CP配合物元素及其他表征手段结果分析,可以初步判定其化学式为[Cu(bpe)(SO4)]·2H2O(理论值:C,39.09,H,7.41,N,3.70,S,8.46;实验值:C,38.18,H,3.75,N,7.64,S,8.65)。利用SEM观察Cu-CP 配合物的表面形貌,如图3a和3b所示,Cu-CP配合物具有较为均匀的块状结构,大小为10 μm~20 μm,放大倍数可进一步观察到块状材料的表面呈薄片状。

图3 Cu-CP(a,b)及其吸附产物Cu-CP@MO(c,d)的SEM形貌
为进一步了解Cu-CP配合物精确的化学环境,本文测定了其XPS,图4显示了该配合物的全谱图及Cu、C、N、O、S等元素的谱图。其中,图4b显示了配合物中Cu2+状态;S 2p谱图表明配合物中存在这与红外光谱的结论一致;N 1s图谱表明其存在吡啶氮原子(398.65 eV)和Cu-N配位键(400.45 eV)[17];O 1s图谱表明其存在Cu-O键(532.35 eV),且较正常Cu-O键弱,也表明中心金属Cu2+与硫酸根中O之间存在弱配位键,与部分铜配合物中在轴向方向存在弱Cu-O键一致[18]。因此,上述结果进一步证实了本文铜配合物Cu-CP的存在。通过测试Cu-CP配合物在氮气气氛中的热重曲线,可以清楚地发现该物质存在三步失重过程(图5a),从室温到145 °C左右,失重约15.90%,主要失去结晶溶剂分子;从180 °C到220 °C左右,失重约8.04%,物质可能失去了配位水分子;从300 °C到380 °C左右,失重约45.01%,所有主要有机物全部分解,剩余黑色产物为金属氧化物(CuO)。通过测定该配合物的比表面积、孔体积和孔径来表征其在氮气氛围中的吸附性质。如图6a和6b所示,该配合物具有较窄的孔径分布和孔体积(平均孔径为1.346 nm,孔体积为0.041 cm3/g)和较小的BET表面积(25.238 m2/g)。

图4 Cu-CP的XPS分析。(a)全谱图;(b)Cu 2p谱图;(c)C 1s谱图;(d)S 2p谱图;(e)N 1s谱图;(f)O 1s谱图

图6 (a)Cu-CP的N2吸附-脱附曲线;(b)Cu-CP的孔径分布
2.2 Cu-CP对MO的去除性能研究
2.2.1 吸附动力学研究
图7a 揭示了20 mg Cu-CP 吸附材料在(25 ± 0.5)°C、200 r/min 条件下对不同浓度MO(25 mg/L、50 mg/L、75 mg/L,120 mL)的吸附效果,研究发现Cu-CP配合物在前20 min内吸附速率很快,其MO去除率分别达到94.14%、92.29%和79.42%,同时75 mg/L 的MO 在1 小时后基本完全去除,此时吸附量达到447.74 mg/g 且去除率高达99.51%。上述实验表明,Cu-CP 配合物对水环境中MO 染料的去除速率较其他吸附材料具有速度快、达到吸附平衡时间短以及吸附量和去除率高等特点(表1)[19-23]。为了更好地了解该配合物对MO的吸附过程,分别采用准一级和准二级动力学模型对上述三种不同初始浓度的MO吸附数据进行拟合(图7),由相关系数R2可知,该配合物的MO吸附更符合准二级动力学模型(表2)。同时,在相对较低浓度条件下(25 mg/L 和50 mg/L)所得到的吸附量与准二级模型计算所得到的吸附量非常接近。上述结果表明准二维动力学模型适合解释该铜配合物对MO的吸附过程,也进一步说明了其吸附MO的主要机制是化学吸附[24]。

表1 部分吸附剂对甲基橙最大吸附量的比较

表2 Cu-CP材料吸附MO的动力学参数

图7 (a)吸附时间对Cu-CP吸附MO的影响;(b)准一级动力学模型的线性拟合曲线;(c)准二级动力学模型的线性拟合曲线
2.2.2 吸附热力学研究
在298.15 K、303.15 K、308.15 K三个不同温度下探讨了Cu-CP配合物的MO吸附热力学行为。如图8所示,在其他条件不变的情况下,Cu-CP 配合物对MO 的吸附量随着温度升高而逐渐增大。通过研究吸附过程的温度效应可以得到3个热力学参数(ΔG、ΔH和ΔS)(表3)。该吸附过程的ΔG为负值,表明在上述条件下Cu-CP配合物吸附MO 的过程是自发进行的,随着温度升高负值越大表明自发进行的程度越深。而且,吸附过程的ΔH为正值,表明其吸附过程为吸热,该结果与温度升高吸附量增大一致。另外,吸附过程的ΔS 也是正值,表明其吸附过程的随机性增加[25-27]。

表3 Cu-CP吸附MO的动力学参数

图8 不同温度下Cu-CP吸附MO的动力学曲线
2.2.3 溶液pH值对吸附性能的影响
MO 是一种阴离子型染料,其在水溶液中以离子形式存在,而溶液pH 值会直接影响吸附材料表面的电荷分布情况。图9 揭示了在不同pH 值(2、4、6、8、10)条件下吸附剂对MO的去除率。对于MO吸附,在酸性至弱碱性条件下吸附量变化不大,去除率从86.10%增至99.67%;当溶液pH值继续升高呈碱性时,MO去除率显著下降,当pH=10时去除率仅11.22%。从上述结果来看,溶液pH值对吸附剂吸附性能影响较大,意味着溶液酸碱性对吸附材料与MO间的相互作用产生了较大影响,进而影响去除率。
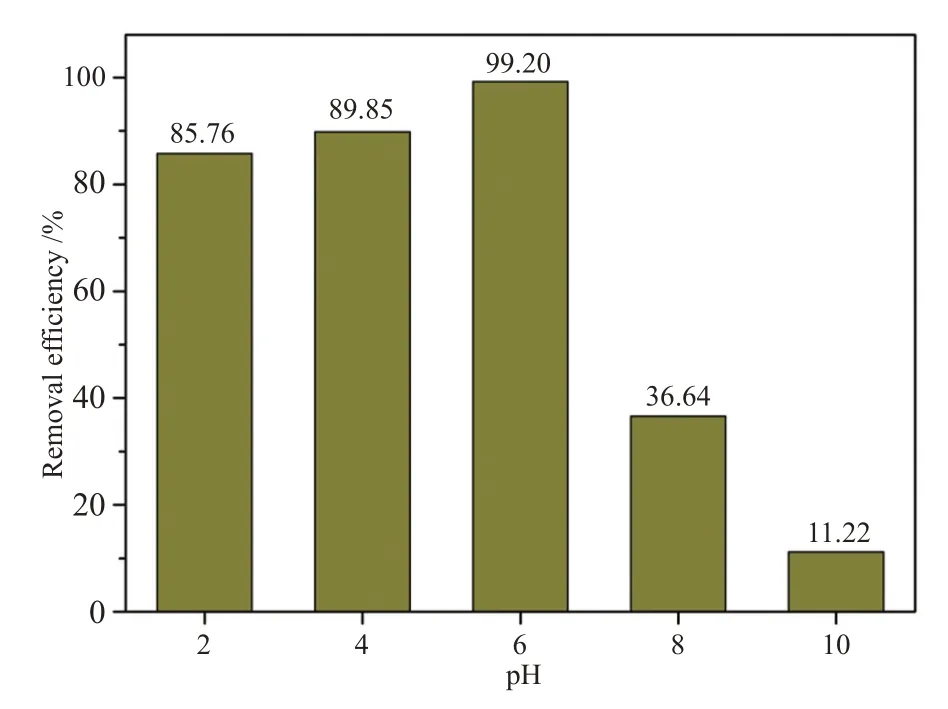
图9 初始溶液pH值对Cu-CP吸附MO的影响
2.2.4 金属盐对吸附性能的影响
实际含染料废水可能存在各种金属盐离子,研究金属盐对Cu-CP 配合物吸附MO 的影响完全有必要。图10a揭示了几种常见的金属无机盐(NaCl、NaNO3、Na2SO4、KCl、CaCl2、MgSO4,0.050 mol/L)存在条件下,Cu-CP 配合物对MO的去除率。可以发现多数无机盐对Cu-CP 在水溶液中去除MO影响较大,只有Na2SO4和MgSO4对其去除率影响相对较小。为了进一步了解金属离子浓度的影响,本文选取不同浓度NaCl(0.005、0.010、0.020、0.050 mol/L)来研究其对MO吸附性能的影响,可以明显发现随着NaCl 浓度的增大而MO的去除率减小,进一步表明在Cu-CP配合物吸附MO的过程中,离子交换扮演了重要作用。

图10 (a)无机盐对Cu-CP去除MO效果的影响;(b)不同浓度NaCl对Cu-CP去除MO效果的影响
2.3 吸附机理分析
为了更好地了解Cu-CP 配合物作为吸附材料在水环境中高效去除甲基橙染料的机理,本文采用SEM、BET、FT-IR、PXRD以及Zeta电位等手段进一步阐述了其对MO染料的去除机理。第一,Cu-CP配合物吸附MO后的产物Cu-CP@MO在表面形貌上发生了较大变化,从大块状变为薄片状(图3)。第二,Cu-CP配合物的N2吸附结果表明其具有较小的比表面积,不存在多孔骨架结构特征。第三,两种材料的PXRD进一步说明Cu-CP 配合物与吸附MO后产物Cu-CP@MO 的物相产生了明显变化(图11),因此该吸附过程应该发生了化学反应。第四,从Cu-CP配合物及吸附MO后产物Cu-CP@MO的红外光谱来看(图5b),在1 000 cm-1~1 200 cm-1处变化较为明显,且Cu-CP配合物含有SO42-基团充当配位单元和电荷平衡单元,所以在该区域有3 个强吸收峰,而吸收MO 后该区域只出现两个中等强度的吸收峰,其归因于MO中SO3-的伸缩振动峰,从而表明Cu-CP吸附MO是利用其SO42-与MO上的SO3-发生交换,同时MO分子与Cu-CP 通过化学键形成了新的产物Cu-CP@MO,从而对水溶液中MO 产生富集作用。第五,通过Cu-CP配合物的Zeta电位可以进一步理解其吸附MO的机理(图12),检测发现其表面带负电荷,而MO也是一种阴离子型染料,可见吸附剂与吸附质之间不存在静电相互作用。因此,本文选择两种常见的阳离子型染料亚甲基蓝(MB)和罗丹明B(RhB)来分析Cu-CP 配合物的染料吸附能力。如图13 所示,Cu-CP 配合物对水溶液中MB 染料(20 mg/L,100 mL)几乎没有吸附能力,同时对水溶液中RhB 染料(8 mg/L,100 mL)吸附效果也不明显,这就表明静电作用对于Cu-CP配合物吸附水溶液中部分阴离子型和阳离子型染料并不明显。在上述几种无机盐存在的情况下,对Cu-CP配合物吸附MO的影响较大,而之前分析发现MO吸附主要是通过其硫酸根离子(SO42-)与阴离子染料MO分子的磺酸根离子(R-SO3-)之间存在离子交换作用,但是水溶液中的其他阴离子(如Cl-和NO3-)会阻止这种交换作用的发生,而硫酸根离子(SO42-)则不影响这种交换作用的进行,从而进一步证实了吸附作用来源于离子交换作用。
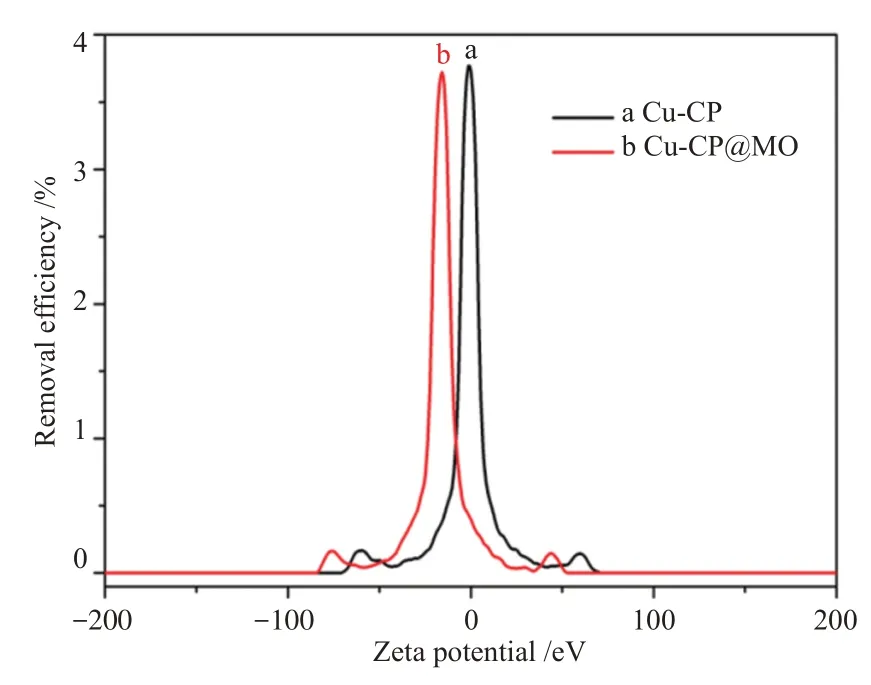
图12 Cu-CP水溶液及其吸附MO后的Zeta电位

图13 Cu-CP吸附染料的紫外-可见吸收光谱。(a)亚甲基蓝(MB);(b)罗丹明B(RhB)
3 结论
本文以五水合硫酸铜和1,2-二(4-吡啶基)乙烯为原材料,采用简单的直接沉淀法制备了一种铜配合物Cu-CP,该合成方法具有易制备、操作简单、产率高等优点,同时产物Cu-CP在水环境中对甲基橙染料具有较高的选择性吸附能力。进一步研究发现,这种自发吸附源于铜配合物中弱配位能力的硫酸根离子(SO42-)与甲基橙分子的磺酸根离子(R-SO3-)间的离子交换作用。同时,Cu-CP吸附MO遵循准二级动力学模型,其吸附热力学研究也表明了该吸附过程是自发进行的。因此,铜配合物Cu-CP可以作为一种潜在的去除含甲基橙染料废水的吸附材料。

