2023年高考化学模拟试题A 卷参考答案
1.A 提示:碳纤维复合材料是以碳纤维为增强体,以树脂、金属、陶瓷和橡胶为基体制成的复合材料;聚氨酯材料属于有机高分子材料,A 项错误。合金有很多比纯金属优良的性能,铝合金具有较高的强度、韧性和抗腐蚀性等优点,在返回舱着地时,舱座椅缓冲器能减缓巨大的瞬间冲力,保障航天员生命安全,B项正确。利用二氧化碳合成甲醇,解决了工业二氧化碳尾气排放问题,实现碳的资源化循环利用,符合“碳中和、碳达峰”发展理念,C项正确。纳米气凝胶属于胶体,具有丁达尔效应,D 项正确。
2.C 提示:X 中只含有羰基,Y 中含有羟基和羰基,A 项错误。中用“*”标记的碳原子为饱和碳原子,与之相连的碳原子不可能处于同一平面,因此X 中所有碳原子不可能共面,B 项错误。X 和Y 分子式相同,结构不同,互为同分异构体,脯氨酸含有羧基,Y中含有羟基,两者能发生酯化反应(取代反应),C 项正确。Y 中含有一个羟基,1 mol羟基产生0.5 mol氢气,因此1 mol Y 与足量的钠反应产生1g氢气,D项错误。
3.B 提示:固体颜色为黄色说明含有Fe2(SO4)3;与足量水作用后,得到深棕色固体混合物Y 和无色碱性溶液,说明X 中有碱性物质且过量,只有漂白粉是碱性物质,因此一定含有过量的漂白粉;由于次氯酸根与碘离子会发生反应生成碘单质,碘单质在水溶液中是棕褐色,与题意不符,所以无KI;深棕色固体混合物Y 为Fe(OH)3和Cu(OH)2,因此一定有CuCl2;FeSO4无法判断。基于此,该样品中确定存在的是漂白粉、Fe2(SO4)3、CuCl2,所以B项正确。
4.B 提示:由离子方程式2MnO-4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O 可知,高锰酸钾与草酸恰好完全反应的物质的量为2∶5,所以高锰酸钾是过量的,溶液并不能完全褪色,A 项错误。5~6滴约为0.25~0.3 mL,因此FeCl3少量,若该反应不是可逆反应,则反应后的溶液中不含Fe3+;向反应后的溶液中滴加少量的KSCN 溶液,溶液变红,说明反应后的溶液中仍存在Fe3+,从而说明KI与FeCl3的反应是可逆反应,B 项正确。乙醇蒸气通过炽热的铜粉,乙醇被催化氧化成乙醛,但是不一定是乙醛使酸性KMnO4溶液褪色,乙醇也可以使其褪色,C项错误。加入新制Cu(OH)2悬浊液,加热至沸腾,生成砖红色沉淀,说明淀粉已经发生水解;滴加碘水,加入的碘水与NaOH 溶液反应,溶液不变蓝,不能证明加热充分反应后的溶液中不含淀粉,从而不能证明淀粉完全水解,D 项错误。
5.D 提示:X、Y、Z、Q、W 为原子序数依次增大的短周期元素,结合结构式可知,X、W 形成1条共价键,最外层电子数可能是1或7,由于X 的原子序数最小,所以X 为H,W 为Cl;Y 形成4条共价键,最外层有4个电子,Y 为C;X、Y、Z 形成+1 阳离子,所以Z最外层有3 个电子,Z 为N。Q 形成4条共价键,但Q 与W 形成-1 价阴离子,所以Q 最外层有3个电子,Q 为Al。X 为H,Y 为C,Z为N,Q 为Al,W 为Cl。
Z为N 元素,基态氮原子核外电子数为7,则核外电子运动状态有7 种,A 项错误。碳形成的氢化物很多,随着碳原子的数目增加,沸点增加,含碳数较多的烃,其沸点比氨气的沸点高,B 项错误。Cl 的含氧酸有HClO、HClO2、HClO3、HClO4,其中HClO4为强酸,C 项错误。该化合物中五元环以双键相连的碳原子、氮原子均为sp2杂化,以单键相连的氮原子为sp3杂化,故D 项正确。



8.(每空2分,共16分)
(1)做还原剂
(2)1.9×1023
(3)MnO2+2Fe2++4H+==2Fe3++Mn2++2H2O
(4)3MnCO3+ 2Fe3++ 3H2O ==2Fe(OH)3+3Mn2++3CO2↑
(5)蒸发结晶 趁热过滤
(6)滴入最后一滴标准液时,溶液的紫红色消失,且半分钟内不恢复100%
提示:(1)“酸浸”时,MnO2被草酸还原,因此H2C2O4做还原剂。

(3)“氧化”时,二氧化锰把酸浸后的二价铁氧化为三价铁,离子方程式为MnO2+2Fe2++4H+==2Fe3++Mn2++2H2O。
(4)碳酸锰消耗三价铁水解产生的氢离子,导致氢离子浓度降低,促进三价铁水解,该反应的离子方程式为3MnCO3+2Fe3++3H2O ==2Fe(OH)3+3Mn2++3CO2↑。
(5)MnSO4的溶解度随温度升高逐渐减小,所以要析出MnSO4·H2O 晶体的操作是蒸发结晶、趁热过滤。

9.(1)恒压滴液漏斗(1分)
(2)防倒吸(2分)
(3)排出装置内的空气,防止Na2S2O4被氧化(2分)
(4)ZnS2O4+2NaOH ==Na2S2O4+Zn(OH)2↓(2 分) pH 太 大,Zn(OH)2会溶解;pH 太小,Zn2+沉淀不完全(2分)
(5)乙醇(2分)
(6)碱石灰(氢氧化钠固体或生石灰)(2分)
提示:(1)仪器a、c均为恒压滴液漏斗。
(2)装置B(单向阀)是只能一个方向流动而不能反向流动的装置,SO2进入装置C中,压强减小会引起倒吸,单向阀可起到防倒吸作用。
(3)由于连二亚硫酸钠的还原性很强,制备过程必须在无氧条件下进行,所以需排净装置内的空气,防止被氧化。
(4)SO2进入装置C后,与Zn-H2O 悬浊液反应生成ZnS2O4,滴入氢氧化钠溶液后,发生反应ZnS2O4+2NaOH ==Na2S2O4+Zn(OH)2↓,由题中信息可知,Zn(OH)2开始沉淀的pH 为8.0,沉淀完全pH 为11.1,由于Zn(OH)2是两性氢氧化物,若pH 太大,Zn(OH)2会溶解生成ZnO2-2,若pH 太小,Zn2+沉淀不完全。
(5)Na2S2O4不溶于乙醇,因此用乙醇来洗涤晶体最为合适。
(6)尾气主要是SO2,用球形干燥管进行尾气处理,可选用碱石灰、氢氧化钠固体或生石灰,因为SO2是酸性氧化物,可以与碱或者碱性氧化物反应。
10.(共14分,每空2分)
Ⅰ.(1)b
(2)>
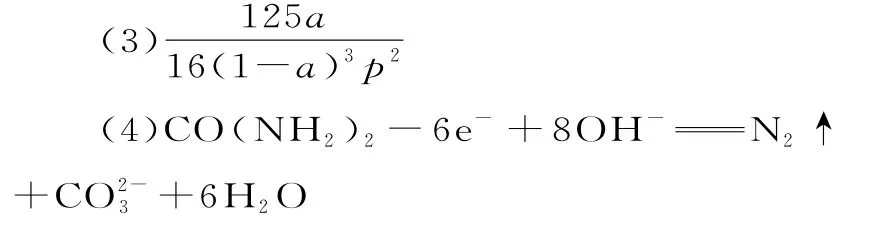
Ⅱ.(1)温度升高,CO2的反应速率加快,反应2为吸热反应,以反应2为主,温度升高有利于反应正向进行,所以CO2转化率增高
(3)B、D
提示:Ⅰ.(1)ΔG=ΔH-TΔS,当T=0时,纵坐标的截距为ΔH,反应2 的ΔH2=+72.49 kJ·mol-1,因此线条b对应反应2。
(2)根据盖斯定律可得ΔH3=ΔH1+ΔH2=-159.47 kJ·mol-1+72.49 kJ·mol-1=-86.98 kJ·mol-1,因此反应3为放热反应,反应到平衡后,绝热恒容容器的温度比恒温恒容容器高,绝热恒容容器相对于恒温恒容容器,平衡逆向进行,因此,c(CO2)绝热>c(CO2)恒温。

(4)阳极尿素失电子结合氢氧根离子生成氮气、碳酸根和水。
Ⅱ.(1)题中CO2的转化率不一定是平衡转化率,从反应速率的角度分析,温度升高,CO2反应速率加快,该时间段内转化率增大;从化学平衡角度分析,反应2 为吸热反应,温度升高,有利于反应2正向进行,因此,CO2的转化率增大。
(2)tmin时,CO2的转化率为10%,分析此时CH3OH 选择性为80%,消耗的CO2为1 mol×10%=0.1 mol,生 成 的CH3OH 为0.1 mol×80%=0.08 mol,生成的CO为0.1 mol×20%=0.02 mol,消耗的H2为0.08 mol×3+0.02 mol=0.26 mol,所以0~tmin内H2的反应速率为
11.(1)7NA(2分)
(2)4(1分) Zn(1分)
(3)O>C>H>Fe(1分) sp2(2分)
(4)大于(1分) NH3中N 的孤对电子形成配位键后,使N—H 成键电子对所受斥力减小,键角增大(2分) C2-2或O2+2(1分)
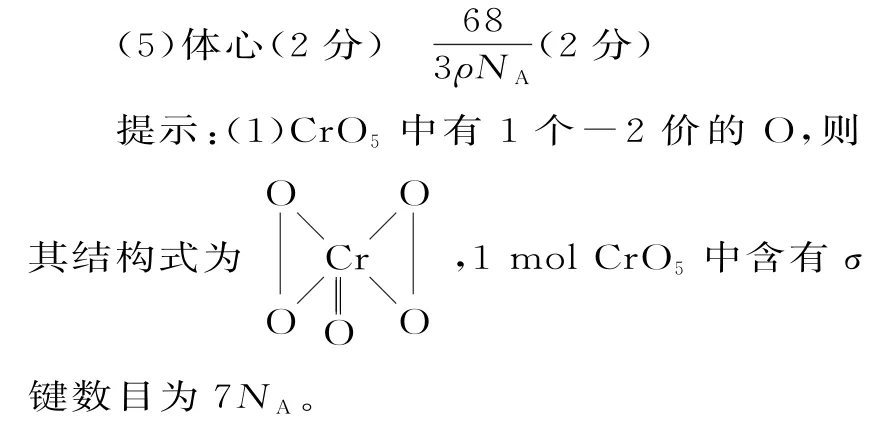
(2)基态锰原子的核外电子排布式为1s22s22p63s23p63d54s2,px原子轨道上电子数2px、3px上分别有2 个 电 子,所 以px原 子 轨道上电子数共4个。与锰同周期第ⅡB 族和ⅢA 族两种元素分别为Zn、Ga,基态Zn的核外电子排布式为[Ar]3d104s2,基态Ga的核外电子排布式为[Ar]3d104s24p1,Zn 核外电子排布为全充满状态,稳定结构,难失去电子,第一电离能比Ga大。
(4)氨气分子中氮原子上有一对孤电子对,[Cu(NH3)4]2+中氮原子上没有孤电子对,排 斥 力 小,所 以[Cu(NH3)4]2+中H—N—H 键 角 大 于 气 态 NH3分 子 中H—N—H 键角。

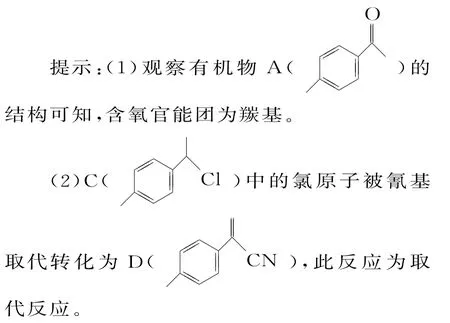
12.(1)羰基(2分)
(2)取代反应(2分)

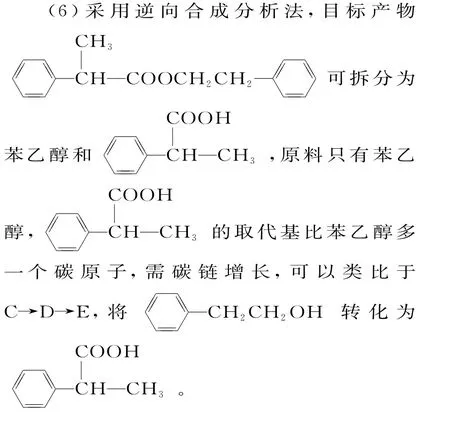
(3)F→G 是取代反应(酯化反应),此反应是可逆反应,选择SOCl2参加反应产率更高是因为SOCl2会发生水解,消耗反应产生的水,有利于反应正向进行。化学方程式为SOCl2+H2O ==SO2↑+2HCl↑。
(4)手性碳原子指的是与四个不同原子或原子团相连的碳原子,分析有机物H 的结构简式,发现有2个手性碳原子。
(5)碱性条件下完全水解生成两种产物,所以含有酯基,分子中含有苯环和甲基,核磁共振氢谱显示4组峰且峰面积为6∶3∶2∶1,所以满足条件的E 的同分异构体有6种,即