辣椒不同栽培土壤/基质真菌群落结构特征分析
马慧斐 朱海生 李永平 黄昊 康玉妹 温庆放 薛珠政
摘 要:為对比分析辣椒不同栽培土壤/基质中真菌差异、揭示辣椒无土栽培基质中真菌群落结构特性,分别采集辣椒无土栽培根际基质(SlPlRh)、无土栽培非根际基质(SlPlNRh)、根际土壤(PlRh)、非根际土壤(PlNRh)以及非耕作土壤(NPl)作为试验素材。利用Illumina-Seq高通量测序技术检测5种土壤/基质中真菌多样性及丰度,分析真菌群落结构特征。结果表明:PlNRh真菌丰度和多样性最高,SlPlNRh最低,两者丰度存在显著差异,其他样品间丰度和多样性均无显著差异;真菌群落组成在门分类水平PlRh、SlPlRh和SlPlNRh的组成较相似,平均相对丰度占比有差异,属分类水平NPl、PlRh和PlNRh组成相似,SlPlRh和SlPlNRh组成相似;真菌群落聚类分析表明NPl、PlRh、PlNRh 3种土壤和SlPlRh、SlPlNRh 2种基质明显分成两个类群;LEfSe分析结果显示PlRh和PlNRh两种土壤的显著性差异物种最多、SlPlRh最少。通过检测辣椒种植土壤和无土栽培基质中真菌多样性及群落组成,比较分析不同类型种植基质根际真菌微生物组的差别,初步揭示辣椒无土栽培基质真菌多样性和群落结构特征,为今后无土栽培基质选择、基质组分配比和改良提供科学依据。
关键词:辣椒;无土栽培;基质;真菌群落结构;多样性
中图分类号:S 641.3 文献标志码:A 文章编号:0253-2301(2023)01-0043-08
DOI: 10.13651/j.cnki.fjnykj.2023.01.007
Analysis on the Community Structure Characteristics of Fungi inDifferent Cultivated Soils/Substrates of Pepper
MA Hui-fei, ZHU Hai-sheng, LI Yong-ping, HUANG Hao, KANG Yu-mei, WEN Qing-fang*, XUE Zhu-zheng*
(Fujian Key Laboratory of Vegetable Genetic Breeding/Crop Research Institute, Fujian Academy of Agricultural
Sciences/Fujian Research Center of Vegetable Engineering Technology, Fuzhou, Fujian 350013, China)
Abstract: In order to compare and analyze the differences of fungi in different cultivated soils/substrates of pepper and reveal the characteristics of fungal community structure in the soilless culture substrates of pepper, the rhizosphere matrix (SlPlRh) for the soilless culture of pepper, non-rhizosphere matrix for the soilless culture (SlPlNRh), rhizosphere soil (PlRh), non-rhizosphere soil (PlNRh) and uncultivated soil (NPl) were collected as the experimental materials. Then, the diversity and abundance of fungi in the five kinds of soils/substrates were detected by using the Illumina Seq high-throughput sequencing technology, and the structural characteristics of fungal community were analyzed. The results showed that PlNRh had the highest fungal abundance and diversity, while SlPlNRh had the lowest. And there were significant differences in the abundance between the two samples, while there were no significant differences in the abundance and diversity among other samples. The fungal community composition of PlRh, SlPlRh and SlPlNRh was similar at the phylum classification level, and the average relative abundance ratio was different. At the genus classification level, the composition of NPl, PlRh and PlNRh was similar, and the composition of SlPlRh and SlPlNRh was similar. The cluster analysis of fungal community showed that the three kinds of soil (NPl, PlRh and PlNRh) and the two kinds of substrates (SlPlRh and SlPlNRh) were obviously divided into two class groups. The lEfSe analysis showed that PlRh and PlNRh had the most species with significant difference, while SlPlRh had the fewest. By detecting the diversity and community composition of fungi in the planting soil and the soilless culture substrates of pepper, the differences of the rhizosphere fungal microbiome in different types of planting substrates were compared and analyzed. Then, the diversity and community structure characteristics of fungi in the soilless culture substrates of pepper were preliminarily revealed, which provided scientific basis for the selection of soilless culture substrates, the distribution ratio and improvement of matrix group in the future.
Key words: Pepper; Soilless culture; Substrate; Fungal community structure; Diversity
植物葉内、叶表、根内和根际这4个部位存在着对其生长发育、形态建成、抗病抗逆等影响重大的微生物群落[1-2],其中根际微生物对植物的贡献长期以来一直倍受重视并得到深入研究[3-4]。于峰等[5]研究表明植物可以通过特殊的根系微生物群进行定殖,进而上调磷饥饿反应基因的表达,帮助缓解磷酸盐饥饿。相比细菌,真菌对土壤中氮素、磷素吸收和植物残体、复杂化合物分解有着更强的作用。合理管理植物根际微生物组不仅能促进宿主营养吸收、抵抗病虫害及适应环境胁迫,还可促进健康土壤的形成,增强土壤生态系统的服务功能[6]。
无土栽培是近几十年发展起来的产业化作物栽培新技术,包括基质栽培、水培和雾培[7]。无土栽培突破地域和土壤环境限制,可实现立体栽培,极大地节约了耕种面积[8],有效避免土传病害,减少农药使用,降低水分和肥料投入,更适合农业绿色发展方向[9]。经过几十年的试验和发展,我国无土栽培已经广泛应用于农业生产和社会生活的多个方面,包括基质育苗[10-11]、蔬菜种植[12-14]、花卉栽培繁殖[15-16]、生态观光[17]等。相比水培和气培,使用固态基质种植对技术的要求较低、操作简便、成本低,因此得到了更广泛的应用[18]。而针对无土基质栽培植物根部微生物的研究还较少,本研究期望通过检测无土栽培模式基质中根际和非根际微生物多样性,解析无土基质与植物根系互作以及根际土壤微生物群落结构特征,为今后无土栽培基质选择、基质组分配比和改良提供科学依据。1 材料与方法
1.1 试验区概况
试验位于福建省福清市福建省星源农牧科技股份有限公司的种植基地(25°32 N,119°24 E),海拔15 m。基地属南亚热带海洋性气候,年平均气温21.1℃。主要种植辣椒,采用普通设施栽培和无土基质栽培两种种植模式。无土栽培基质按照有机肥10%、珍珠岩5%、草炭25%和椰糠60%的比例混合均匀,再分装到基质袋中,连接水肥一体化装备。
1.2 试验材料采集
于2019年9月25日采集辣椒根际土/基质(PlRh/SlPlRh)、非根际土/基质(PlNRh/SlPlNRh)和基地内非种植土壤(NPl),每个小区选取5个点采集混合样。PlNRh/SlPlNRh:将辣椒植株拔起后抖落大块的土壤碾碎混匀,收集备用;PlRh/SlPlRh:上述操作后粘在辣椒根系的土壤/基质用力抖在铺好的纸上,混匀备用;NPl:采自棚内柱子下面距离地面10~15 cm的土体。上述5种处理各取3次重复,每份样品大约5 g,立即装入灭菌的10 mL离心管中,放入干冰中速冻,用于DNA提取。
1.3 土壤DNA提取
采用天根生化科技(北京)有限公司的TGuide S96基因组DNA提取试剂盒提取样品DNA。用酶标仪对提取的核酸进行浓度检测,根据浓度进行检测扩增,扩增后PCR产物使用浓度1.8%的琼脂糖进行电泳检测。
1.4 真菌多样性测序
真菌多样性是基于Illumina Novaseq测序平台,利用双末端测序(Paired-End)方法,构建小片段文库进行测序。测序结束后使用Trimmomatic[19](version 0.33)对原始数据进行质量过滤,然后使用Cutadapt[20](version 1.9.1)进行引物序列的识别与去除,使用USEARCH[21](version 10)对双端reads进行拼接并去除嵌合体(UCHIME[22],version 8.1),最终得到高质量的序列用于后续分析。
1.5 数据分析
借助百迈客公司云平台系统进行真菌OTU、α多样性、群落结构、系统进化等分析。使用SPSS数据分析软件进行差异显著性分析。
2 结果与分析
2.1 样品测序深度评价
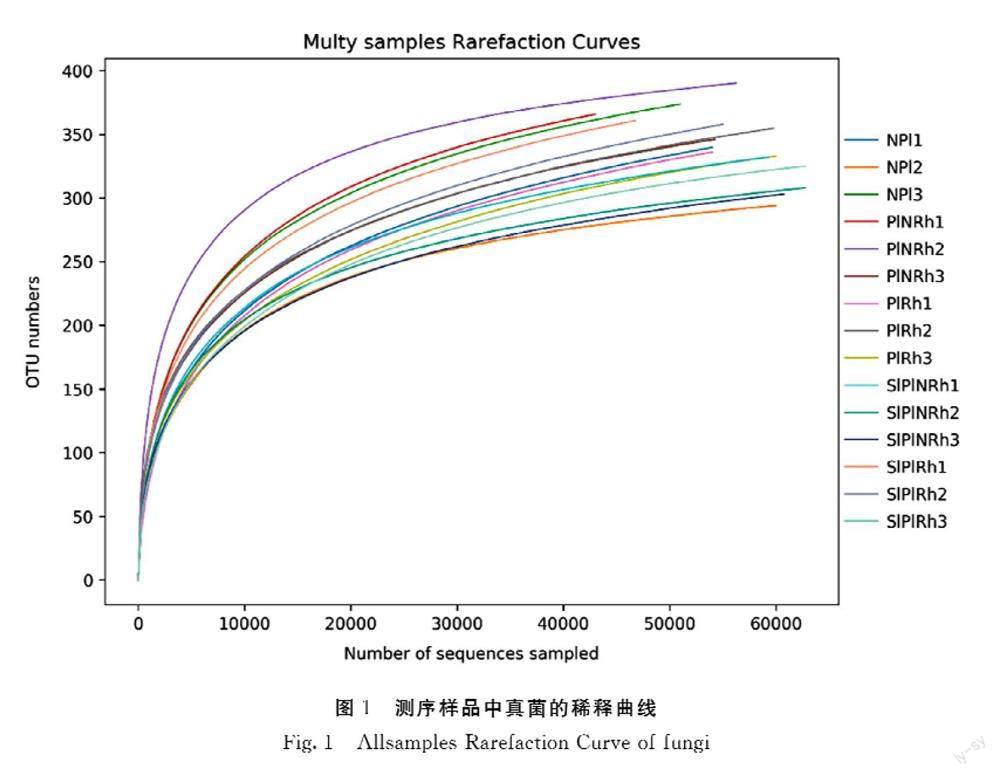
为确定微生物多样性测序样本数据是否满足后续分析需要,对测序深度进行分析。从每个样品中随机抽取一定测序量数据,统计它们所代表物种数目,用抽到的序列数和代表的物种数来构建稀释性曲线。由图1可知,随着测序量的增加,真菌的稀释曲线逐渐趋于平坦,虽未达到饱和,但继续增加测序量只会产生少量新的OTU,并不对OTU总数产生显著影响,表明本试验的测序数据量合理,能够较真实地反映这5组土壤样品的真菌群落。
2.2 不同栽培基质真菌OTU差异分析
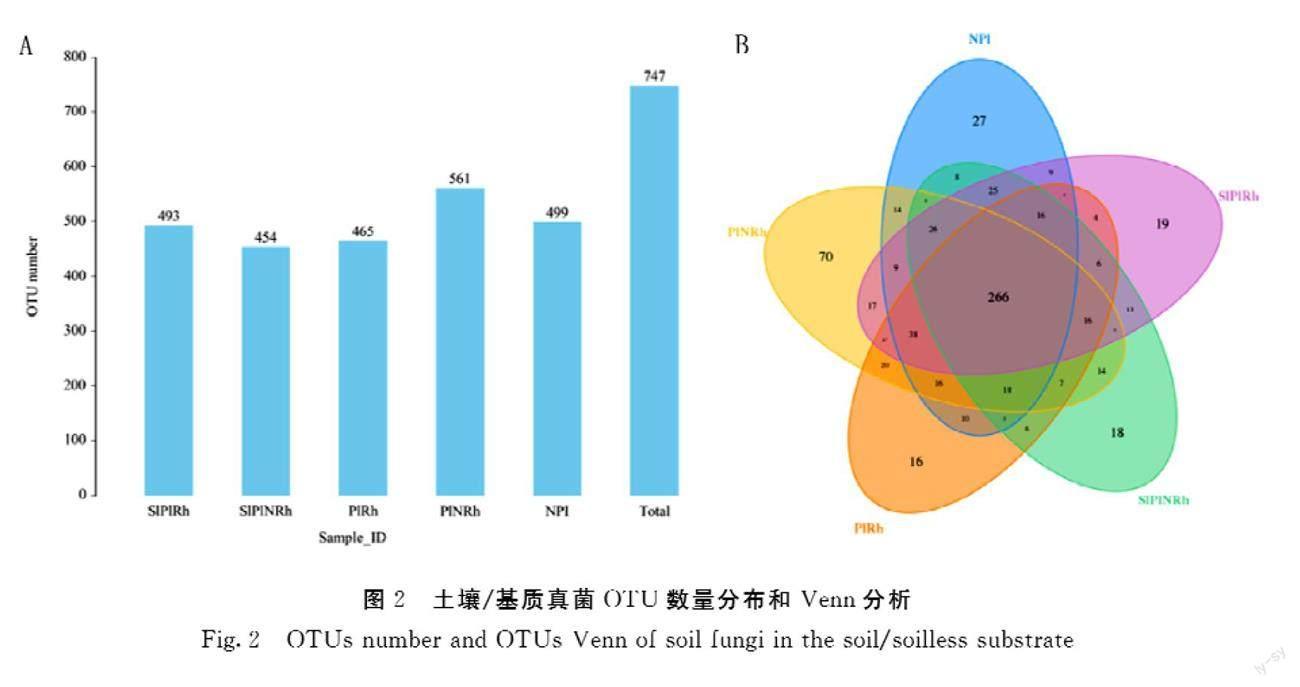
对5组样品的OTU数进行统计,结果共产生747个OTU,每组包含的OTU数介于454~561个,共有OTU数为266个,占总数的35.6%。其中NPI、SlPlRh、SlPlNRh、PlRh和PlNRh分别得到499、493、454、465和561个OTU。PlNRh中特有的OTU最多,为70个,占总数的9.37%;PlRh、SlPlRh和SlPlNRh中特有的OTU分别为16、19和18个,数量比较接近,平均占总数的2.37%,NPI中特有的OTU为27个,占总数的3.61%。
2.3 不同栽培基质真菌α多样性分析
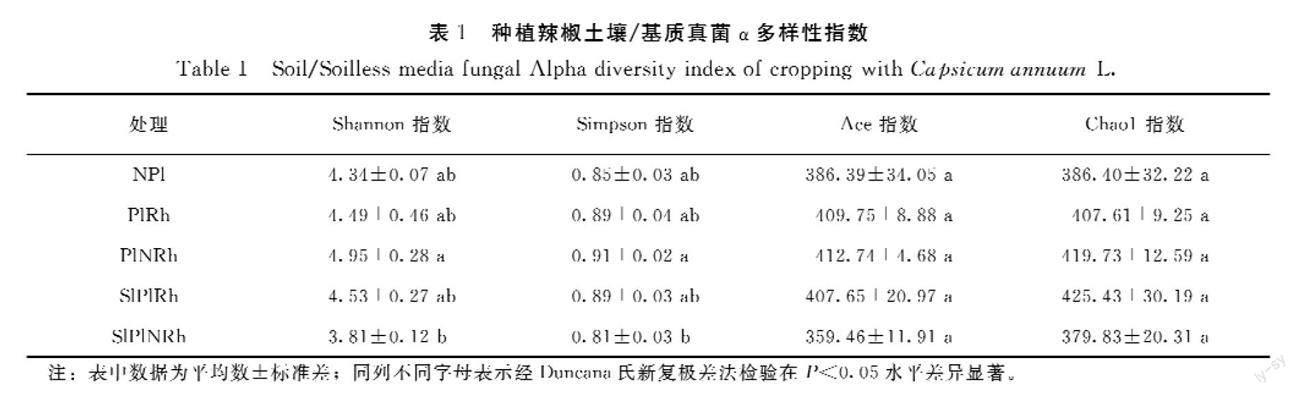
从表1可知,5种类型的土壤/基质真菌α多样性指数Ace和Chao1表现为SlPlNRh最低,PlNRh最高,显著性分析表明它们之间存在显著差异,其余样品之间则无显著差异,说明SlPlNRh的真菌丰富度最低。推测可能因为原始基质材料中真菌数量较少,且缺少植物根际分泌物的诱导。Shannon指数和Simpson指数显示SlPlNRh所包含的真菌多样性最少,其次为NPI,而PlRh、PlNRh和SlPlRh处理多样性指数差距较小,显著性分析结果表明5组样品之间真菌多样性不存在显著差异。推测SlPlNRh是几种人工配比物质的组合,原始携带的真菌种类有限又缺少植物根际分泌物的诱导,所以真菌多样性最低;NPI真菌多样性偏低可能是因为缺乏营养,即使含有丰富的真菌种类,在丰度较低的情况下也不足以检测到;PlNRh虽然缺少根际分泌物的诱导,但其属于自然环境,拥有最丰富的微生物资源库,加之耕作土壤营养丰富,适宜微生物生长,因此可检测到最丰富的真菌种类;PlRh和SlPlRh的真菌多样性非常接近,可能是植物根际分泌物与土壤/基质中的微生物经过复杂的互作后筛选的结果。
2.4 基质栽培和土壤栽培对真菌群落组成及相对丰度的影响
从图3可知,PlRh、SlPlRh和SlPlNRh真菌微生物群落在门分类水平上的组成较相似,但平均相对丰度占比有差异;真菌微生物群落在门分类水平上与NPl和PlNRh差异较大。各处理中真菌类群相对丰度排名前10的有子囊菌门Ascomycota、未知分类真菌unclassified_Fungi、罗兹菌门Rozellomycota、担子菌门Basidiomycota、被孢霉门Mortierellomycota、壶菌门Chytridiomycota、隐真菌门Aphelidiomycota、油壶菌门Olpidiomycota、球囊菌门Glomeromycota和Kickxellomycota菌门。其中,子囊菌门、未知分类真菌、罗兹菌门和担子菌门的真菌为明显优势菌群,其他6个菌门的平均相对丰度较低。
属分类水平上,各处理中真菌类群相对丰度排名前10的有未分类真菌unclassified_Fungi、青霉菌属Penicillium、曲霉属Aspergillus、隶属于粪壳菌纲未知属的真菌unclassified_Sordariomycetes、镰刀菌属Fusarium、Savoryella、隶属于毛壳菌科未知属的真菌unclassified_Chaetomiaceae、隶属于子囊菌纲未知属的真菌unclassified_Ascomycota、Wardomycopsis和假埃希氏菌属Pseudallescheria。真菌微生物群落较明显地分成NPl、PlRh、PlNRh和SlPlRh、SlPlNRh两组。值得关注的是常常引起植物的根腐、茎腐、茎基腐等多种病害的镰刀菌属真菌在PlRh、SlPlRh和SlPlNRh中丰度更低,推测在营养充足健康的辣椒根际能够产生抑制镰刀菌的分泌物,SlPlNRh中的低丰度应该是由于本身基质组分携带镰刀菌的数量极少。
2.5 不同栽培基质真菌群落聚类分析
使用Qiime软件计算Unifrac距离,并基于Weighted Unifrac方法构建UPGMA样品聚类树,对5种土壤/基质的15个样品真菌群落构成的相似性进行聚类分析,并将聚类结果与各样品在门分类水平上的物种相对丰度进行整合展示(图4)。结果表明,SlPlRh和SlPlNRh的真菌群落成员在聚类上与3种土壤样品NPl、PlNRh和PlRh明显分成两个大类,3种土壤的真菌群落在聚类关系上趋同性较强。表明真核微生物种群结构构建与所处的环境物质有较大的相关性。
2.6 基质栽培和土壤栽培真菌群落组间差异性
通过LEfSe分析,可以发掘出组间具有显著差异的Biomarker,以及显著影响组间差异性的物种或群落[23]。不同基质和土壤中真菌微生物群落组间差异LEfSe分析柱状图和进化分支图见图5,不同土壤和基质类型对应不同的Biomarker,PlRh和PlNRh两种种植土壤的显著性差异物种(Biomarker)最多,应该是基于土壤这个庞大的微生物资源库且营养充足。NPl和SlPlNRh次之,SlPlRh最少。在门分类水平上,PlNRh中含有的被孢霉门Mortierellomycota的真菌为显著性差异物种,其他4组样品在门分类水平上无显著差异物种。在种分类水平上,SlPlRh中包含的青霉属Penicillium_menonorum、Xenomyrothecium_tongaense和光滑端梗孢属的光滑端梗霉菌Acrophialophora_levis为显著性差异物种,SlPlNRh中包含的两种分别隶属于曲霉属的真菌unclassified_Aspergillus和粪壳菌纲unclassified_Sordariomycetes的真菌为显著性差异物种。基质中差异显著物种对植物生长的影响还需要后续试验来检验。
3 结论与讨论
本研究表明,辣椒根际土壤(PlRh)非根际土壤(PlNRh),无土栽培根际基质(SlPlRh)非根际基质(SlPlNRh),及非耕作土壤(NPl)包含的真菌丰度和多样性表现为SlPlNRh>PlRh/SlPlRh>NPl>PlNRh,表明植物根系可以从原本真菌资源丰富的根际土壤中选择性地招募部分真菌类群,也可以从原本丰富度和多样性较低的基质(也可能是因为丰度太低未被检测到)中发展出更多的真菌类群。群落聚类分析显示,来自土壤和基质的真菌群落能够较明显地分成两个类群,表明环境物质对土壤真菌群落构建具有积极作用。5组样品在门、纲、目、科、属、种分类水平上不同程度地存在差异显著性物种,这些差异物种对植物生长、发育的影响还需要进一步验证。
无土栽培技术从早期的实验室研究到现在的大规模商业化生产应用,经历了150多年,而栽培基质与不同种类植物根部的互作对植物和微生物的影响还处于探索阶段。我国无土栽培起步较晚,分布较广但不够集约,新型无土栽培技术大多数只在小规模试验示范,还未能形成像国外那样成熟的栽培技术体系。国内农业整体机械化程度还不够发达,尤其是无土栽培在机械化和自动化方面与美国、德国、日本、荷兰等发达国家相比有较大差距。无土基质的质地与普通土壤有较大的差异,目前使用的基质大部分是用草炭、有机腐殖土、椰糠、蛭石等按照一定比例混合配置而成。陈娟等[24]通过对不同类型土壤种植辣椒前后微生物多样性比较发现,辣椒种植会使不同类型土壤中细菌和真菌的OTU數量有所上升。本研究发现无土基质中辣椒根际真菌OTU高于非根际,说明辣椒根际分泌物在基质环境下同样能够诱导微生物群落增长。陈娟等[24]同时也发现真菌群落结构受到不同品种辣椒基因型因素的影响,由此推测相同配方的基质中种植不同品种作物后真菌群落结构也会有差异,而具体差异以及差异对作物的影响还需要后续试验来验证。
设施土壤环境由于连作、缺乏雨水淋滤等因素正在不断恶化,无土基质栽培方式成为设施蔬菜可持续绿色发展的重要途径。胡云等[25]在黄瓜无土栽培基质中添加生物炭发现可明显提高多种真菌的比例,还可以增加黄瓜根际酶的活性,提升黄瓜根际速效磷、速效钾、碱解氮、有机质含量,最终提高黄瓜产量和品质。说明合理调整、改变基质组分能够改变植物根际微生物群落结构,改善根际酶活性,进而提高作物产量和品质。本研究对不同栽培基质真菌群落聚类分析也表明3种土壤的真菌群落在聚类关系上趋同性较强,与2种基质中的真菌群落明显区分开来,也说明种植基质对植物根际真菌群落组成产生积极作用。
因此,基质配方开发还有很大空间,为不同作物研发不同基质也是未来需要深入研究的课题。耕地土壤微生物丰度和结构的变化是反映土壤环境质量变化的重要生物指标[26],本研究结果也反映了植物和基质相互作用对土壤微生物的影响,因此基质中微生物丰度和群落结构变化同样可以用来检验基质能否为植物提供合适的根际环境。种植后土壤微生物的多样性、群落结构等也可成为检验基质是否适用的参考指标。
参考文献:
[1]杜威,江萍,王彦苏,等.白僵菌施加对水稻三种抗氧化酶活力及叶际微生物多样性的影响[J].生态学报,2014,34(23):6975-6984.
[2]MELOTTO M,UNDERWOOD W,KOCZAN J,et al.Plant stomata function in innate immunity against bacterial invasion[J].Cell,2006,126(5):969-980.
[3]潘丽媛,肖炜,董艳,等.超高产生态区水稻根际微生物物种及功能多样性研究[J].农业资源与环境学报,2016,33(6):583-590.
[4]陈偉立,李娟,朱红惠,等.根际微生物调控植物根系构型研究进展[J].生态学报,2016,36(17):5285-5297.
[5]TANG J,WU D,LI X,WANG L,et al.Plant immunity suppression via PHR1-RALF-FERONIA shapes the root microbiome to alleviate phosphate starvation[J].EMBO J,2022:e109102.
[6]邵秋雨,董醇波,韩燕峰,等.植物根际微生物组的研究进展[J].植物营养与肥料学报,2021,27(1):144-152.
[7]晏琼,刘晓宇,虞昊安,等.植物无土栽培技术研究进展[J].中国农业大学学报,2022,27(5):1-11.
[8]王紫芹,甘德欣,龙岳林.无土栽培研究进展[J].农业科学与技术(英文版),2013, 14(2):269-278,323.
[9]梁玉芹,杨阳,刘云,等.无土基质材料对作物生长及病害防治的研究进展[J].华北农学报,2016,31(S1):421-425.
[10]车艳丽,李彦明,杨其长,等.酒糟沼渣在番茄基质育苗上的应用[J].中国农业大学学报,2021,26(1):88-98.
[11]闫志山,杨骥,范有君,等.脱毒马铃薯试管苗不同育苗基质处理对原原种产量的影响[J].中国马铃薯,2003(6):345-346.
[12]黄仁权,高永,戴燚.智能温室草莓无土栽培关键技术[J].耕作与栽培,2022,42(1):127-128.
[13]陈耀兵,陈国辉,阮锡春.无土栽培不同基质配方对辣椒生长的影响[J].现代农业科技,2018(18):46,48.
[14]GRUDA N S.Increasing Sustainability of Growing Media Constituents and Stand-Alone Substrates in Soilless Culture Systems[J].Agronomy,2019(9):298.
[15]马海龙,刘忠华,段志平,等.蚯蚓粪替代泥炭的栽培基质特性及对绿萝和吊兰花卉生长的影响[J].中国土壤与肥料,2021(5):112-118.
[16]尤毅,孙映波,吕复兵,等.切花文心兰无土栽培基质的优化筛选[J].广东农业科学,2011,38(14):43-46.
[17]朱泓厚,杨子涵,任丽颖.安徽省滁州市无土景观植物应用现状与分析[J].江西农业,2020(10):121-122.
[18]李婷婷,马蓉丽,成妍,等.中国蔬菜基质栽培研究新进展[J].农学学报,2013,3(04):30-34.
[19]BOLGER A M,MARC L,BJOERN U.Trimmomatic:a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014(15):2114-2120.
[20]MARTIN M.Cutadapt removes adapter sequences from high-throughput sequencing reads[J].Embnet Journal,2011,17:10-12.
[21]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-2001.
[22]KNIGHT R.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[23]ZHANG C,LI S,YANG L,et al.Structural modulation of gut microbiota in life-long calorie-restricted mice[J].Nature Communications,2011,4(1):2163-2173.
[24]陈娟,刘周斌,欧立军.不同类型土壤种植辣椒前后微生物多样性比较[J].中国农学通报,2021,37(10):84-93.
[25]胡云,马建华,李明,等.生物炭对基质栽培黄瓜根际养分与真菌丰度的影响[J].分子植物育种,2022,20(8):2773-2780.
[26]崔晓辰.根际微生物与土壤植物关系的研究进展[J].现代农业研究,2021,27(5):34-35,49.
(责任编辑:柯文辉)

