负载褐藻多酚的丝素蛋白GBR生物膜制备及其性能的体外实验研究
陈文泽,邹多宏,2
由牙周炎症、外伤、感染等原因造成的牙槽骨骨量不足使得口腔种植体在植入后无法实现充分的骨整合,从而不利于口腔种植术后获得良好的预后[1]。引导骨再生(guided bone regeneration, GBR)技术是临床上治疗牙槽骨缺损常用且有效的方法之一,通过屏障膜隔绝骨缺损区域外非成骨细胞向缺损区域的迁移,从而为缺损区域内骨组织的形成提供了空间,因此,屏障膜在GBR技术中发挥着至关重要的作用[2]。理想的GBR屏障膜应具备良好的机械性能、生物相容性、生物可降解性以及一定的促成骨能力等特性[3],如何获得兼具这些特性的GBR屏障膜仍是亟待解决的问题。该实验使用丝素蛋白 (silk fibroin, SF) 制备了双层丝素蛋白膜,并在其粗糙面上负载褐藻多酚 (phlorotannins, PT),使该膜兼具生物可降解性、良好的抗拉强度、良好的生物相容性以及促进人牙槽骨骨髓间充质干细胞成骨向分化的能力,可作为新型骨组织工程生物屏障膜使用。
1 材料与方法
1.1 合成材料蚕茧(浙江久恒蚕丝制品经营部);碳酸钠、溴化锂(美国 Sigma-Aldrich公司);MWCO 3500透析袋(美国 Pierce公司);褐藻多酚(陕西帕尼尔公司)
1.2 主要试剂与仪器α-MEM、胰酶消化液、青-链霉素溶液、BCIP/BNT碱性磷酸酯酶显色试剂盒(上海碧云天生物技术有限公司);活死细胞染色试剂盒(美国 Proteintech公司);胎牛血清(美国Gibco公司);人骨髓间充质干细胞成骨诱导分化试剂盒(广州赛业生物科技有限公司);CCK-8试剂(日本同仁化学研究所);PCR引物(上海生物工程股份有限公司);CO2孵育箱、酶标仪、实时荧光定量PCR仪、傅里叶红外光谱仪(美国Thermo Fisher Scientific公司);扫描电子显微镜(日本电子株式会社);高温高压灭菌锅(厦门致微仪器有限公司)。
1.3 方法
1.3.1人牙槽骨骨髓干细胞的分离与培养 门诊收取18~24周岁女性患者骨阻生第3磨牙时去除的牙槽骨,放入取材液(含5%青-链霉素双抗溶液的α-MEM的培养基)中,冰盒内保存。用含有2%双抗的PBS冲洗3次,用无菌手术刀片清除附着软组织,用组织剪分离骨松质并剪碎,5 d后首次换液,以后每3 d换液1次,培养10~12 d获得P0代。将获得的原代细胞进行传代扩增,计数,将细胞冻存备用。取第3代hABMSCs供实验用。
1.3.2制备SF溶液 蚕茧在0.02 mol/L碳酸钠溶液中煮沸30、60、90 min后在蒸馏水中冲洗3次,每次30 min进行脱胶处理。脱胶后的蚕丝干燥12 h后在60 ℃的9.3 mol/L溴化锂溶液中溶解4 h,所得的溶液装入MWCO 3500透析袋内在蒸馏水中透析2 d。最后将透析袋内的溶液移入离心管,18 000 r/min离心2次,每次20 min,收集上清液。
1.3.3制备PT-SF双层膜 将SF溶液浇铸于亚克力板上,室温放置24 h后成膜,真空水蒸气处理24 h,取出后固定于不锈钢板上,在膜上涂布SF溶液,放入-80 ℃冰箱,使不锈钢板与冰箱隔板紧密接触,冷冻过夜后将其转入冻干机冻干,再经真空水蒸气处理24 h获得SF双层膜。将3.5 μg的PT溶解于1 ml无水乙醇中制备PT溶液,按照6.5 μl/cm2的比例在SF双层膜的粗糙面上滴加PT溶液,放置在生物安全柜中直到干燥,并保存在-80 ℃冰箱中供后续使用。
1.3.4力学测试 将不同脱胶时长的SF双层膜裁剪为长 100 mm、宽10 mm 的测试样品,浸泡于PBS内室温过夜,并通过力学万能实验机以 0.01 mm / s 的拉伸速度匀速拉伸直至样品断裂,测量其室温条件下的湿态抗拉强度,每组样品重复测试 5次。
1.3.5结构表征 取抗拉强度最大的SF双层膜所对应的SF溶液重新制备膜样品。低真空下喷金后使用扫描电镜在15.0 kV的加速电压下拍摄样品的光滑面与粗糙面,取PT粉末、SF膜和PT-SF双层膜采用傅立叶变换红外光谱仪分析各成分。
1.3.6细胞生物相容性实验 按照国际标准组织(ISO/EN10993-12)规定提取SF双层膜与PT-SF双层膜的浸提液,将高温高压消毒后的各组样品浸泡于含10 %胎牛血清和1%青-链霉素溶液的α-MEM培养基内24 h,样品与培养基比例为1 g/10 ml[4]。在96孔板内接种细胞,每组每个时间点5个副孔,每孔接种1× 104个hABMSCs。接种24 h后更换培养基,对照组使用普通培养基培养,SF组与PT-SF组使用对应的浸提液培养,此后每3 d换液1次。在1、4、7、14 d时分别弃去培养基,PBS清洗2次,每孔加入CCK-8溶液(CCK-8 ∶DEME=1 ∶9)100 μl,37 ℃孵育2 h后使用酶标仪读取每孔在450 nm处的吸光度值。
1.3.7细胞活力及细胞黏附实验 细胞活力实验:将SF双层膜、PT-SF双层膜制备成直径10 mm的圆形样品。在每个样品上接种5× 104个hABMSCs,空白组将细胞接种于24孔板底,每组3个复孔,培养24 h后按照活死细胞染色试剂盒使用说明进行染色操作,使用荧光显微镜进行观察;细胞黏附实验:将PT-SF双层膜制备成直径6 mm的圆形样品。在每个样品的粗糙面上接种1×104个hABMSCs,48 h后,PBS清洗3遍,用4 %多聚甲醛固定样品30 min后PBS清洗3遍,使用扫描电镜拍摄样品。
1.3.8细胞成骨分化的检测 qRT-PCR:将1×105个hABMSCs分别接种在SF双层膜和PT-SF双层膜的粗糙面上,细胞接种24 h后吸弃培养基,PBS清洗2次后每孔加入成骨诱导培养基1 ml,此后每3 d更换1次,在成骨诱导第7天时用TRIzol提取细胞中的RNA并根据试剂说明书逆转录合成cDNA。采用qRT-PCR检测碱性磷酸酶(alkaline phosphatase, ALP),RUNX相关转录因子2(RUNX family transcription factor 2, RUNX2)和成骨细胞特异性转录因子(Osterix, OSX)基因表达水平(引物序列见表1)。ALP染色与茜素红染色:将消毒后的各组样品分别浸泡于成骨诱导培养基内24 h,样品与培养基的比例为1 g/10 ml,获得浸提液。将hABMSCs接种于12孔板内,每孔1×105个,24 h后更换成骨诱导培养基或相应浸提液,每3 d换液1次,7 d后采用ALP染色的方法检测ALP活性,14 d后采用茜素红染色的方法检测钙盐沉积情况。

表1 PCR引物序列

2 结果
2.1 不同脱胶时间的丝素蛋白溶液制备的膜抗拉强度的比较图1A为分别由脱胶时间30、60、90 min的丝素蛋白溶液制备而成的丝素蛋白双层膜在湿态条件下的拉伸曲线;随着脱胶时间从30、60 min增加至90 min,丝素蛋白双层膜的抗拉强度从 (3.293±0.122 8)、(2.649±0.096 6)MPa 降低至(2.077±0.181 3) MPa(图1B)。

图1 SF双层膜的抗拉强度测试
2.2 样品表征扫描电镜可见SF双层膜光滑面表面致密光滑 (图2A),粗糙面疏松多孔(图2B),截面可见粗糙面呈纵向有序多孔的结构 (图2C);与SF相比,在PT-SF中氢键和N-H伸缩振动由3 275移动至3 274 cm-1,C-H伸缩振动由2 937移动至2 930 cm-1,C-N伸缩振动和N-H弯曲振动由1 514移动至1 512 cm-1(图2D)。这表明PT可能通过氢键、疏水作用等作用力与SF发生了相互作用,从而结合到了SF双层膜的粗糙面上。

图2 SF双层膜及PT-SF双层膜的微观结构及成分分析
2.3 细胞黏附能力及PT-SF双层膜生物相容性实验hABMSCs接种在PT-SF双层膜的粗糙面48 h后,扫描电镜结果表明细胞可以较好的黏附在PT-SF双层膜的粗糙面上 (图3A、B)。CCK-8结果显示,使用浸提液培养 1、4、7、14 d后,空白组、SF组和PT-SF组之间的吸光度值无明显差异 (图3C);活死细胞染色结果如图3D显所示,活细胞呈绿色荧光 (Live),死细胞呈红色荧光 (Dead),空白组、SF组及PT-SF组粗糙面上活死细胞比例无明显差异。
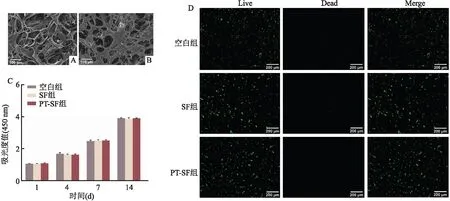
图3 PT-SF 膜的生物相容性
2.4 促成骨分化能力qRT-PCR结果显示,与空白组及SF组相比,PT-SF组的成骨相关基因ALP、RUNX2 (P=0.056 5,F=10.38) 以及OSX 的表达显著性增强,其中ALP 与OSX的差异有统计学意义(P=0.008 7,F=36.66;P=0.047 5,F=11.89)(图4A-C)且成骨诱导至第7天 时ALP染色及第14天时茜素红染色结果显示,PT-SF组的ALP阳性结果及茜素红着色更加明显(图4D、E)。

图4 PT-SF双层膜的促成骨分化能力检测
3 讨论
临床上使用的可吸收性GBR膜多由人工合成高分子材料或天然高分子材料制成,人工合成高分子材料制备的GBR膜在降解过程中可能会引发局部的炎症反应不利于成骨[5],而天然高分子材料制备的膜则通常力学性能较差[6]。丝素蛋白是一种来源广泛的天然高分子蛋白材料,具有优异生物相容性和力学性能,同时其分子结构与构成骨组织的主要有机成分I型胶原纤维具有高度的相似性,因此,在骨组织工程领域被公认为颇具潜力的天然材料[7]。褐藻多酚是一种来源于褐藻的多酚类物质,既往研究[8]表明褐藻多酚具有抗氧化、抗菌等作用,同时也有研究[9-10]表明褐藻多酚具有促进骨髓间充质干细胞成骨方向分化的能力 。
该实验通过溶液浇铸、定向冷冻及冷冻干燥技术制备了由致密层和多孔层共同构成的双层丝素蛋白膜。其朝向软组织面的致密层表面光滑结构致密,致密的结构可为SF双层膜提供良好的力学性能,拉伸实验[11]结果表明其湿态下抗拉强度可达 (3.293±0.122) MPa,显著高于市售Bio-Gide 胶原膜的(1.68±0.54) MPa;朝向骨组织面的多孔层则具有粗糙表面,呈现出且与致密层的表面相垂直的“蜂窝”状多孔结构,这种结构可为细胞提供有效的附着位点,对于骨缺损区域内成骨相关细胞的黏附具有一定的促进作用[12]。在此基础上利用多酚类物质易与蛋白质通过氢键、疏水键及共价键发生反应的特点,在SF双层膜的粗糙面上实现了褐藻多酚的负载[13]。体外细胞实验结果表明细胞可以较好的与PT-SF双层膜共存并能随培养时间的延长而不断增殖。既往研究[9]表明,褐藻提取物可能通过激活Wnt和BMP通路上调成骨相关基因RUNX2、OSX以及ALP的表达。体外实验表明,与空白组和SF组相比PT-SF组由于PT的加入,hABMSCs内RUNX2与OSX的表达增强, 同时ALP表达水平及活性也均高于空白组和SF组。以上结果表明PT-SF双层膜具有良好的机械性能以及生物安全性,双层膜的结构设计兼顾了屏障功能以及促进细胞黏附的功能,同时结合在粗糙面上的PT弥补了SF双层膜在促成骨能力上的缺陷。
综上所述,该研究通过溶液浇铸、定向冷冻及冷冻干燥技术构建了PT-SF双层膜。相关实验结果显示,所制备的PT-SF双层膜有望作为新型的GBR 膜应用于临床。

