Bmp2影响脂肪干细胞成骨能力的研究
赖文涛,赵志军,张春阳
近些年来,骨形态发生蛋白(bone morphogenetic proteins,Bmps)被证明在诱导成骨分化过程中发挥重要作用[1]。在Bmps的16个亚型中,Bmp2,4,6,7,9被认为是最具骨诱导性的[2]。通过外源性的添加Bmp2或在骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)中过表达Bmp2都能够发挥其成骨分化的作用,以此来达成骨缺损修复的目的[3]。Gromolak et al[4]研究表明在体外用FGF2和Bmp2处理绵羊BMSCs后显示OCN和I型胶原蛋白表达的增加,以及相关成骨基因的表达增高。因此,Bmps介导的骨缺损修复治疗具有广阔的研究价值。
脂肪干细胞(adipose-derived stem cells,Adscs)相比于其他类型的干细胞而言,具有来源广泛、易于获取、多向分化潜能、免疫原性低等特点。Caetano et al[5]报道支架/干细胞复合体骨再生更为显著,表明了Adscs对修复骨组织缺损有积极影响。Adscs还可通过旁分泌的方式将生物活性因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)等来促进缺损部位血管的形成。Han et al[6]研究表明低氧预处理后的外泌体能更高效的促进血管形成。这些特点有助于干细胞复合组织异体移植后降低免疫排斥反应,在临床上应用前景广泛。因此,该研究通过构建过表达Bmp2-Adscs模型,来探讨Bmp2对于Adscs成骨分化能力的影响。
1 材料与方法
1.1 试剂与仪器DMEM 购自大连美仑生物技术有限公司,茜素红、碱性磷酸酶试剂盒购自北京天根有限公司,2 × SYBR Green qPCR Mix购自上海biosharp公司,Runx2一抗、OPN一抗、Bmp2一抗、Bmp4一抗、Smad1/5与p-Smad1/5一抗均购自武汉博奥森有限公司,OCN一抗购自美国Invitrogen公司,Dlx2一抗、羊抗兔二抗均购自美国Abcam公司,β-actin一抗购自上海Santa有限公司,电穿孔转染试剂盒套装、酶标仪均购自美国Thermo Fisher公司。激光共聚焦显微镜 Nikon A1 购自日本Nikon公司,PCR仪 7900HT 购自美国ABI公司,紫外分光光度计购自美国Thermo Fisher公司,Bmp2质粒购自武汉淼灵平台。
1.2 实验方法
1.2.1Adscs的提取及鉴定 大鼠购自维通利华生物技术有限公司。在整个研究过程中,所有大鼠都被保持在1个12 h的光/暗周期中,可以自由获得食物和水。仰卧固定大鼠;从双侧腹股沟皮垫下取出脂肪,并去除多余组织,剪碎后放入含双抗 PBS中进行冲洗。然后置换入离心管,加入0.1%的胶原酶;在温箱中摇床消化1 h,用1 ml注射器反复吹打均匀后,分别用200目与400目的细胞筛过滤,滤液放入离心机中离心10 min,条件1 365 r/min,弃上清液,保留沉淀。使用流式细胞仪,CD90一抗鉴定Adscs。
1.2.2细胞诱导分化及分组 培养大鼠Adscs,镜下观察细胞长至40%~50%的融合度后对细胞进行成骨诱导分化。使用补充了Supplement Mix的成骨分化培养基(MSC Osteogenic)培养24 h后,更换新鲜培养基。培养至80%~90%的生长密度后,使用4%多聚甲醛固定,用PBS清洗后,通过茜素红染色试剂盒进行染色,镜下可见细胞被染成橘红色。将诱导完成的细胞定位阳性对照,未经诱导分化的Adscs为空白对照组(Control组),转染空载质粒的细胞为阴性对照组(Vector组),采用成骨诱导培养基培养的Adscs为成骨诱导组(Inducement组),转染Bmp2质粒的细胞为实验组。
1.2.3Bmp2质粒转染 取1×106个生长状态良好的Adscs,按照Neon Transfection System 电转染试剂盒提供的方法进行 GFP-Bmp2质粒电转染。条件设定为电压1 200 mV、脉冲2次、间隔20 ms,转染成功24 h后在荧光显微镜下观察细胞状态。
1.2.4茜素红与碱性磷酸酶染色 各组培养14 d后,以4%多聚甲醛固定并以PBS冲洗,按茜素红试剂盒说明逐步加入茜素红染液,并在37 ℃摇床中孵育,然后在镜下观察各组染色情况;同样的,按碱性磷酸酶染色试剂盒说明逐步加入碱性磷酸酶染液,在暗室中孵育,然后在镜下观察染色情况,图像使用Image J分析。
1.2.5qRT-PCR实验 提取各组RNA,并测定 RNA浓度。将RNA反转录为cDNA。每组cDNA各取1 μl,利用 SYBR GreenⅠ试剂盒进行 real time PCR扩增,根据所得各组的Ct值,利用 2-ΔΔCt计算Bmp2、Bmp4、BSP、OPN、OCN、Runx2、Smad1、Smad5、Dlx2的mRNA相对表达量。引物序列见表1。

表1 引物序列
1.2.6Western blot实验 各组分别加入RIPA,超声辅助裂解。在低温超速离心机中离心,条件为12 000 r/min,15 min,并测定蛋白浓度。然后上样进行电泳,电泳结束后使用400 mA恒流4 ℃转膜过夜将蛋白转移到0.22 μm的PVDF膜上。用5%脱脂牛奶封闭1 h,0.1% TBST冲洗,4 ℃孵育过夜。TBST冲洗,室温条件下孵育羊抗兔二抗1 h,TBST冲洗后使用ECL超敏发光液进行化曝光显影,使用Image J对蛋白条带的灰度进行扫描。
1.2.7细胞免疫荧光染色 各组细胞分别计数 1×106个,转移至带玻璃爬片的24孔板内进行培养,72 h后弃掉培养基,并使用4%多聚甲醛固定,PBS清洗,使用10%山羊血清封闭1 h,封闭完成后使用OPN、Bmp2、Runx2一抗4 ℃孵育过夜,0.3% PBST清洗3次后使用Alexa Fluor488、Alexa Fluor594荧光二抗室温条件下避光孵育4 h,孵育完成后使用0.3% PBST清洗3次后使用Hoechst 33342进行核复染10 min,甘油封片后使用激光共聚焦显微镜观察荧光强度。

2 结果
2.1 Adscs免疫荧光鉴定及验证转染效率首先,通过对Adscs以CD90进行荧光标记(图1A),阳性率>90%,即细胞纯度>90%,然后通过对各组Adscs进行Bmp2的荧光标记(图1B),相较于对照组,成骨诱导组与Bmp2组的Bmp2基因水平显著上调(P<0.05),说明质粒转染成功。
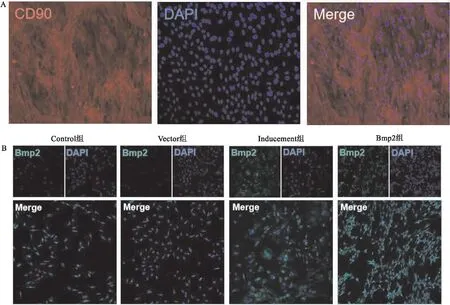
图1 脂肪干细胞荧光鉴定与转染效率的验证 ×400
2.2 Bmp2对Adscs成骨潜能的影响首先,通过Bmp2的mRNA与蛋白表达水平验证诱导分化(图2A),相较于对照组,成骨诱导组与Bmp2组的Bmp2基因水平显著上调(P<0.05),说明诱导分化成功。相较于对照组,骨形态发生蛋白家族中Bmp4、P-Smad1/5均显著升高(P<0.05),说明Bmp通路高度激活。而BSP、OPN、OCN、Runx2、Dlx2的表达相比对照组均显著升高,说明Bmp通路的激活可以促进Adscs向成骨细胞方向分化(P<0.05)。在转录水平(图2B-G),qRT-PCR结果显示Bmp2及Bmp4表达水平显著上调,说明转染过表达Bmp2质粒效率高。相较于对照组,成骨基因BSP、OPN、OCN、Runx2以及Dlx2在过表达Bmp2后均显著升高(P<0.05 ),说明不管是在转录水平还是翻译水平,激活Bmp2信号通路均可以提高Adscs向成骨细胞分化。为了验证实验结果,该实验使用皮尔逊相关性分析对Bmp2蛋白表达和成骨蛋白OPN、OCN、Dlx2、Runx2、BSP进行相关性分析(图2H-L),结果显示Bmp2及OPN、OCN、Dlx2、Runx2、BSP的表达呈现显著的正相关关系,说明Bmp2过表达明确促进成骨基因表达,使Adscs向成骨细胞分化得到增强。

图2 成骨基因的表达情况与相关性分析
2.3 Bmp2对Adscs成骨分化的影响茜素红、碱性磷酸酶染色结果如图所示(图3A),过表达Bmp2后,Adscs茜素红标记颜色显著加深,这与阳性对照诱导骨化组趋势一致,说明激活Bmp通路能促进Adscs的成骨分化(图3B)。碱性磷酸酶染色结果提示(图3C),Bmp2组有更多的硫化钴沉淀,表明激活Bmp2通路可促使Adscs向成熟的成骨细胞转化。
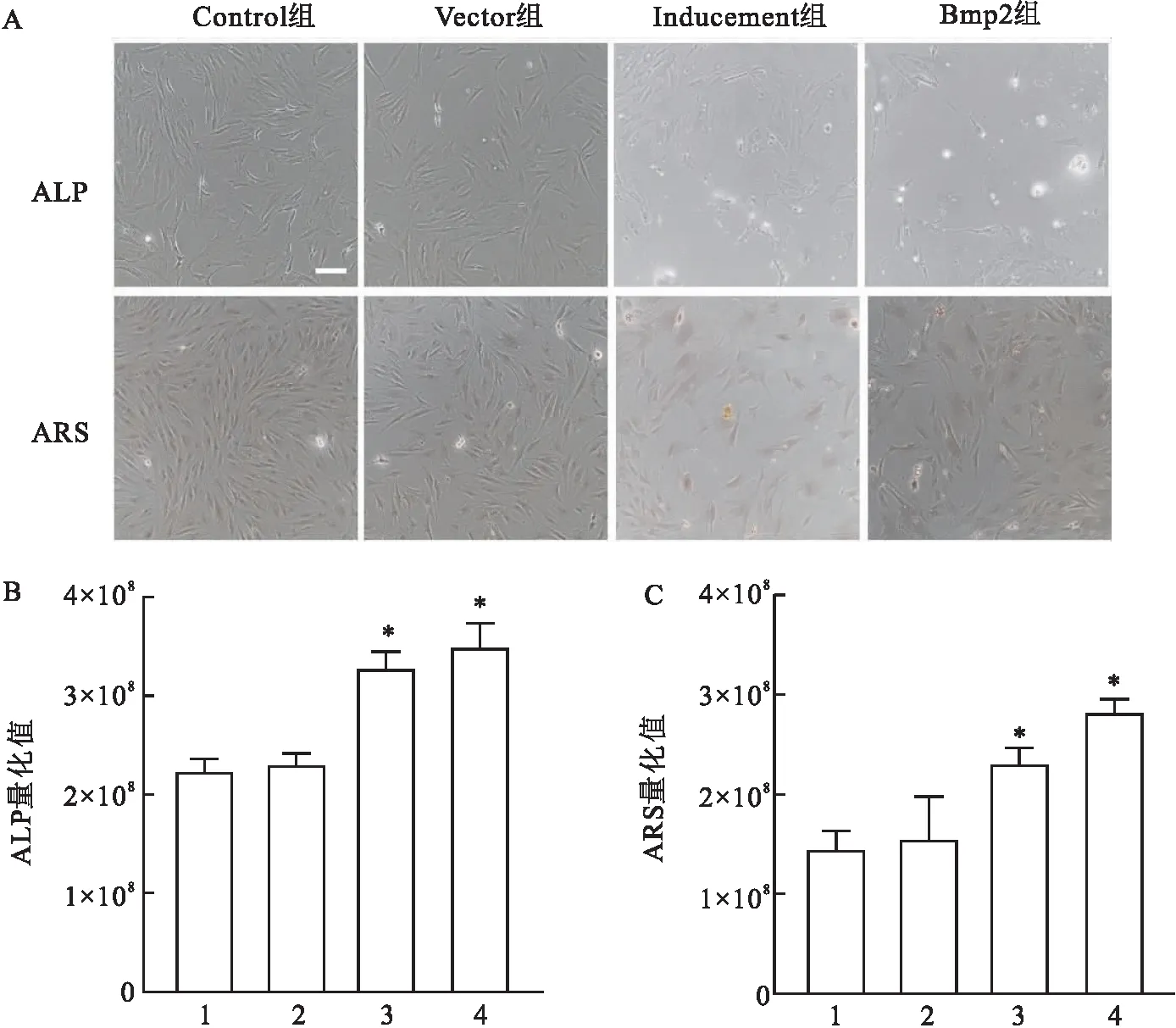
图3 ARS与ALP染色情况
2.4 Bmp2对Adscs表达Runx2及OPN的影响为了进一步验证Bmp2对Adscs成骨分化的影响,该研究使用Runx2及OPN进行荧光标记(图4A),结果显示(图4B~C),成骨基因Runx2以及OPN在过表达Bmp2的情况下荧光强度均显著升高(P<0.05)。
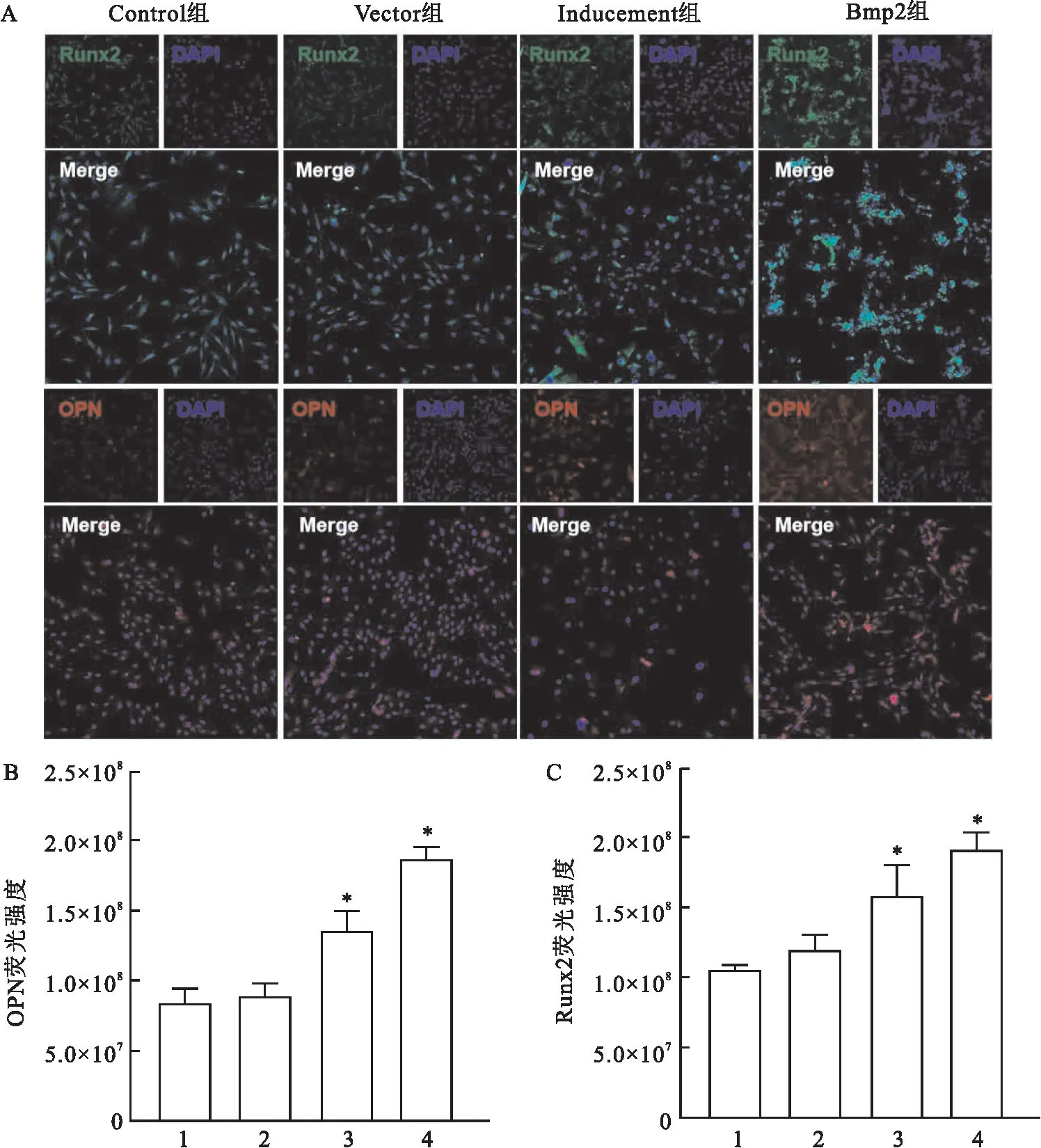
图4 Runx2与OPN荧光染色情况
3 讨论
对于骨缺损的基因疗法是指把一些成骨基因转运至靶细胞内,从而以自分泌或旁分泌的机制来促进骨形成。甚至可以多个基因一起转染,达到内源性蛋白合成的协同调控,增强生物活性[7]。因此,能在局部维持一定生物活性因子治疗浓度的基因疗法被认为是未来治疗骨缺损的可靠方法。在该研究中,为了证实Bmp2在体内所能发挥的成骨能力,将其转染至Adscs中,通过碱性磷酸酶以及茜素红染色分析显示,Bmp2转染后的Adscs在培养皿中硫化钴沉淀及钙盐沉积增多,这表明Adscs的矿化能力增强,碱性磷酸酶、OCN和OPN是成骨早期阶段的主要生物标志,而钙沉积被认为是成骨后期的标志。Sun et al[8]通过收集猪小肠黏膜下层的细胞外基质与陶瓷骨相结合作为载体,来观察移植的BMSCs的细胞增殖、细胞活力以及成骨分化能力,结果显示BMSCs中成骨基因上调,并通过激活Smad1/5/8的磷酸化来实现成骨分化,这与该研究结果一致。通过Western blot 实验显示,其下游基因Smad1/5,表达量并没有随之升高,反而P-Smad1/5表达量增高,这提示Bmp2在体内的成骨能力可能是通过磷酸化Smad1/5来实现的。该实验还检测了Bmp4、OCN、OPN、Runx2、Dlx2、BSP这6个与成骨相关的基因表达情况,并通过qRT-PCR及免疫荧光进行了验证,结果显示均有不同程度的表达上调。Chen et al[9]使用氟化物诱导Bmp2低甲基化及高表达,结果显示氟可通过Bmp2-Wnt/β-catenin通路提高OCN、Runx2、OPN的高表达,从而促进成骨细胞的增殖和分化,这与该实验结果一致。Zhu et al[10]在来源于牙根尖乳头的干细胞(stem cells from apical papilla,SCAPs)内敲除Bmp拮抗剂GREM1来检测OPN、OCN、BSP、Dlx2、Runx2、DSPP、OCX的表达情况,结果显示这些基因在第1、2、3周均有增加,说明敲除GREM1能增强SCAPs的成骨/成齿分化和干性,抑制SCAPs的增殖和衰老。GREM1对SCAPs功能的影响可能是通过调节Bmp在mRNA水平上的基因表达实现的。由于实验条件所限,未能找出更多的成骨相关基因来验证这点。但也在一定程度上表明,Bmp2在体内的成骨作用至关重要。该研究采用电穿孔来进行转染,属于瞬时转染,目前有多种供选择的基因转移载体,如质粒、脂质体、逆转录病毒、腺病毒和腺相关病毒,虽然病毒载体能够增加转染效率,使靶基因表达时间延长,但短效表达或许才是该研究需要的。Hsieh et al[11]指出,腺病毒作为载体来递送Bmp基因进入细胞内是高效的方法,但短期的Bmp2高表达,已经足以启动成骨发生的级联反应,并且Bmp的长期高表达,也会增加成骨畸形,骨刺形成等并发症。因此,在合适的时机选择不同的载体,也是该研究需要考虑的。Bai et al[12]利用薄膜涂层聚乳酸-乙醇酸(PLGA)和PLGA/氢氧化镁支架开发了有效的给药系统,使得Bmp2在需要的时候给予适当的剂量,以提高Bmp2在体内的成骨效率。
但该研究仍有一定局限,如能加入多基因进行共转染,或能较大提高Bmp2在体内的成骨潜能,Hu et al[13]使用壳聚糖质粒共转染Bmp2及FGF2进入Adscs中,通过PCR、Western blot、ELISA检测显示,共转染后,Adscs内Bmp2、FGF2 的mRNA和蛋白水平显著上调。与单独转染Bmp2或FGF2的细胞相比,共转染组的OCN和BSP mRNA水平也显著升高,说明共转染能显著促进成骨。其次,在动物实验中进行进一步研究将会对上述结果得到更多的验证,Vayas et al[14]在大鼠临界颅骨缺损模型(直径4 mm)中对Bmp2与MMP10进行研究,得出MMP10与Bmp2在成骨作用方面呈正相关,即MMP10可增强Bmp2的成骨效应,从而实现颅骨缺损修复,这提示MMP10和Bmp2的联合应用可能成为骨缺损修复和再生的一种有前途的策略。最后值得一提的是,外泌体作为近来研究的热点,相对Adscs而言或能提供更精准、高效的基因治疗能力,因其避免了移植细胞出现的存活率低、细胞流失、受体部位致瘤性等问题。Chen et al[15]用慢病毒转染Adscs后,从稳定过表达miR-375的Adscs中提取富含miR-375的外泌体,并用水凝胶将其包埋移植入大鼠颅骨缺损模型中,结果显示Exo (miR-375)表现出缓慢和受控的释放,加快了颅骨缺损的修复过程。综上所述,Adscs治疗骨缺损的前景较大,也需要投入更多的研究来为临床治疗骨缺损提供大量理论依据。

