新型低毒Au@Uio-66-NH2纳米颗粒的放疗增敏作用研究
赵正阳,李笑秋
放疗(radiotherapy,RT)是肿瘤局部治疗的重要手段,具有组织深度穿透、定位精确和可控等优点,但同时也存在对正常组织的损伤以及肿瘤的辐射抵抗等限制因素[1-2]。克服上述限制因素的常用方法是使用放疗增敏剂增加肿瘤组织的放射敏感性,降低正常组织的毒性,从而提高放疗疗效。Au纳米颗粒是常见的纳米化重金属放疗增敏剂之一[3],具备良好的肿瘤富集特性,其放疗增敏能力与自身粒径大小有关,小粒径Au纳米颗粒拥有更强的辐射沉积能力[4]。然而随着Au纳米颗粒粒径的减小,其本身的生物毒性则会变的越来越明显,使得其进一步的临床转化得到限制[5-6]。该研究通过利用Uio-66-NH2金属有机框架作为载体材料负载小粒径Au纳米颗粒(粒径为15 nm)来有效解决这一问题。
1 材料与方法
1.1 材料仪器四氯化锆(zirconium tetrachloride,ZrCl4)购自上海麦克林生化科技股份有限公司;2-氨基对苯二甲酸购自上海阿拉丁生化科技股份有限公司;N,N二甲基甲酰胺(N,N-Dimethylformamide,DMF)、冰醋酸、水合四氯金酸(Trichlorogold hydrochloride hydrate,H3AuCl4O)购自上海国药集团化学试剂有限公司;DMEM培养基、胰酶(浓度0.25%)购自美国Gibco公司;胎牛血清(FBS)购自美国Hyclone公司;CCK-8试剂购自北京兰杰柯科技有限公司;6~8周龄的雌性Balb/c小鼠购自杭州子源实验动物科技有限公司。JEM-F200透射电子显微镜(transmission electron microscopy,TEM)购自日本JEOL公司; Malvern ZS90动态光散射仪(dynamic light scattering,DLS)购自英国Malvern Instruments公司;UV-2802PC紫外可见分光光度计(Ultraviolet-visible Spectrophotometer,UV-Vis)购自美国UNICO公司。
1.2 方法
1.2.1Au@Uio-66-NH2纳米颗粒的制备 将1 ml氯金酸水溶液 (0.025 mol/L)加入到100 ml去离子水中,之后加热至100 ℃。向溶液中加入3 ml枸橼酸钠水溶液(0.034 mol/L),边加热边搅拌20 min,得到深红色的枸橼酸稳定的Au纳米颗粒。然后,将得到的溶液冷却至室温,加入10 mg硫辛酸聚乙二醇(lipoic acid-polyethylene glycol,LA-PEG),搅拌过夜。最后将其分散在1 ml DMF中。将分散在DMF中的1 ml Au纳米颗粒、27.3 mg 2-氨基对苯二甲酸以及1.2 ml冰醋酸加入到7 ml DMF中,在超声波下搅拌15 min。同时,在超声波作用下将33.4 mg四氯化锆分散在7 ml DMF中,得到均匀的分散液。然后,将上述两种溶液混合在25 ml反应釜中,加热至120 ℃并维持24 h,然后用DMF洗涤多次,最后分散在去离子水中常温保存。
1.2.2Au@Uio-66-NH2纳米颗粒表征测定 取8 μl含Au@Uio-66-NH2纳米颗粒的水溶液置于圆形铜片上,干燥过夜后使用TEM观察Au@Uio-66-NH2颗粒的形态,用GraphPad Prism V8.0软件处理图片。将Au@Uio-66-NH2纳米颗粒水溶液置于DLS仪器内,检测纳米颗粒尺寸分布以及Zeta电势,之后每隔5 d对同一批次的Au@Uio-66-NH2纳米颗粒水溶液进行粒径检测,评价纳米颗粒在水溶液中的稳定性。利用UV-Vis对Au@Uio-66-NH2纳米颗粒水溶液进行紫外光谱分析,用GraphPad Prism V8.0软件处理上述数据。分别取500 μl Au纳米颗粒及Au@Uio-66-NH2纳米颗粒溶液置于玻璃瓶中,加入5 ml硝酸,加热板300 ℃煮至液体即将蒸发完时停止反应,加入500 μl王水,并用去离子水定容至3 ml,电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)检测样品中Au的浓度。
1.2.3细胞培养 4T1小鼠乳腺癌细胞取自美国典型培养库(ATCC),培养在含1%双抗(100 U/ml青霉素和100 μg/ml链霉素)及10%胎牛血清的DMEM当中,并在37 ℃、5% CO2培养箱内进行孵育。当细胞生长至对数生长期时(密度长至培养皿80%左右),用胰酶消化细胞,用于后续传代、种板及植瘤。
1.2.4CCK-8实验评估Au@Uio-66-NH2纳米颗粒与Au纳米颗粒的生物安全性 当细胞处于对数生长期时,用胰酶消化培养皿底部细胞,离心后重悬制成细胞悬液。用细胞计数板对细胞进行计数,以5×103个/孔的密度将细胞铺入96孔板内,在37 ℃、5% CO2培养箱内孵育24 h。之后分别加入含不同Au浓度(0、25、50、75、100 μg/ml)的Au@Uio-66-NH2纳米颗粒以及Au纳米颗粒的培养基,并继续培养24 h。24 h后取出96孔板,弃去原培养基,每孔加入100 μl含有CCK-8试剂的培养基(CCK-8试剂与DMEM培养基体积比为1 ∶10),然后继续放入培养箱培养1 h,最后用酶标仪检测每组在450 nm处的吸光度,根据公式:存活率=(实验组-空白对照组)/(阴性对照组-空白对照组)×100%计算细胞存活率,并利用Excel 2013和GraphPad Prism V8.0软件对所得数据进行作图处理。
1.2.5CCK-8探究放疗后不同时间点Au@Uio-66-NH2纳米颗粒的放疗增敏作用 取对数生长期细胞,将细胞分为3组:空白对照组(不含纳米颗粒且不放疗)、单纯放疗组(不含纳米颗粒)以及纳米颗粒联合放疗组(Au@Uio-66-NH2纳米颗粒中Au浓度为50 μg/ml),以5×103个/孔的密度传至96孔板中,在培养箱内培养24 h。24 h后弃去原培养基,每组作不同处理。继续孵育4 h后给予6 Gy剂量的放射治疗,治疗后4 h更换新鲜培养基并在培养箱中继续培养。依次在放疗后24、48、72 h用CCK-8试剂检测每组的细胞存活率,同时用Excel 2013和GraphPad Prism V8.0软件对所得数据进行作图处理,对每组数据进行对比。
1.2.6克隆形成实验探究在不同放疗剂量下不同浓度Au@Uio-66-NH2纳米颗粒的放疗增敏作用 对6孔板按放疗剂量梯度(0、2、4、6 Gy)以及Au@Uio-66-NH2纳米颗粒中Au浓度梯度(25、50、100 μg/ml)进行分组,每孔种植1 000个细胞。在培养箱孵育过夜后每组作不同处理,继续孵育4 h后分别给与不同剂量的放射治疗,治疗后 4 h更换新鲜培养基,放入培养箱继续孵育。5 d后取出6孔板,弃去原培养基,1×PBS每孔清洗1遍,4%PFA固定细胞55 min,之后用1×PBS再次清洗3遍。结晶紫染色45 min,最后用1×PBS清洗5遍,拍照计数,并利用Excel 2013和GraphPad Prism V8.0软件对所得数据进行作图处理。
1.2.7构建4T1小鼠肿瘤模型 所有动物均按《实验动物饲养使用指南》的规定饲养,并符合中国科学技术大学动物保护使用委员会的要求。将悬浮于100 μl 1×PBS的5×105个4T1细胞接种于Balb/C小鼠右侧背部皮下,构建小鼠4T1荷瘤模型。
1.2.8验证体内Au@Uio-66-NH2纳米颗粒的放疗增敏作用以及生物安全性 将小鼠分为4组:空白对照组(Ⅰ组),单纯纳米颗粒组(Ⅱ组),单纯放疗组(Ⅲ组),纳米颗粒联合放疗组(Ⅳ组)(n=4)。当荷瘤小鼠皮下肿瘤长至50 mm3左右时,第Ⅱ组与第Ⅳ组小鼠尾静脉注射含Au@Uio-66-NH2纳米颗粒的等渗液(5 mg/kg)。12 h后第Ⅲ组与第Ⅳ组小鼠给与6 Gy剂量的放射治疗,之后每2天测量1次小鼠肿瘤大小以及小鼠体质量,肿瘤体积计算公式:肿瘤体积(mm3)=0.5×长度×宽度2。在放疗后第18天用颈椎脱位法处死小鼠,取出小鼠皮下肿瘤以及主要脏器。肿瘤拍照称重后与主要脏器一同用4%PFA进行固定,48 h后用石蜡包埋,之后对组织作HE染色处理,并用全景扫描显微镜观察染色结果。

2 结果
2.1 Au@Uio-66-NH2纳米颗粒的表征透射电镜图显示每个Au@Uio-66-NH2纳米颗粒的大小基本一致,粒径在100 nm左右,Au纳米颗粒被稳定的包裹在Uio-66-NH2当中,如图1A所示。DLS测得的粒径主要分布在100 nm左右,这与透射电镜观察的结果相一致,如图1B所示;测得的电势为17 mV,如图1C所示。对于Au@Uio-66-NH2纳米颗粒在水溶液中的长期粒径监测结果显示粒径基本稳定在100 nm左右,体现出该颗粒在水溶液中具有良好的稳定性,可以长期在水溶液里储存,如图1D所示。紫外光谱分析能够明显看到Au@Uio-66-NH2纳米颗粒在530 nm波长处有一处明显的波峰,为Au元素的特征峰,进一步证实了Au纳米颗粒被成功组装进Uio-66-NH2内,并具有良好的稳定性,如图1E所示。ICP-MS测量Au纳米颗粒及Au@Uio-66-NH2纳米颗粒中Au的含量分别为790.18 μg及770.43 μg。

图1 Au@Uio-66-NH2纳米颗粒相关表征图
2.2 Au@Uio-66-NH2与Au纳米颗粒毒性检测探究上述Au@Uio-66-NH2纳米颗粒与Au纳米颗粒的体外生物安全性,分别检测与不同浓度Au@Uio-66-NH2纳米颗粒以及Au纳米颗粒(0、20、50、75、100 μg/ml,以Au浓度作为标准)孵育24 h后的4T1细胞存活率,如图2所示。结果显示不同浓度Au@Uio-66-NH2组的4T1细胞存活率均未有明显下降,而同等浓度Au组的细胞存活率明显降低,并且随着浓度的增加,两者的差异逐渐增大,当浓度为100 μg/ml时,Au组的细胞存活率只有60.98%,远低于Au@Uio-66-NH2组细胞存活率85.85%(P<0.05),实验表明Au@Uio-66-NH2纳米颗粒有效缓解了Au纳米颗粒的细胞毒性作用。
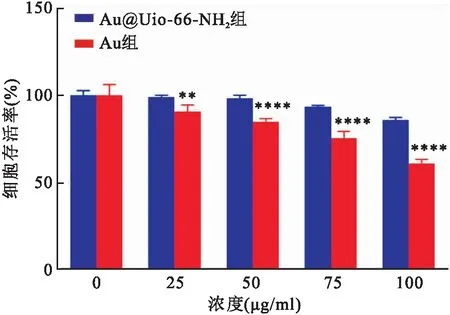
图2 不同浓度Au@Uio-66-NH2纳米颗粒与Au纳米颗粒的细胞毒性比较
2.3 CCK-8法及克隆形成实验评估Au@Uio-66-NH2纳米颗粒放疗增敏效应进一步研究Au@Uio-66-NH2纳米颗粒的放疗增敏作用,比对不同时间段各组处理后的CCK-8结果,如图3A所示,随着放疗后时间的延长,RT组与Au@Uio-66-NH2+RT组的细胞存活率在不断降低,且Au@Uio-66-NH2+RT组的治疗效果优于RT组,在放疗后72 h,Au@Uio-66-NH2+RT组细胞存活率仅有62.86%,低于RT组的细胞存活率70.33%(P=0.017 4,t=3.255),表明Au@Uio-66-NH2纳米颗粒在体外具有良好的放疗增敏效果。
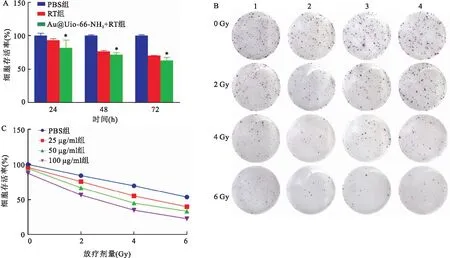
图3 体外实验验证Au@Uio-66-NH2纳米颗粒放疗增敏作用
进一步验证不同Au@Uio-66-NH2纳米颗粒浓度以及不同放疗剂量对增敏效果的影响,采用克隆形成法对比不同处理组最终的细胞集落数量,如图3B所示。从图中数据可以看出Au@Uio-66-NH2纳米颗粒的放疗增敏作用具有浓度依赖性,高浓度颗粒组的细胞集落数量明显少于低浓度颗粒组以及RT组的细胞集落数。并且随着放疗剂量的提高,Au@Uio-66-NH2纳米颗粒的增敏效果也越强,其中在6 Gy放疗剂量下,2组疗效最佳,细胞存活率仅有22.67%,故选用6 Gy作为后续体内治疗实验的放疗剂量(图3C)。
2.4 Au@Uio-66-NH2纳米颗粒体内放疗增敏效果验证通过构建小鼠乳腺癌模型,进一步探究纳米颗粒的体内放疗增敏作用,如图4所示。Au@Uio-66-NH2+RT组的小鼠肿瘤生长速度明显低于RT组,在治疗第18天纳米颗粒联合放疗组小鼠肿瘤生长抑制率为67.86%,高于RT组肿瘤生长的抑制率48.95%(F=93.70,P=0.011 6),如图4A所示。对各组小鼠的体质量进行长期监测,各组小鼠间体质量未见明显差异,再次验证Au@Uio-66-NH2纳米颗粒具有良好的生物安全性,如图4B所示。在治疗后第18天处死小鼠,取出各组小鼠的皮下肿瘤,进行拍照,如图4D所示。之后称量各组小鼠肿瘤的质量,结果显示Au@Uio-66-NH2+RT组小鼠肿瘤质量明显低于RT组(F=35.57,P=0.016 6),而Au@Uio-66-NH2组与PBS组相比肿瘤质量未见明显差异,进一步说明了Au@Uio-66-NH2纳米颗粒本身不具有明显的细胞毒性作用,如图4C所示。最后对取出的肿瘤及脏器作HE染色处理,如图4E所示,纳米颗粒联合放疗组肿瘤组织坏死区域更大,而各组小鼠之间主要脏器染色比对结果并未显示出明显差异,进一步在组织水平上证实了Au@Uio-66-NH2纳米颗粒的放疗增敏作用以及良好的生物安全性。

图4 体内实验验证Au@Uio-66-NH2纳米颗粒放疗增敏作用及生物安全性
3 讨论
放射治疗是目前主要的癌症治疗方式之一,但是由于放疗对周围正常组织的损伤以及肿瘤异质性等原因造成的辐射抵抗,限制了放疗的疗效。为了在最大限度减少正常组织暴露的同时给予肿瘤组织更多的放疗剂量,人们对放疗技术进行了不断的改进,例如近距离放射疗法、三维适形调强放疗、图像引导放射治疗以及立体定向消融放疗等。尽管上述技术的改进极大促进了放疗的疗效,但仍然存在着一些影响疗效的因素,例如肿瘤异质性,肿瘤区域血管分布的改变、代谢变化等[7]。而放疗增敏剂可以在一定程度上克服上述问题对疗效带来的负面影响,简要补充现有放疗增敏剂应用现状及局限性。纳米材料具有的优势在于,由于高渗透长滞留效应的存在,其能够在肿瘤区域高度富集,而很少聚集在正常组织当中,并且它的大小和形状易于操控,其表面还可以通过修饰赋予不同的功能从而进一步提高放疗效率。由于纳米材料这些独特的理化性质,使得其被广泛用于肿瘤的放疗增敏[8]。其中具有高Z值的重金属纳米颗粒作为主要的放疗增敏手段之一,其作用机制是由于X射线的吸收系数会因原子序数Z的改变而产生显著的变化,随着Z值的增高,X射线的吸收效率也会明显增加[9]。Au纳米颗粒作为高Z值纳米材料的一员,具有化学稳定性好、制备容易、生物相容性高等特点,在各类肿瘤当中都表现出了良好的放疗增敏效果。在对Au纳米颗粒放疗增敏效应的不断探究中显示小粒径Au纳米颗粒具有更强的放疗增敏能力,然而其生物毒性作用相对于较大粒径Au纳米颗粒也变的更加明显,不利于临床应用。
金属有机骨架是由有机配体和金属离子在配位键的驱动下自组装而成的高度结晶的多孔材料,由于其具有高比表面积,被认为是一种很有前途的新型载药材料[10]。Uio-66-NH2是一种基于锆元素的金属有机框架,由于其原料便宜,反应简单,不需要额外的表面修饰,并且具有低细胞毒性和相对较高的生物相容性等特点,在近期受到越来越多人的重视。已有多篇文献[11-12]报道了Uio-66-NH2作为药物载体在肿瘤化疗、放疗及光热治疗领域所发挥的积极作用。该研究将Uio-66-NH2作为Au纳米颗粒的载体,采用CCK-8细胞毒性检测方法表明了Au@Uio-66-NH2纳米颗粒改善了小粒径Au纳米颗粒的细胞毒性,并且在后续的体外和体内实验均表明了Au@Uio-66-NH2纳米颗粒的放疗增敏作用以及良好的生物安全性。
综上所述,该研究通过将Au纳米颗粒组装进Uio-66-NH2的多孔结构中,有效降低了Au纳米颗粒的生物学毒性,并同时保留了Au纳米颗粒的放疗增敏作用,具有良好的临床转化潜力。

