用色度传感器测定化学反应速率的实验教学
戴崇超
摘要:利用色度传感器,测定酸性高锰酸钾溶液与乙醛溶液反应过程中溶液的吸光度变化,并通过分析、比较各组实验中反应物的物质的量与物质的量浓度和溶液吸光度变化之间的关系,让学生学会选用合适的物理量表示化学反应速率,并在真实情境中掌握化学反应速率的计算。
关键词:化学反应速率;色度传感器;实验探究
文章编号:10056629(2023)06005703中图分类号:G633.8文献标识码:B
1 研究背景
在化学反应速率的教学中,已有许多数字化实验的改进和创新,让学生不仅能通过宏观实验现象,也能通过数据和图像曲线,多维度地感知化学反应的快慢、学习化学反应速率的相关概念以及影响化学反应速率的因素[1,2]。
但在定量表示化学反应快慢时,为什么一般用单位时间内反应物浓度的减少或生成物浓度的增加表示化学反应速率,而不用质量或物质的量的变化来表示化学反应速率是学生应该关注的问题;同时掌握化学反应速率的计算以及理解同一化学反应,用不同物质表示的化学反应速率之间的关系也是教学的重点、难点之一。
本文通过对实验曲线和数据的挖掘,帮助学生构建化学反应速率的概念,让学生学会选取合适的物理量表示化学反应速率;通过读取曲线中一段时间内的反应物浓度变化的数据,让学生在真实情景中掌握化学反应速率的计算,理解同一化学反应,用不同物质表示的反应速率之间的关系[3]。
2 实验设计
2.1 实验原理
使用色度传感器测定不同浓度、不同体积的酸性高锰酸钾溶液与乙醛溶液的反应,2MnO-4+5CH3CHO+6H+→2Mn2++5CH3COOH+3H2O,并測定反应过程中溶液吸光度的变化,利用朗伯比尔定律,将吸光度换算为c(MnO-4),并进行化学反应速率的计算。
2.2 实验试剂和仪器
实验仪器:色度传感器、数据采集器、比色皿、5mL针筒
实验试剂:
预先配制两组KMnO4与H2SO4的混合溶液:
第一组混合溶液中c(KMnO4)=0.01mol/L,c(H2SO4)=1.0mol/L;
第二组混合溶液中c(KMnO4)=0.015mol/L,c(H2SO4)=1.5mol/L;
两组CH3CHO溶液:
第一组c(CH3CHO)=0.1mol/L;
第二组c(CH3CHO)=0.15mol/L
2.3 实验过程
2MnO-4+5CH3CHO+6H+→2Mn2++5CH3COOH+3H2O,反应过程中,溶液紫色逐渐变浅,利用色度传感器,测定反应过程中溶液吸光度数据的变化,进行三组实验。
实验一:0.01mol/L KMnO4和1.0mol/L H2SO4的混合溶液1.0mL与0.1mol/L乙醛溶液1.0mL
实验二:0.01mol/L KMnO4和1.0mol/L H2SO4的混合溶液1.5mL与0.1mol/L乙醛溶液1.5mL
实验三:0.015mol/L KMnO4和1.5mol/L H2SO4的混合溶液1.0mL与0.15mol/L乙醛溶液1.0mL
实验时,先向比色皿中加入乙醛溶液,之后点开数据采集器,在经过相同时间后,加入预先配制的KMnO4与H2SO4的混合溶液,分别进行三组实验,并通过色度传感器测定溶液吸光度的变化,在移除由于实验操作和溶液混合过程
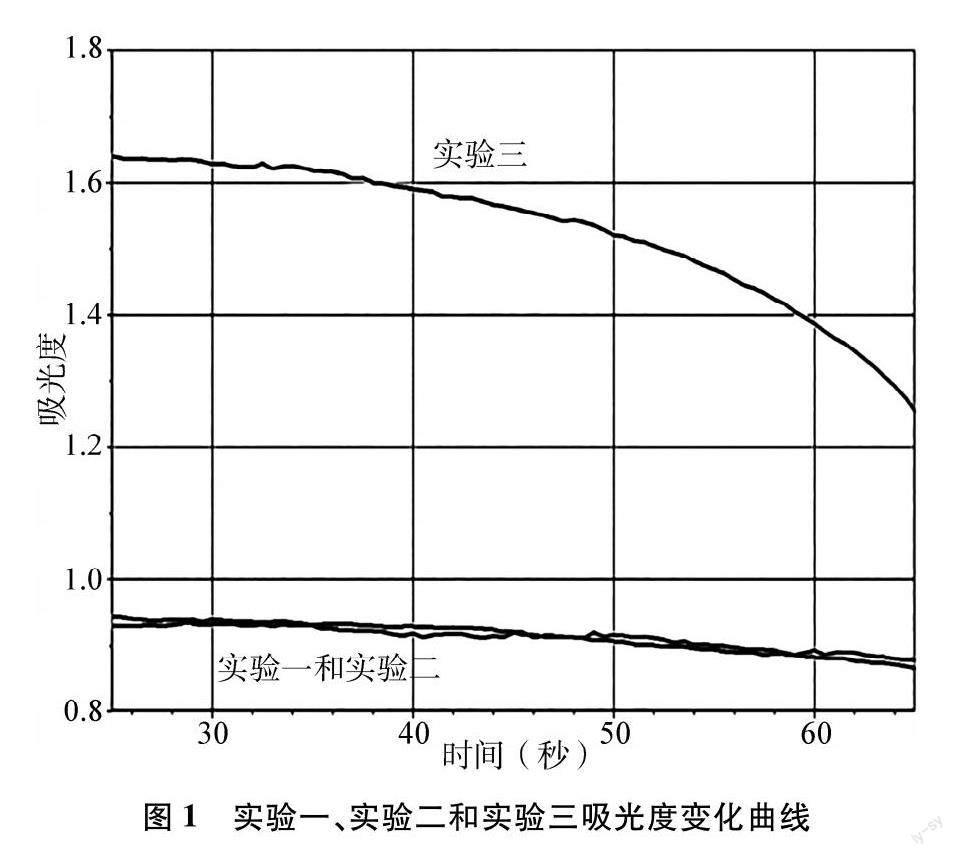
中造成的吸光度数据扰动后,将三条曲线呈现于同一张图,得图1。
2.4 实验设计方案说明
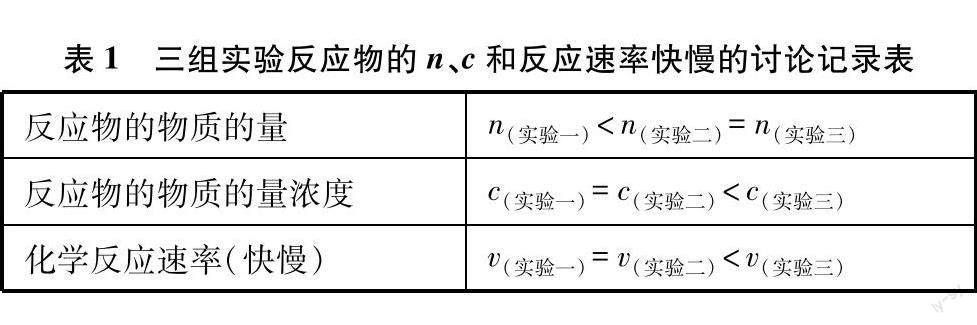
(1) 实验一和实验二为对照组,两组实验c反应物相同,而n反应物不同。
(2) 实验二和实验三为对照组,两组实验n反应物相同,而c反应物不同。
(3) 三组实验混合后溶液总体积分别为2.0mL和3.0mL,因为如果取用的溶液体积过大,会导致溶液在注入比色皿的过程中无法充分混合;量取溶液体积过小,也会导致量取的相对误差偏大。由于针筒每次量取体积时会存在少量的偏差,所以预先将高锰酸钾和硫酸溶液混合,这样每组实验只要取用两次溶液即可,既能减少课堂演示时的误差,也能缩短课堂演示的时间,同时也能让实验一和实验二的曲线吻合度更高,避免对学生学习造成过大的干扰。
3 实验结果分析,数字化实验素材的挖掘及其在教学过程中的应用
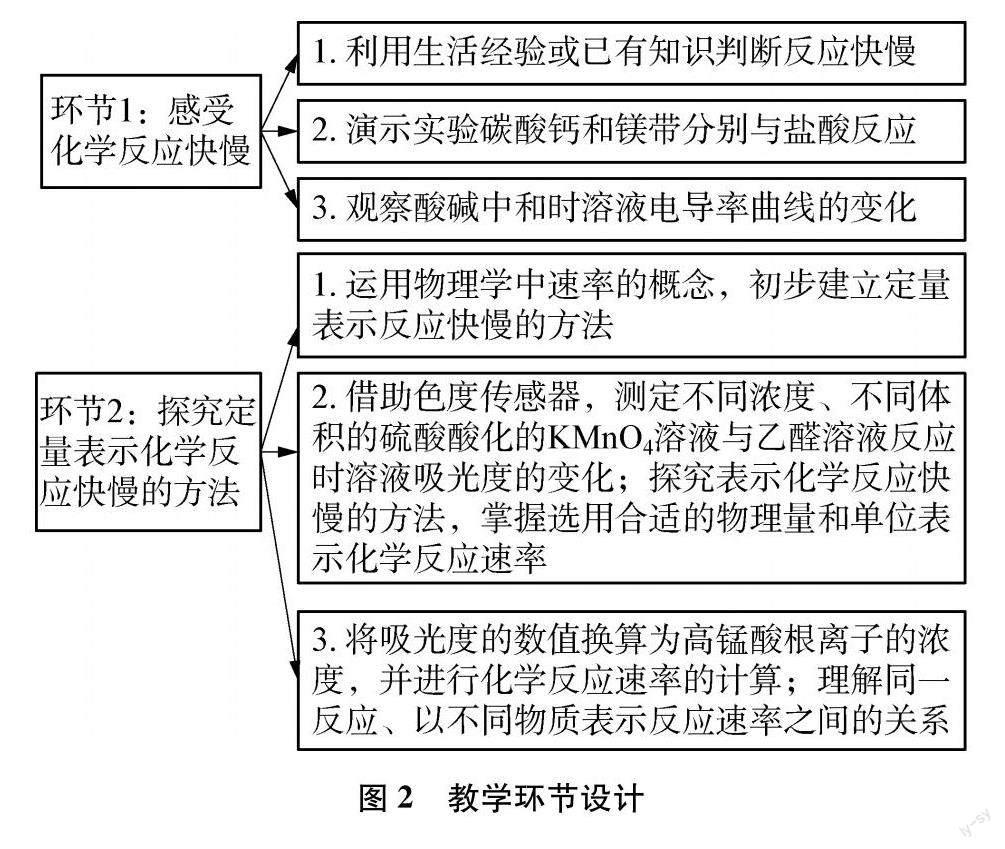
图2是笔者在课堂实践过程中设计的教学环节,上述数字化实验可以贯穿运用于课堂环节2的教学过程。
以下是数字化实验在教学过程中的具体应用。
3.1 使学生学会选择哪种物理量的变化来表示化学反应速率
实验得到的三条曲线,分别对应三组实验。
实验一与实验二:反应物的浓度c(实验一)=c(实验二);而反应物的物质的量n(实验一):n(实验二)=1∶1.5,学生通过观察发现,反应过程中溶液吸光度变化基本相同,说明两组实验反应速率几乎相同,即v(实验一)=v(实验二)。
实验二与实验三:反应物的浓度c(实验二)∶c(实验三)=1∶1.5;而反应物的物质的量n(实验二)=n(实验三),测定发现实验三溶液吸光度起始点比较高,这是因为实验三c(MnO-4)起始浓度较大,同时反应过程中实验三溶液吸光度下降趋势比较快,说明c(MnO-4)减小速率比实验二快,说明实验三化学反应速率较快,v(实验二)
由于课堂中学生需要分析的实验数据较多,对学习可能会造成一定的困扰,可在学生讨论后以表格的形式逐一呈现学生课堂讨论的结果,帮助学生更清晰地理解和分析(如表1所示)。
学生通过分析上述三组实验反应物的物质的量和物质的量浓度以及溶液吸光度曲线的变化关系后,很清晰地分析出选择物质的量浓度的变化来表示反应速率能够更为准确地反映出化学反应的实际快慢,所以人们一般用反应物或生成物单位时间内物质的量浓度的变化来表示化学反应速率。
3.2 让学生在真实情境中掌握化学反应速率的计算,理解以不同物质表示同一化学反应速率之间的关系
选取实验三,通过朗伯比尔定律,将溶液的吸光度数值换算为c(MnO-4)后,利用logger-pro软件的检查功能,教师选取曲线中合适的两点数据(如图3),学生将读取的结果记录于学习任务单(如表2)中以后,并计算这段时间内v(MnO-4);再利用化學方程式中化学计量比关系,计算这段时间内△c(H+)和△c(CH3COOH),进一步求算v(H+)和v(CH3COOH)。在掌握化学反应速率计算的同时,理解同一化学反应,用不同物质表示的反应速率之间的关系[4,5]。
3.3 帮助学生理解瞬时反应速率和平均反应速率的区别
依然选取实验三,曲线的横坐标是时间,纵坐标是c(MnO-4),可以运用logger-pro软件的求切线斜率的功能,对曲线求切线斜率,斜率的数值取正值即为该点时间的v(MnO-4)瞬时反应速率(图4),通过展示曲线中30~50s(即计算平均化学反应速率时所取的时间段)内不同点切线斜率的数值,让学生理解瞬间反应速率和平均反应速率的区别。
4 结语
在化学反应速率的学习过程中,学生不太关注为什么一般用反应物或生成物物质的量浓度的变化而不用物质的量或质量等其他物理量的变化表示化学反应速率。利用数字化传感器通过分析不同浓度和不同物质的量的硫酸与高锰酸钾和乙醛溶液的化学反应,让学生理解选用物质的量浓度来表示反应速率的合理性,同时利用朗伯比尔定律,将传统实验中溶液颜色与微粒的浓度联系在一起,让学生在真实情境中掌握化学反应速率的计算。通过对数字化实验所呈现的数据曲线进一步挖掘,既丰富了数字化实验的教学功能,也使其在课堂中发挥了更好的教学效果。
参考文献:
[1]马善恒,王后雄. 国内数字化实验的研究现状及发展趋势——基于CiteSpace的可视化分析[J]. 化学教学,2021,(3): 19~23.
[2]王晓芳,鹿钰锋,夏建华. 手持技术数字化实验在我国近20年的研究进展及现状——基于CiteSpace可视化分析化学教学[J]. 化学教学,2021,(4): 32~34.
[3]余亮,曹钰. 运用数字化实验培养初中生的图象分析能力——以“探究化学反应速率的影响因素”为例[J]. 实验教学与仪器,2021,38(11): 15~17.
[4]陆晨刚.DIS技术测定化学反应速率常数的深入探究[J]. 化学教学,2018,(5): 71~73.
[5]吴有萍,马娟娟,余新红. 数字化实验在探究化学反应速率影响因素中的应用[J]. 中国现代教育装备,2022,(24): 33~35.

