小鼠伊文思蓝尾静脉或腹腔注射及视网膜铺片技术的优化
邢春涛,余 琦,张璐莎,李 珏,3,关 华,王 乐,李 蓉,4
0 引言
在眼科研究中,小鼠模型是广泛应用的实验动物之一,常用于研究各种眼部疾病的发病机制以及新型治疗方法的筛选[1-3]。然而,由于小鼠眼球较小,活体实验很难对其进行视网膜血管观察,因此需要使用其他技术来观察小鼠视网膜血管的变化。常见的小鼠视网膜血管观察技术包括荧光素标记[4-5]、光学相干断层扫描血管造影[6-7]、荧光素血管造影[8-9]等方法,静脉伊文思蓝推注联合视网膜铺片是研究视网膜血管性疾病的常用技术方法[10-11]。该方法可以清楚地观察到视网膜血管的走形、分布及渗漏情况[12-13],还能够对无灌注区的视网膜面积进行估算[14-15],且具有成本低、易操作、高灵敏度等特点。但在视网膜铺片染色过程中,由于伊文思蓝注射后在体内循环时间、小鼠眼球在4%多聚甲醛固定液中的固定时间、视网膜铺片所用的时间等存在差异,加之使用的封片剂种类不同等技术问题,均会对实验结果的分析比较产生影响。因此,为了获得更好的实验结果,本实验中我们对上述问题进行了比较分析,并总结了视网膜铺片染色的实验技巧,优化了实验方案,以期为视网膜血管性疾病的相关研究提供更为准确、可靠的实验技术支持。
1 材料和方法
1.1 材料C57BL/6雄性17周龄小鼠30只,购自西安交通大学实验动物中心。所有动物实验部分均由陕西省缺血性心血管疾病重点实验室伦理委员会审核并批准(SQXZDSYS202201)。1%伊文思蓝溶液:0.3g伊文思蓝(Evans blue,美国Sigma公司)溶于30mL生理盐水中,震荡溶解,过滤,4℃低温避光保存,使用前取适量,且需水浴预热至37℃备用。4%组织固定液(陕西中晖赫彩生物医药公司),抗荧光淬灭剂(索莱宝生物科技有限公司),体视显微镜(SZ2-ILST,日本OLYMPUS公司),倒置荧光显微镜(IXT3,日本OLYMPUS公司),小鼠尾注静脉显像仪(ZH-XQ,原阳振华教学仪器公司),15°眼科手术穿刺刀(南京易乐医疗器械有限公司),显微弹簧剪、显微有齿镊(瑞沃德生命科技有限公司)等。
1.2 方法
1.2.1 尾静脉注射将小鼠置于自制小鼠固定器中,肉眼找到小鼠相对较粗的尾静脉,再用小鼠尾注静脉显像仪找到该静脉粗细均匀的部位,用1mL注射器(斜面朝上)与尾部呈15°角穿刺进针,当注射器斜面基本完全没入尾部,将注射器尾部下压,尽量使其与鼠尾平行,同时向前行针,此时会有明显的无阻力感[16]。当针进入血管约1/4~1/3时,推注1%伊文思蓝溶液0.3mL,注射后立即可见小鼠通体变为蓝色,尤其是口唇、耳、爪等裸露部位,表明该操作成功。分别于10min(26眼)、20min(6眼)后处死小鼠[17-18]。当鼠尾静脉注射失败时,给予小鼠腹腔注射1%伊文思蓝溶液0.3mL,分别在腹腔注射后1、2、3h观察小鼠体表颜色,发现在3h小鼠体表颜色与静脉注射10min最接近,因此,当尾静脉注射失败时,可以给予小鼠1%伊文思蓝溶液0.3mL腹腔注射后循环3h的补救方法(8眼),见图1。
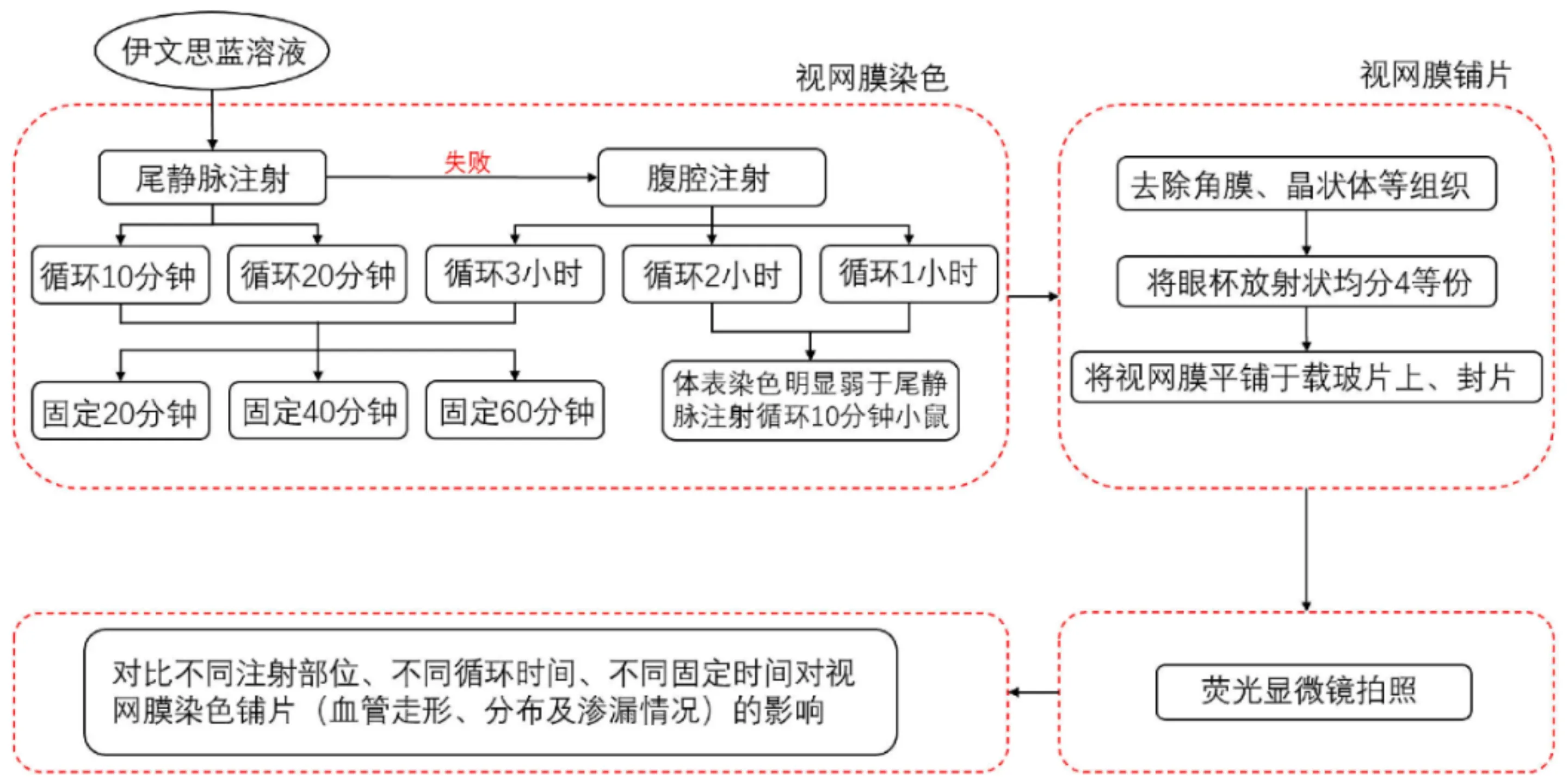
图1 实验流程图。
1.2.2 视网膜铺片小鼠处死后立即摘取双侧眼球,去除眼球后部肌肉及结缔组织等眼球附属组织,置于4%多聚甲醛固定液中进行固定,分别固定20min(10眼)、40min(10眼)、60min(20眼)后,在体视显微镜下用15°眼科手术穿刺刀在角巩膜缘处做穿刺口(图2A),用显微弹簧剪从穿刺口沿角巩膜缘剪开(图2B),去除角膜、虹膜、晶状体、玻璃体,将眼杯以视神经为中心,放射状均匀剪开,分为4部分(图2C),巩膜面朝上置于载玻片上,剪去视神经及巩膜与视神经移形处,使视网膜与葡萄膜完全脱离,去除巩膜、葡萄膜及视网膜上残留的色素组织,将视网膜平铺于载玻片上,滴1~2滴抗荧光淬灭剂,立即盖上盖玻片,置于倒置荧光显微镜下,通过绿色荧光进行拍照。
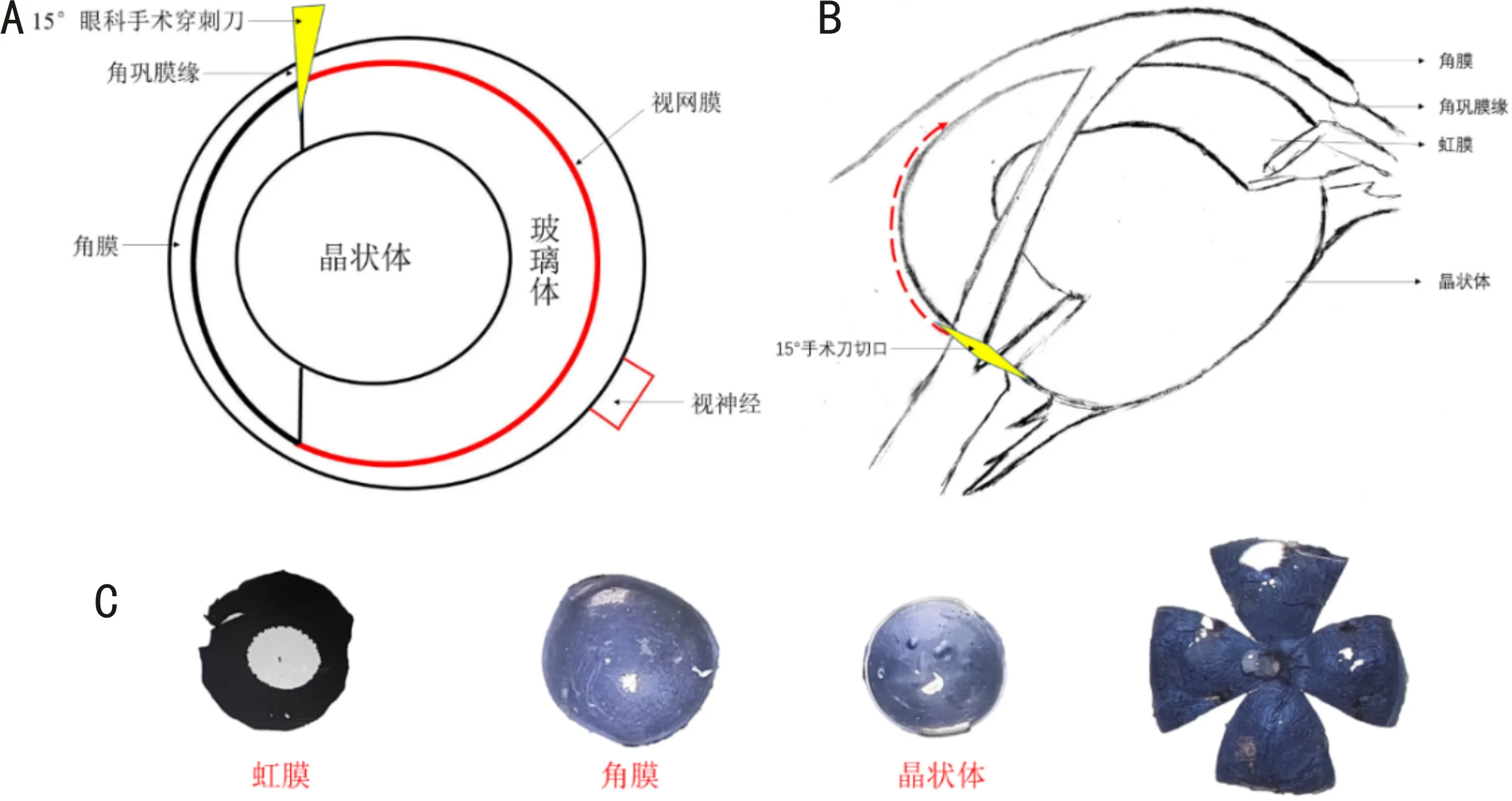
图2 视网膜剥离过程示意图 A:在体视显微镜下用15°眼科手术穿刺刀在角巩膜缘处做穿刺口;B:用显微弹簧剪从穿刺口沿角巩膜缘剪开;C:剥离的眼组织。
1.2.3 渗漏点计数使用Image J软件计数每高倍视野下(HPF)视网膜荧光渗漏,其中片状渗漏仅记录1次。
2 结果
2.1 尾静脉注射与腹腔注射对比当鼠尾静脉注射伊文思蓝溶液成功后,可见小鼠口唇爪等皮肤裸露部位即刻明显变蓝,此为伊文思蓝注射成功的标志。当鼠尾静脉注射失败时,给予小鼠1%伊文思蓝溶液0.3mL腹腔注射循环3h后,小鼠的外观颜色对比无明显区别(图3),且运用此两种伊文思蓝注射方法制作的视网膜铺片,在荧光显微镜下观察可见血管走形及显影清晰程度无明显区别(图4)。
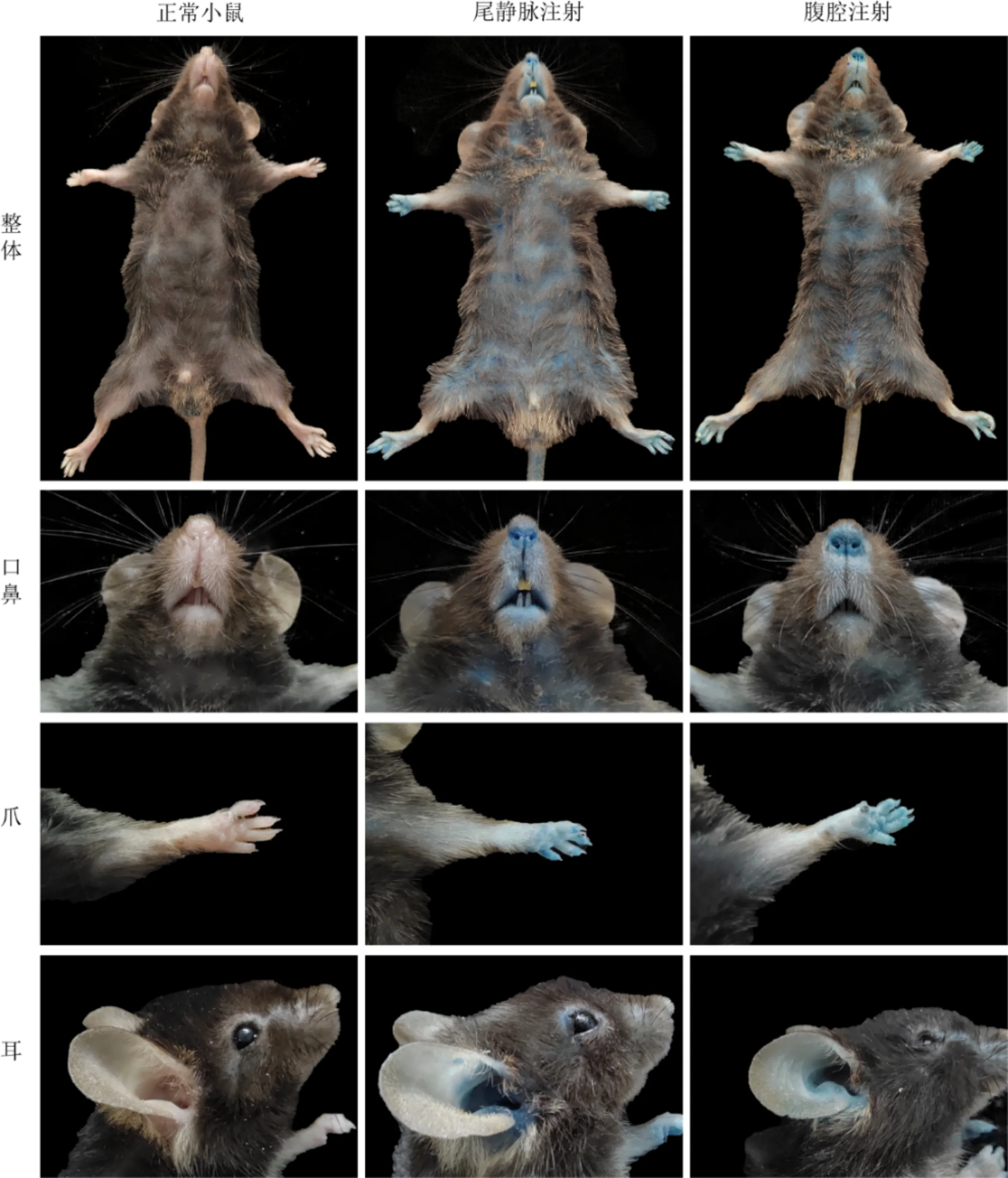
图3 正常小鼠、伊文思蓝尾静脉注射、伊文思蓝腹腔注射三者体表颜色对比 尾静脉注射及腹腔注射伊文思蓝后小鼠口鼻、爪、耳变蓝,且两者外观无明显区别。

图4 伊文思蓝尾静脉注射与腹腔注射两者视网膜成像对比 血管走形及显影清晰程度无明显区别。A、B:500μm;C、D:200μm。
2.2 伊文思蓝体内循环时间的影响当尾静脉注射伊文思蓝成功后,体内循环10min与20min相比,循环10min取材时,视网膜荧光拍照:血管外组织无荧光着色,血管与周围组织荧光对比明显,血管形态、走形清晰(图5A、D)。循环20min取材时,视网膜荧光拍照:血管外组织明显着色,血管与周围组织荧光对比不强烈,血管形态、走形欠清晰(图5B、E)。若尾静脉注射伊文思蓝失败后,要立即进行腹腔注射进行补救,若尾静脉注射失败后与腹腔注射间隔时间过长或过夜,视网膜组织会出现过染(图5C、F)。
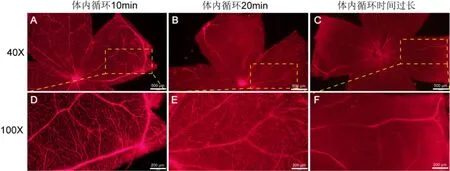
图5 伊文思蓝体内循环时间的影响 A:血管外组织无荧光着色,血管与周围组织荧光对比清晰;B:血管外组织明显着色,血管与周围组织荧光对比不明显;C:背景荧光过强,仅能看到大血管走形;D:血管形态、走形清晰;E:血管形态模糊,走形观察不清晰;F:背景荧光过强,血管网形态模糊,血管与周围组织无法形成对比。
2.3 组织固定时间的影响4%多聚甲醛固定小鼠眼球20、40、60min对比,固定60min[19]时小鼠视网膜与葡萄膜脱离更加完全,可以减少因不完全脱离进行操作造成的视网膜损伤。固定20min时,荧光显微镜下可见视网膜血管形态模糊不清,荧光渗漏明显(图6A);高倍镜下可见,血管走形不连续,背景荧光不均匀,无法形成很好的观察(图6D)。固定40min时,低倍镜下可见视网膜血管形态明显清晰,虽仍存在荧光渗漏,但明显减少(图6B);高倍镜下可见血管走形清晰、连续,背景荧光偶见不均匀(图6E)。固定60min时,低倍镜下可见视网膜血管形态十分清晰(图6C);高倍镜下可见血管走形清晰连续,背景荧光均匀,偶见荧光渗漏,可以清晰明确地进行观察(图6F),组织固定20min进行操作时,视网膜出现荧光渗漏个数明显高于固定40、60min(图7)。
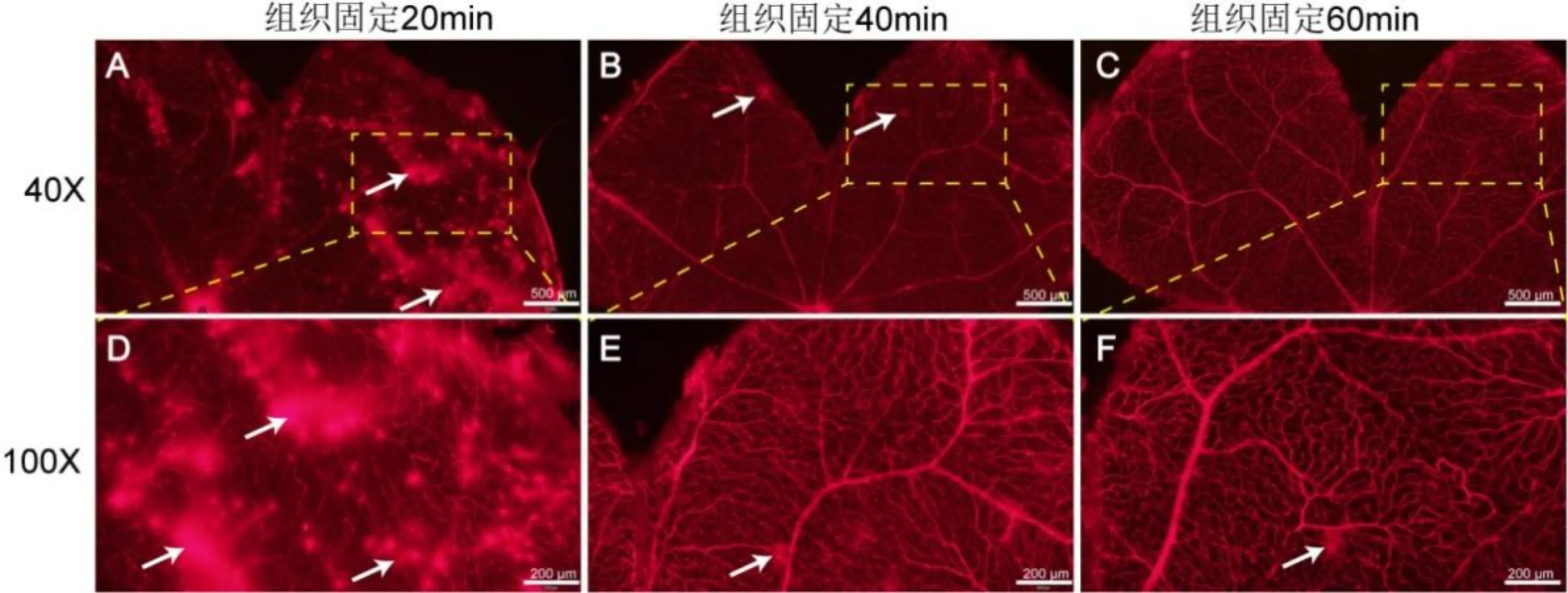
图6 组织固定时间的影响 A:血管走形模糊不清,荧光渗漏明显;B:血管走形可以观察,仍存在少量荧光渗漏;C:血管走形清晰,无荧光遮挡;D:血管形态模糊,背景荧光形成遮挡;E:血管形态较为清晰、连续,背景荧光偶见遮挡;F:血管形态清晰连续,背景荧光均匀。白箭头示荧光渗漏。

图7 组织固定20、40、60min视网膜荧光渗漏的差异 bP<0.01 vs组织固定20min。
3 讨论
视网膜石蜡切片HE染色及视网膜铺片是研究视网膜血管性疾病的常用技术方法[10,20]。伊文思蓝注射联合视网膜铺片是研究视网膜血管形态和血管渗漏的常用方法[21-22],该方法能够清晰显示视网膜内整体的血管走形、形态及渗漏情况。通过查阅文献发现小鼠体内伊文思蓝溶液不同的注入方式、不同的体内循环时间,以及不同的组织固定时间均可影响视网膜铺片染色实验的准确性和可重复性,不利于研究者进行实验。故本研究对当前伊文思蓝注射联合视网膜铺片技术进行了系统地归纳总结以及优化。我们采用尾静脉注射的方式注入小鼠体内1%伊文思蓝溶液0.3mL,与之前文献报道的心脏灌注法、上腔静脉穿刺灌注法相比优势在于以下3个方面:(1)小鼠不需要进行麻醉,绝对避免了因麻醉造成的意外事件[23-24]。(2)尾静脉注射与心脏灌注及上腔静脉灌注相比,小鼠尾静脉注射不需要打开小鼠胸腔或者颈部皮肤,直接通过尾静脉进行注射,明显减少操作时间,操作更加简便。(3)若尾静脉注射失败,可以通过立即进行腹腔注射来补救实验。通过分析本实验结果发现,腹腔注射方法虽然简单易操作,但是需要体内循环3h才能与尾静脉注射体内循环10min体表染色程度相近,其时间成本过高,大大延长实验时间。文献显示通过上腔静脉推注2%伊文思蓝,体内循环5min[10],视网膜血管形态清晰。由于伊文思蓝有一定毒性以及参考伊文思蓝使用说明,本实验通过尾静脉注射1%伊文思蓝溶液观察视网膜血管形态,结果显示1%伊文思蓝溶液体内循环10min时,视网膜血管形态清晰,视网膜血管外组织无荧光着色,血管与周围组织对比更加明显。由于组织固定时间[25]及环境温度[26]均可影响眼球固定效果,通过查阅文献我们分别观察了眼球固定20、40、60min对实验结果的影响,对比发现,室温16℃条件下,眼球固定20min时,视网膜与葡萄膜黏连较为紧密,在剥离时会对视网膜组织造成较大面积的损伤,严重影响实验结果;固定40min时,视网膜与葡萄膜存在少量黏连,且黏连紧密程度明显降低,剥离黏连处时仍存在损伤视网膜的风险;固定60min时,视网膜近乎完全脱离,减少因视网膜与葡萄膜黏连紧密,剥离视网膜组织造成的组织损伤。本研究为清晰地观察视网膜血管形态和血管渗漏提供了一种简便的、稳定的、重复性高的操作技术。
将实验中的技巧与心得进行总结与分析:(1)尾静脉注射1%伊文思蓝0.3mL成功后,要严格把控10min的循环时间,及时处死小鼠进行眼球固定,循环时间过长,会出现血管周边组织着色。(2)尾静脉注射伊文思蓝失败后,立即进行腹腔注射进行补救,腹腔注射1%伊文思蓝0.3mL循环3h与尾静脉注射1%伊文思蓝0.3mL循环10min相比,体表染色程度相近且荧光显微镜下视网膜血管形态、走形、血管周边组织着色情况大致相同。如若尾静脉注射失败后间隔较长时间再进行腹腔注射,视网膜组织会出现过染,将无法对视网膜血管进行观察。(3)眼球在进行4%多聚甲醛固定前,要先剪除眼外肌及筋膜等组织,充分暴露眼球外壁,确保眼球可以充分固定。小鼠眼球固定时,在室温16℃情况下,以50~60min为宜,此时视网膜与葡萄膜基本完全脱离,可以有效避免实验者手动脱离对于视网膜造成的损伤。室温不同,固定的时间应当适当延长或缩短。(4)眼杯制作成功后,要观察切缘是否残存视网膜移形部位,因移形部位是视网膜与葡萄膜结合紧密部位,因此在最大程度保存视网膜组织的同时,尽量将视网膜移形部位剪除干净,避免在铺片过程中牵扯视网膜组织。(5)视神经处同样是视网膜与周围组织黏连紧密处,此处尽量将视神经平齐视网膜剪除,降低视网膜黏连程度,同时保证视网膜组织及视盘的完整性。(6)将眼杯以视盘为中心,放射状剪开4处,剪开深度以眼杯边缘至视盘总长的2/3为宜,过于接近视盘,操作时容易造成视网膜组织撕裂损伤,剪开过于接近眼杯边缘,容易造成视网膜边缘卷曲,不易展片。(7)切忌先将视网膜剥离,再转移至载玻片上进行铺片。单纯视网膜很难在载玻片上展片成功,且在转移过程中极易损伤视网膜组织。应将整个眼杯转移至载玻片上进行展片。(8)将剪好的眼杯在载玻片上进行展片时,应将视网膜面朝下,滴1~2滴无菌PBS溶液或生理盐水可防止视网膜组织干裂,同时有助于展片的顺利进行。(9)封片前用吸水纸吸取多余水分,滴1~2滴抗荧光淬灭剂,立即盖上盖玻片并进行荧光显微镜下拍照,时间过长视网膜组织会发生固缩。
小鼠伊文思蓝静脉推注联合视网膜铺片技术是一种用于研究小鼠视网膜血管结构和功能的方法[27-28]。该方法的优点包括可以同时观察视网膜血管的形态及渗漏情况,并且能够研究视网膜血管性疾病相关病理变化和发展动态。另外,和其他检测方法相比,静脉推注技术不需要特殊设备和操作技能,其操作简单,成本低廉[29-30]。

