兰花花器官及成花基因调控研究进展
史梅容 舒文波 邱明萱 李林宴,,孙振元* 巨关升 李振坚
(1.中国林业科学研究院 林业研究所/国家林业局林木培育重点实验室,北京 100091;2.华中农业大学 园艺林学学院/园艺植物生物学教育部重点实验室,武汉 430070)
兰花是兰科(Orchidaceae)植物的总称,有5个亚科(杓兰亚科(Subfam.Cypripedioideae)、拟兰亚科(Subfam.Apostasioideae)、树兰亚科(Subfam.Epidendroideae)、香荚兰亚科(Subfam.Vanilloideae)和兰亚科(Subfam.Orchidoideae))、800多个属和28 000多个种,具有地生、腐生和附生3种生活型,是植物最大的开花家族之一,位列中国十大名花之一[1]。其中,兰属(CymbidiumSw.)、蝴蝶兰属(PhalaenopsisBlume)、文心兰属(Oncidiumhybridum)、卡特兰属(CattleyaLindl)、兜兰属(PaphiopedilumPfitz)、万代兰属(Vandacoerulescens)和石斛兰属(Dendrobium)已成为7 大商品化兰花[2]。目前,兰花商品化应用的主要瓶颈是花器官的形成和花期的调控。所以,对兰花花器官调控和开花过程进行研究,对兰花产业的发展尤为重要。兰花花器官有其独特性,而开花过程可分为成花和花发育2个阶段,每个阶段都由相应的基因调控[3]。虽然分子遗传方法已使人们对模式植物(如拟南芥(Arabidopsisthaliana)和水稻(OryzasativaL.))中的花器官形成以及成花机制有所了解[4],但目前对兰花成花的整体认识仍不甚透彻。本研究重点研究了兰花花器官调控以及成花的分子调控机制,并解析了兰花成花转录组、基因组和已功能验证的相关基因,以期为兰花开花研究提供重要的基础信息,开辟新的研究策略和途径。
1 兰花花器官调控的分子机制
1.1 兰花花器官特征
与其他开花植物相比,单子叶兰花进化出了壮观的花形态特征,以适应其特殊的授粉和适应性繁殖策略[1]。长期进化中,兰科植物形成了独有的花被结构:由3个萼片(Sepal)、2个花瓣(Petal)、1个由花瓣特化成的唇瓣(Lip)以及合蕊柱(Gynostemium)组成(图1(a))[1]。成花是植物的重要特征之一,其表达模式可以分为ABC或ABCDE模型,ABCDE 模型解释了五类花同源异型基因的相互作用,以确定每个花器官的特性(图1(b))[1]。兰花与其他植物在ABCDE表达模式的基因相似,A和E类基因一起决定萼片,A、B和E类基因决定花瓣,B、C和E类基因共同决定雄蕊,而D和E类基因决定心皮[1,5]。

(a)兰花花结构侧视图(左)与俯视图(右)的比较。(b)拟南芥花发育的ABCDE模型。AP1,无瓣花1;AP2,无瓣花2;AP3,无瓣花3;PI,雌蕊;AG,无性生殖;STK,种子储备;SEP,SEPALLATA。(a) Comparison of side views (left) and top views (right) of the floral structures of orchid.(b) The ABCDE model of flower development in Arabidopsis.AP1,APETALA1;AP2,APETALA2;AP3,APETALA3;PI,PISTILLATA;AG,AGAMOUS;STK,SEEDSTICK;SEP,SEPALLATA.
1.2 兰花花器官调控
对兰花中高度特化的花结构进行研究,不仅揭示了参与花发育的基因,还揭示了ABCDE模型调控的复杂性[1]。ABCDE基因属于MADS-box转录因子家族的MIKCC基因,兰花植物的成花是由MADS-box型转录因子介导。目前,已在拟南芥花同源异型基因和其他物种的同源物中分离到各种兰花(如兰花属、石斛属、文心兰属和蝴蝶兰属)的MIKCC基因,一些功能亦得到了验证[4]。
1.2.1A和E类基因
A和E类基因属于AP1/AGL9超家族[6]。A功能基因来自SQUA-like亚群,可分为FUL/AGL8-like和euAP1-like演化支。E功能基因来自包含AGL9-like和AGL2/3/4-like clades的SEP-like亚群。AGL6是SQUA-like和SEP-like亚群间的AP1/AGL9群[4]。研究发现,蝴蝶兰玫瑰(PhalaenopsisFormosaRose)的ORAP11和ORAP13基因在花芽早期高度表达[7],且过表达DOAP1的转基因梳唇石斛(DendrobiumChaoPrayaSmile),表现出开花早、花序分生组织过早转变为花分生组织[1];但台湾蝴蝶兰(Phal.aphrodite)的PaAP1-1和PaAP1-2基因则在雌蕊和花粉发育中发挥作用,而PaAGL6-1基因在唇瓣表达,PaAGL6-2在所有花器官中表达[8]。蝴蝶兰杂种Athens的PhaMADS1和PhaMADS2基因在授粉前的子房中高表达,而PhaMADS4、PhaMADS5和PhaMADS7皆在萼片、花瓣和唇瓣中表达[9];但石斛兰(D.MadameTong-In)中的DOMADS2仅在花发育后期的花柱上表达;文心兰(OncidiumGower Ramsey)OMADS6、OMADS7和OMADS11基因在除雄蕊外的所有花器宫中均有表达[6],过表达OMADS6产生心皮状萼片和雄蕊状花瓣[1];黄花文心兰的AP1同源基因OMADS10在成熟花的唇瓣和心皮中表达,但过表达文心兰OMADS1基因导致花期提前[10];木石斛(D.crumenatumSw)的DcOAP2基因在所有花器官中都有表达[11];小扇叶兰(Erycinapusilla)的AP1-like基因EpMADS10、EpMADS11和EpMADS12在所有花器官中皆弱表达[4]。另外,小兰屿蝴蝶兰的PeSEP基因在所有花器官中都有表达[12],但石斛兰(D.MadameTong-In)中DOMADS1和DOMADS3基因以及鸽石斛(D.crumenatum)中的DcOSEP1基因在花转变过程中不断被激活,并持续到成熟的花阶段[13],且沉默蝴蝶兰PeSEP3导致花被片转化为叶状组织[1]。
1.2.2B类基因
兰花B类基因包含DEFICIENS(DEF)/APETALA3(AP3)-like和GLOBOSA(GLO)/PISTILLATA(PI)-like基因,且所有花器官都可检测到B类基因[1]。对兰科植物的B类基因进行调查,发现11个物种具有4个AP3和2个PI同源基因[14]。台湾蝴蝶兰的PaAP3-1、PaAP3-2、PaAP3-3和PaAP3-4基因在萼片、花瓣和唇瓣/柱中表达[8];石斛的DcOAP3A和DcOPI基因在所有花器官中积累[13];意大利兰(Orchisitalica)的OrcPI和OrcPI2基因在未成熟花芽的所有花器官中均表达,而狐尾兰(Rhynchostylisgigantea)中的RgPI在所有花器官表达[15];蝴蝶兰杂种PhPI10基因仅在唇瓣表达[16];小兰屿蝴蝶兰(Phal.equestris)的PeMADS4基因决定蝴蝶兰的唇形[17];文心兰的OMADS5基因负向调控唇瓣结构[18];而春兰(Cymbidiumgoeringii)花被的形成是通过A、B和E类基因的共表达[19]。
1.2.3C和D类基因
C和D类基因是由被子植物基因复制和多样化事件产生的[1]。C和D类基因都属于MADS-box基因的AG亚家族,在ABCDE模型中,C类基因对于雄蕊和心皮的发育非常重要,而D类基因则是胚珠发育所必需[4]。小兰屿蝴蝶兰的PeMADS1基因参与蕊柱的发育[20];蝴蝶兰和雅典蝴蝶兰(Phal.Athens)的C类和D类基因中的PhIAG1和PhIAG2,在唇瓣、蕊柱和胚珠中均有表达,但PhaMADS8、PhaMADS9和PhaMADS10在蕊柱和子房中均有特异性表达;木石斛(D.crumenatumSw)和球花石斛(D.thyrsiflorum)的DcOAG1表达于所有花器宫,DcOAG2仅在子房表达,但DthyrAG1和DthyrAG2在授粉后的花序和胚珠中均有表达[13,21],且梳唇石斛C类基因DOAG1和D类基因DOEG2都参与了蕊柱的形成[22]。黄花文心兰的OMADS4基因在雄蕊和心皮中表达,但OMADS2基因的表达仅限于心皮的柱头腔和子房[23];兰属CeMADS1基因只在柱中表达,而CeMADS2基因在所有花器官中部有[24];桃红蝴蝶兰PeMADS1和PeMADS7与柱和胚珠发育有关[1]。
2 兰花成花转导机制
大多数兰花需要数年时间才能完成幼年阶段[4]。成花是由被称为开花时间的基因启动,该基因调节着营养分生组织向花分生组织的转化。然后,花分生组织相关基因调节花的形成。一旦成花开始,控制花中螺旋形成的基因就会表达。虽然在被子植物中出现了花形态的极端变异,但可以区分出4种相对简单的花器官,即萼片、花瓣、雄蕊和心皮[4]。在此,本研究从分子遗传学的角度,综述近年来兰花成花和花发育的研究。
2.1 兰花成花信号
中国野生兰科植物约有208个属1 761个种,包括特有种601种。中国兰花主要分布在热带、亚热带以及长江流域以南地区(包括华东、华南和西南)。世界兰科有5大观赏属,中国有兜兰属、蝴蝶兰属、兰属和石斛属4个属,且2019年观赏兰花年产值占花卉总产值20%(中国花卉协会兰花分会内部资料)。兰科植物花的同源异型突变频率较高,这使其在花的形态、大小和颜色等特征上有着高度的差异[19,25]。2021年国家重点保护野生植物名录(第二批)共列入国家重点保护野生兰科植物29种和8类。为保存丰富的兰花资源,中国花卉协会批准建设了10个国家级兰花资源库。其中,广东农科院环艺所已收集保存各类兰花资源1 365份[26];福建农林大学森林兰苑保存濒危兰科植物1 200种及人工种质资源3 000多份(中国花卉协会兰花分会内部资料)。这表明,兰花存在多样的栖息地。
兰花多样的生境表明兰花可能已经进化出不同的开花策略,以应对各种环境和发育条件(图2)[1]。例如兰花中都有明显的全基因组复制(WGD)事件,可能与兰花的多样性有关。树兰亚科(Subfam.Epidendroideae)中的各种兰花对不同的环境温度和光照条件作出响应,从而诱导开花;低温促进蝴蝶兰、春兰和石斛的开花,而高温促进文心兰属和几个石斛杂交品种的开花;同时短日照下,有助于五唇兰(Phalpulcherrima)和米尔顿兰(Miltoniopsisorchids)的开花,而短日照下扇兰(Psygmorchispusilla)花峰值的诱导与日照长度的增加呈正相关[1]。此外,也有研究表明,植物激素,如细胞分裂素(CTK)和脱落酸(ABA),对兰花的花转变有促进作用[1]。相比生长素抑制花尖的起始,赤霉素(GA3)对开花没有影响,但可挽救高温下花朵发育障碍[1]。这些结果表明,兰花在决定开花时,会对常见的外部和内部信号作出反应。
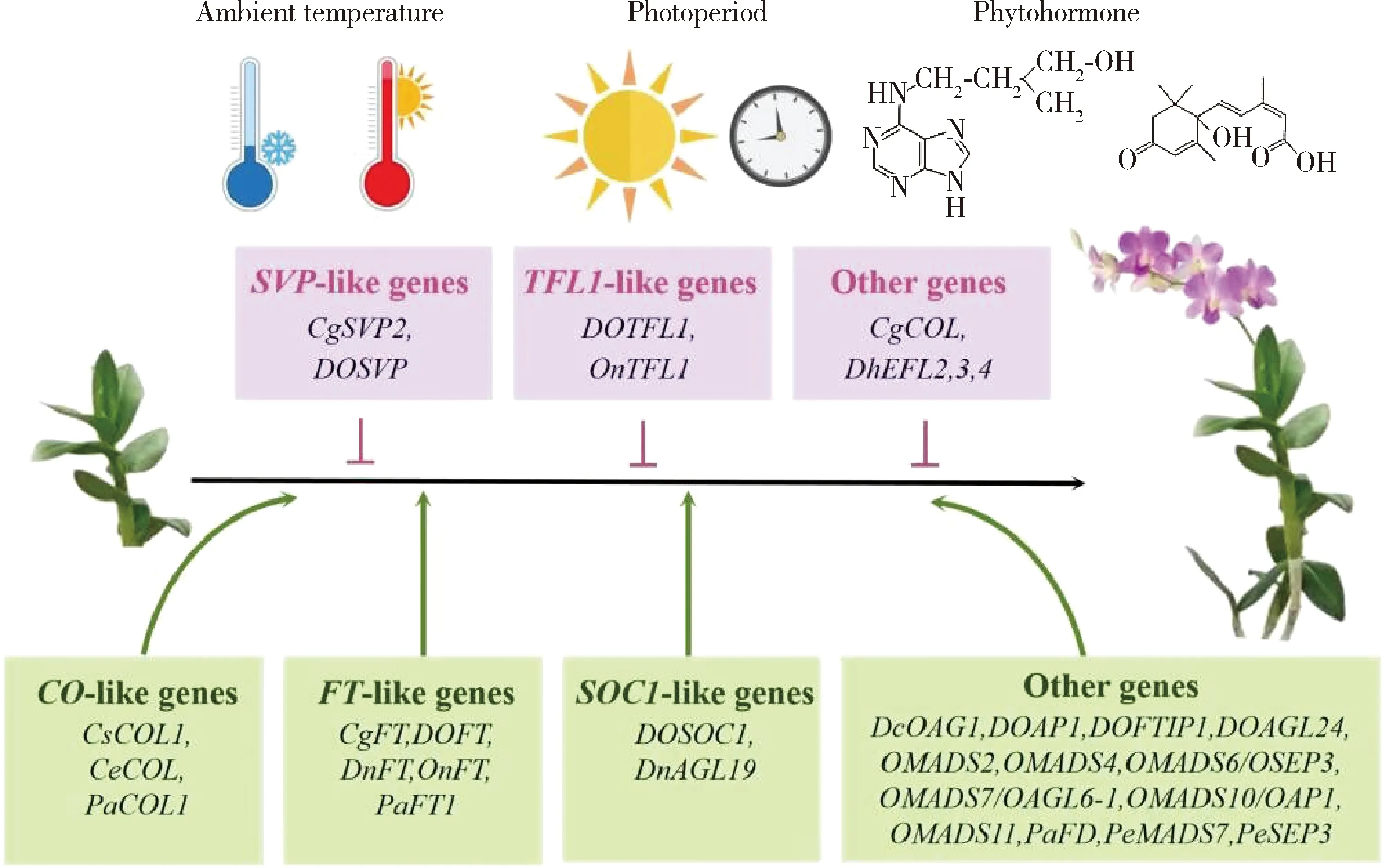
开花抑制子和启动子分别显示在粉色和黄色框中,而环境和发育信号则显示在基因上方。Flowering repressors and promoters are shown in pink and yellow boxes,respectively,while environmental and developmental signals are indicated above the genes.
2.2 兰花成花的主要影响因子
在成花过程中,花期、环境温度和光周期是决定兰花起始和个体发育的关键。成花是开花植物生命周期的关键,这种从营养生长向生殖生长的转变是发育状态和多种环境累积的响应[1]。植物开花由多种遗传途径组成复杂的网络进行调节,包括光周期、春化、赤霉素、年龄、自主和热感应途径[1]。目前,对兰花成花的机制研究有限,而阐明兰科植物的开花机制,将有助于兰花育种及其商业化潜力[4]。在成花过程中,幼年期、环境温度和光周期是决定兰花始花和季节的关键因素[4]。目前,已发现6条受内外信号调控开花的分子遗传机制(环境温度途径、光周期途径、春化途径、赤霉素途径、生物钟途径和自主途径)(图3),保证了不同环境下兰花开花。当前,在兰科植物中,石斛属植物花发育相关的研究较为完善[27]。由图3可知,外部温度变化、生物钟和光周期导致石斛昼夜节律的变化;而后许多信号通路被激活,包括植物激素中的细胞分裂素、生长素和赤霉素;一些关键基因,如DnVRN1、DoSOC1、DoAP1、DnCOL和DnFT等,被发现与花发育相关。本研究主要从分子生物学的角度总结近年来兰花成花的主要进展。

图3 石斛属植物花发育相关的环境因子及基因[27]Fig.3 Environmental factors and genes related to flower development in Dendrobium[27]
2.2.1温度对兰花成花的影响
温度是兰花成花的关键因子,温度水平以及昼夜温差都会影响花芽分化与发育[3]。不同种类兰花对环境温度的要求不同[28],一些兰花对温度变化的开花反应不同。如低温促进金钗石斛[29]、美堇兰属(Miltoniopsis)、蝴蝶兰属和轭瓣兰属(Zygopetalum)开花[4],而文心兰属[4]和一些石斛杂交品种[30]开花需高温环境。另外,也发现一些与温度相关的开花基因。在感应低温下,黑斑蝴蝶兰FLOWERINGLOCUST1(PaFT1)基因被上调[31]。目前,对蝴蝶兰低温诱导花发育的基因调控网络研究较为完善(图4),具体为低温诱导PaFT1表达,与PaFD相互作用,激活诱导成花所需的下游基因[4]。

图4 低温条件下台湾蝴蝶兰的开花调控Fig.4 Flowering regulation of Phal. formosa at low temperature
2.2.2光周期对兰花成花的影响
光周期以信号方式向植物光受体(主要为光敏色素(Phytochromes)、向光素(Phototropin)和隐花色素(Cryptochrome)传递生物钟变化,从而诱导 CO 表达,启动开花相关基因的表达[3]。研究发现,不同种类的兰花对光周期的要求也不同。如五唇兰(Phal.pulcherrima)9 h光照比12 h光照能更有效地启动开花[32];扇兰(Psygmorchispusilla)花的形成与白天时长的增加呈正相关[33];美堇兰在23 ℃短日照(SD)后转移到低温(11 ℃~14 ℃),有利于开花[30];但光周期对台湾蝴蝶兰开花没有显著影响[4]。另外,也发现一些与光周期相关的基因影响开花,如文心兰中的开花启动子FT(OnFT)的表达受光周期的调控[34];霍山石斛DhPEBPs具有与FT/TFL1对立的调节开花的功能[35];铁皮石斛DoSUTs在主要花器官的发育中起作用[4];朵丽蝶兰杂交种的EARLYFLOWERING4-like4(DhEFL4)基因受光周期调节[36];蝴蝶兰CO-like(Phalacol)的异位表达,引起烟草早期开花表型[37]。
2.2.3植物激素对兰花成花的影响
植物激素对兰花开花也有影响[4]。植物激素对大花蕙兰花的形态发生和发育起重要作用[38];蝴蝶兰花发育需开花茎尖中维持最佳的GA[39];而6-苄基氨基嘌呤(BA)促进了单轴兰花(蝴蝶兰)和合生兰花(石斛兰)的开花,且与赤霉素(GA)联合使用,对开花也有促进作用[40];在蝴蝶兰和朵丽蝶兰中,喷施BA可提前3~9 d产生花序[41];ABA 在兰花的成花过程中发挥了抑制作用[42],且NAA也抑制兰花花芽分化,延迟花期[3]。可见,植物激素对植物开花有显著影响,但其效果差异较大。
2.3 兰花成花功能基因组研究
目前,我国已经开发出一些兰花新品种,如通过野生资源的驯化筛选,中国已培育出兰花品种596个[26];采用多倍体技术,已在大花蕙兰、石斛兰和蝴蝶兰等中获得了多倍体植株[43];兰花杂交育种也是获得新品种的一个重要手段。从1854 年第一个在英国皇家园艺学会(Royal Horticultural Society(RHS))国际兰花品种登录委员会登录的兰花杂交种虾脊兰(Cal.furcata×Cal.masuca)开始,目前登记的兰花杂交种已超过14万个,主要包括石斛兰、卡特兰、万代兰、兜兰、蝴蝶兰、兰属和文心兰(表1)[44]。另外,通过生物技术也获得了一些兰花新品种,如白色文心兰、黑色蝴蝶兰和蓝色蝴蝶兰等。这些不同开花品种的获得,为我们研究兰花的开花分子机制,提供了丰富的材料。

表1 RHS注册登录的兰科杂交品种Table 1 RHS registered Orchidaceae hybrid
2.3.1兰花成花转录组研究
近年来,兰科多种植物利用转录组测序技术,在花器官、成花和花发育等转录组研究方面取得了很大的进展。如中国台湾成功大学热带植物研究所建立了OrchidBase3.0,收集到5个亚科的10种兰花花器官转录组数据[45],并对蝴蝶兰[46]、卡特兰杂交种KOVA[47]等的花部特征进行了转录组分析,同时对建兰[25,48-49]等的唇瓣和重瓣进行了转录组分析。在花启动方面,研究人员对蝴蝶兰[31]等进行了转录组分析;在低温花诱导方面,研究人员对金钗石斛(D.nobileLindl.)和台湾蝴蝶兰[50-52]等进行了转录组分析;在春化作用方面,研究人员对金钗石斛的春化腋芽[53]和石斛春化过程中的细胞分裂素(CTK)-赤霉素(GA)信号网络[51]等进行了转录组分析;在花发育方面,对竹叶兰(Arundinagraminifolia(D.Don)Hochr)[54]、大花蕙兰、丹心兰[55]和铁皮石斛[5,56]等进行了转录组分析。最近,在大花惠兰(Cymbidium)和文心兰(Erycina)转录组分析中,发现了许多可能影响开花的基因[4]。
2.3.2兰花成花基因组研究
兰花基因组测序项目和其他先进工具(如基因组编辑技术)极大地促进了兰花花发育的分子生物学研究。兰花基因组研究的一个关键里程碑是2015年蝴蝶兰的测序。随着更经济有效的测序技术的快速发展,兰科植物中已有18个物种先后完成了高质量参考基因组测序与组装,主要包括蝴蝶兰、小兰屿蝴蝶兰、铁皮石斛、深圳拟兰、白花蝴蝶兰、香荚兰、建兰、霍山石斛、鼓槌石斛、墨兰、沉香虎头兰黄色素花×黄辉大花蕙兰和金钗石斛等(表2)[57]。这些兰花基因组序列的发布,为在全基因组范围内鉴定和比较具有潜在新功能的兰花基因提供了巨大的机会。例如,在兰花花发育调控中起关键作用的MADS-box基因[1],在小兰屿蝴蝶兰和蝴蝶兰的基因组中分别鉴定出51和56个。尽管这些兰花基因组中的MADS-box基因总数远少于拟南芥(107个基因)和水稻(80个基因)的基因组,但兰花中含有更多与花器官形成有关的MADS-box基因,这种差异意味着增加的MADS-box基因可能与兰花高度特异多样性的花形态特征有关。拟兰亚科和其他亚科间MADS-box基因的数量不同进一步支持了这一假设。

表2 兰科已完成全基因组测序的种Table 2 Species of orchidaceae whose whole genome has been sequenced
2.3.3兰花成花基因功能验证
近来,兰科基因功能鉴定技术也取得了飞速发展。与许多其他作物相似,兰科首先使用基因枪法[58-59],将外源基因导入兰花基因组;进一步利用农杆菌介导法,将外源基因转入蝴蝶兰、石斛属、大花蕙兰和文心兰等[60-61],并使用原球茎外植体将蝴蝶兰的转化过程缩短到8个月[60]。另外,建立了高效的墨兰原生质体分离及瞬时表达体系[62],将病毒诱导基因沉默(Virus-induced gene silencing,VIGS)技术应用于兰科植物的基因功能验证[63]。随着许多兰花高质量基因组序列的完成(表2),CRISPR/Cas9基因编辑系统已成功应用于蝴蝶兰、铁皮石斛和霍山石斛[1]。
迄今为止,通过异源系统或同源系统瞬时转化技术,发现兰花开花的特性高度保守(图2)。例如,过表达FT-like基因(CymbidiumCgFT、DendrobiumDOFT/DnFT、OncidiumOnFT和PhalaenopsisPaFT1)、SOC1-like基因(DendrobiumDOSOC1/DnAGL19)、CO-like基因(CymbidiumCsCOL1/CeCOL和PhalaenopsisPaCOL1)和其他开花相关的同源基因(DendrobiumDcOAG1/DOAGL24/DOAP1/DOFTIP1、OncidiumOMADS2/OMADS4/OMADS6(OSEP3)/OMADS7(OAGL6-1)/OMADS10(OAP1)/OMADS11和PhalaenopsisPaFD/PeMADS7/PeSEP3)导致早花,而SVP-like基因(CymbidiumCgSVP2和DendrobiumDOSVP)、TFL1-like基因(DendrobiumDOTFL1和OncidiumOnTFL1)和其他基因(CymbidiumCgCOL和DoritaenopsisDhEFL2,3,4)的异位表达,延迟了不同类型转基因植物的开花[1,6,12-13,23,31,34,53,64-68]。有趣的是,与拟南芥中的对应物一样,兰花中的FT和TFL1同源物以类似拮抗的方式调节开花(图3)。
在石斛兰中,DOFT的下调或上调分别延迟或加速开花,而DOTFL1影响兰花开花的方式则相反[66],且DOFT1和DOTFL1的调控网络在拟南芥中也相似。例如,过表达石斛DOFT则上调了DOsOC1和DOAP1,这与FT对拟南芥SOC1和APETALA1(AP1)的促进作用相似。此外,2种兰花MADS-box转录因子DOSOC1和DOAGL24相互作用,并与DOTFL1处的CArG-box基序结合,这意味着在拟南芥中表现出潜在的调节层次[1]。值得注意的是,兰花开花基因可能已经进化出与不同兰花物种独特生理特征相关的其他新调节功能。一个典型的例子是开花期基因参与了假鳞茎的产生。假鳞茎是大多数附生兰花基部加厚的茎,作为水、矿物质和碳水化合物的储存器官[1]。在石斛兰中,假鳞茎的形成恰好发生在生殖发育的开始,并为随后的花序和花发育提供营养[1]。DOFT和DOTFL1对开花的拮抗作用分别与它们在促进和抑制石斛假鳞茎中的相反作用密切相关[66],这表明这些开花时间基因可能有助于调节兰花生殖发育所需的营养库。
3 讨论与展望
兰科植物拥有多变的花朵结构以及花期调控的重要性,故研究成花的分子机制意义突出。随着转录组、基因组和代谢组等多组学时代的到来,成花相关功能基因的挖掘将是未来研究的热点。尽管最近的一系列发现有助于我们理解兰花成花机理,但由于兰花营养期较长、遗传转化效率低下以及兰花基因组有限等瓶颈,兰花成花研究依然主要集中在模式植物中。这不可避免地限制了对兰花这些特殊花器官和成花特性分子机制的解析。另外,由于诱导条件不同,不同兰花的成花调控网络可能存在差异。目前,兰科开花控制的遗传机制研究还处于初步阶段,主要存在如下问题:1)兰花花器官的基因调控研究,应将花发育的所有相关基因的调控过程,与花形态相联系进行研究;2)成花的关键基因鉴定较少,应深入研究基因表达模式的特异性和保守性。兰科植物的开花研究已有了一些进展。随着多种兰花品种高质量基因组序列的完成,CRISPR/Cas9基因编辑系统已成功应用于蝴蝶兰、铁皮石斛和霍山石斛[1]。因此,亟需在兰花中建立高效、稳定、普遍的遗传转化体系和基因编辑系统。后续新的功能基因及复杂的遗传调控网络的逐步发现,将为兰科植物花器官高度进化的形态学发育提供分子基础,并有助于拓展人们对于植物开花分子调控的理解,对促进兰花产业的发展及其重要。

