浒苔多糖降解菌的筛选及其碳源利用谱分析
黎芯怡 王静涵 甄莉 徐展 戴景程 闫达中 陈静


摘 要:浒苔中含有大量的浒苔多糖,分解、利用及转化浒苔多糖对藻类资源利用以及海洋碳循环具有重要意义。为筛选出能降解浒苔多糖的微生物,提高浒苔生物量的回收利用效率,本研究利用微生物分离鉴定以及基质测试技术从浒苔绿潮中分离鉴定了浮游及浒苔附着微生物,成功地从分离到的菌株中筛选出能降解浒苔多糖的菌株,并选取黄杆菌Algibacter lectus S7和交替單胞菌Alteromonas confluentis A1-6作为代表菌株进行碳源利用谱分析。结果发现:黄杆菌Algibacter lectus S7可以分解利用浒苔多糖、木聚糖、葡萄糖、半乳糖和蔗糖;交替单胞菌Alteromonas confluentis A1-6可以分解利用浒苔多糖、葡萄糖、半乳糖、乳糖、木聚糖、蔗糖、可溶性淀粉、麦芽糖和糊精。从生长曲线可见,两菌株均能高效分解利用浒苔多糖,并分别揭示了两菌株对碳源利用情况,为海洋微生物对浒苔多糖的分解代谢研究及工业上提高浒苔生物量回收利用效率提供菌种资源及碳源参考。
关键词:浒苔;浒苔多糖;浒苔多糖降解菌;碳源利用谱
中图分类号:Q93-33 DOI:10.16375/j.cnki.cn45-1395/t.2023.03.017
0 引言
浒苔(Ulva prolifera, Enteromorpha prolifera),隶属于绿藻门石莼科浒苔属,俗称“海青菜”“绿紫菜”[1],是生活在近海滩涂中的天然野生绿藻,也是我国东南沿海最常见的海洋绿藻之一。自2007年起,每年夏季我国黄海都会爆发由浒苔引发的大规模绿潮[2]。其中,2008年青岛暴发的浒苔绿潮是世界上最大的绿潮,影响海域超过2万km2,实际覆盖面积超过400 km2 [3]。大量漂浮浒苔遮蔽阳光,消耗水中氧气,造成海洋生物死亡,对养殖业及海洋环境带来极大的危害[4]。为减少浒苔绿潮对海洋环境的污染,政府每年都要花费巨额资金,出动大量人力来打捞浒苔,同时面临着提高浒苔生物量资源的回收利用效率问题[5]。
浒苔多糖是浒苔生物量的主要成分,占浒苔干重的20% ~ 70%[6]。浒苔多糖具有免疫调节[7] 、抗肿瘤 [8-9]、抗病毒[10]、抗氧化[11-12] 、降血脂[13-14]等多种生理活性功能。而低分子量的浒苔寡糖具有更好的生物活性及水溶性,更广泛地应用于药物及功能性食物中 [15-16]。同时,浒苔可作为生产生物柴油及生物乙醇的材料[17-18]。目前对浒苔生物量的资源利用还存在成本高、转化效率低的问题。因此,筛选出能高效降解浒苔多糖的微生物及酶类,加快多糖物质的降解,是提高浒苔生物质利用效率及实现资源转化的关键,也是浒苔绿潮污染治理中重要的一环。
浒苔多糖主要成分为葡萄糖、木糖、半乳糖、鼠李糖和葡萄糖醛酸等,并且含有以糖醛酸和硫酸基为主要结构的水溶性多糖,其中糖醛酸和硫酸根的含量相对比较稳定[19]。目前对浒苔多糖降解微生物的研究还十分匮乏。Li等[20]从腐烂浒苔绿藻表面底泥中分离到一株γ-变形菌门的交替单胞菌(Alteromonas sp. A321),发现它能产生某种可分解浒苔多糖的酶。此外,黄杆菌在浒苔绿潮爆发时期大量出现。Liu等[21]分析并比较了胶州湾浒苔绿潮爆发区域中不同时期浒苔附着微生物及海水中微生物的结构组成,发现浒苔绿潮中期的海水中黄杆菌的丰度最高,达45%。另据Lin 等[22]研究发现,爆发浒苔的养殖水体中黄杆菌丰度是没有爆发浒苔的水体中的3~5倍。黄杆菌的大量出现可能是由于黄杆菌能首先分解利用浒苔多糖,因而在与其他微生物竞争碳源时占据优势,得以大量生长繁殖。
本研究对浒苔绿潮期间的微生物进行了分离及鉴定,筛选出了能降解浒苔多糖的微生物,并选取2株代表菌进行了多糖底物利用谱分析。以期能筛选出高效降解浒苔多糖的微生物,并解析其多糖底物利用谱,为由浒苔引起的海洋污染的治理问题提供理论基础和菌种资源;为工业上提高浒苔生物量回收利用效率提供新思路。
1 材料与方法
1.1 浒苔及微生物样品的采集及分离鉴定
在广西北海金海湾红树林海域和山东青岛栈桥及金沙滩海域的浒苔绿潮爆发地用无菌自封袋和采样瓶分别采集浒苔及海水样品。分别分离浒苔附着微生物和海水中的浮游微生物。
浒苔附着微生物的分离方法:取50 g新鲜浒苔用500 mL无菌海水清洗3遍后沥干,装入1 000 mL无菌锥形瓶中,加入500 mL无菌海水,置于超声清洗机中超声水浴(35 kHz)并用振荡的方法分离,收集液体[23]。
分别取海水及浒苔附着菌液,梯度稀释后均匀涂布于2216E固体海洋培养基平板上,倒置放入28 ℃恒温培养箱培养24~36 h,观察菌落生长情况。挑取单菌落,接种于2216E液体培养基中,放入28 ℃恒温摇床培养24 h。用16S rRNA 通用引物对27F/1492R PCR 扩增后送测序公司测序,通过比对NCBI数据库,鉴定微生物的种类,并将分离鉴定后的菌株用20%甘油保存于-80 ℃ 冰箱中。
选取重点分析的5个菌株,分别根据NCBI中序列的比对结果,选取相似度高的几株菌的序列构建系统发育树,在 Mega X中用Clustal W 对序列进行比对后用邻接法(neighbor joining)构建系统发育树。
1.2 浒苔多糖的提取
采取已建立的热水浴加乙醇沉降的方法提取浒苔多糖,具体步骤为:将浒苔清洗干净后,取适量于无菌水中,置于90 ℃水浴锅水浴7 h,收集液体,重复操作2次。将所得液体离心(4 800g(g为重力加速度),15 min)去杂质后浓缩至50 mL。加1/5提取液体积的氯仿正丁醇溶液(氯仿∶正丁醇 = 5∶1)剧烈震荡30 min后离心,取水相,去除提取液中的蛋白质,重复3次至无白色沉淀,收集上清液。将收集的液体用3倍体积的无水乙醇沉降,离心去上清,待干燥后加入适量无菌双蒸水溶解备用。
1.3 浒苔多糖降解微生物的筛选
将提取的浒苔多糖以5 g/L的终浓度加入无碳的海洋无机盐培养基(minimum marine medium,MMM)中,该培养基含有25.95 g NaCl, 2 g MgCl2·6H2O,3 g MgSO4·7H2O, 0.12 g CaCl2·2H2O,27 mL 0.5 mol/L Na2EDTA,25 mL 1 mol/L Tris-HCl(pH=8),10 mL 1 mol/L NH4Cl,0.8 g K2HPO4,0.2 g KH2PO4,0.015 g FeSO4·7H2O,0.03 g H4MoNa2O6,1 mL 微量元素混合液(含H3BO3 2.86 g/L,MnCl2·4H2O 1.86 g/L,Zn SO4·7H2 O 0.22 g/L,Na2MoO4·2H2O 0.39 g/L,CuSO4·5H2O 0.08 g/L,Co(NO3)2·6H2O 0.05 g/L)和1 mL 1 000 * 维生素混合物。将分离到的菌株接种到以浒苔多糖为唯一碳源的MMM液体培养基中,28 ℃、200 r/min震荡培养,根据生长情况判断各菌株对浒苔多糖的利用能力,筛选出能利用浒苔多糖的菌株。同时,按照BIOLOG使用方法,用PM2A碳源利用板测试几株菌对PM2A板上各碳源的利用情况。
1.4 浒苔多糖降解菌的生长曲线测定
为了测试筛选出的浒苔多糖降解菌株A1-6和S7对浒苔多糖的利用能力及对其他碳源的利用情况,用2216E液体培养基加上浒苔多糖及其他碳源测试菌株的生长曲线及碳源利用谱。除浒苔多糖外,测试的碳源有:葡萄糖、α-乳糖、D-果糖、D-麦芽糖、D-半乳糖、蔗糖、木聚糖、糊精、可溶性淀粉及明胶。配制以上各种糖的储备液,质量浓度为20 g/L。所用糖溶液经121 ℃、15 min高温蒸汽灭菌后使用。取保存的A1-6和S7菌种,用2216E液体培养基培养,转接3代活化。取15 mL无菌培养管,每管加入2216E培养基9 mL,待测糖储备液1 mL(终质量浓度为2 g/L),接种菌液1 mL。以不加糖储备液的培养物作为对照。每组培养物各重复做3次。用分光光度计检测培养物在600 nm下的OD值[24]。
2 结果分析
2.1 采样点浒苔绿潮的情况
2020年2月广西北海爆发了浒苔绿潮。图1(a)为广西北海金海湾海域的绿藻,发现引发此次绿潮的绿藻主要有2种:丝状的浒苔及片状的浒苔。2021年7月,山东青岛爆发了浒苔绿潮,图1(b)为山东青岛栈桥海域的绿藻,引发此次绿潮的绿藻主要为丝状浒苔。
2.2 北海及青岛样品分菌结果分析
北海样品分离的微生物鉴定结果见表1。北海样品中共分离到13种菌,其中海水样品中有8种,丝状浒苔附着菌分离到7种,片状浒苔附着菌分离到4种(3个样品中分离到的菌株存在部分重复,如交替单胞菌Alteromonas macleodii和Alteromonas oceani在3个样品中都分离到;Polaribacter marinaquae和Maribacter dokdonensis分别在2个样品中都有分离到)。共分离到3种黄杆菌:Polaribacter marinaquae、Maribacter dokdonensis、Cellulophaga lytica。其中,在海水及片状浒苔上有分离到Polaribacter marinaquae(片状浒苔上4次都分離到),丝状浒苔上没有分离到Polaribacter marinaquae;在片状浒苔上和丝状浒苔上都有分离到Maribacter dokdonensis(丝状浒苔上2次分离到),海水中没有分离到Maribacter dokdonensis;只在丝状浒苔上分离到1株Cellulophaga lytica。
青岛样品分离的微生物鉴定结果见表2。青岛样品中共分离到22种菌,其中海水样品中有10种,丝状浒苔附着菌分离到12种,共分离到4种黄杆菌:Meridianimaribacter flavus、Tenacibaculum geojense、Tenacibaculum mesophilum和Algibacter lectus,4株都是在丝状浒苔上分离到的,海水中没有分离到。对比2个采样点的分菌结果,只有Alteromonas confluentis在北海和青岛样品中都有分离到。其他菌株均不相同,包括2个样点分离到的黄杆菌也不相同。
在菌株鉴定的基础上,对重点分析的5株菌:菌株 A1-6、S7、A2-2、aA1-7和aA1-9构建了基于16S rRNA基因序列的系统发育树(见图2)。从图2可见,菌株A1-6与Alteromonas confluentis亲缘关系最近,聚成一支,且属于γ变形菌(γ-proteobacteria)。菌株S7、 aA1-7、 aA1-9 、A2-2分别与Algibacter lectus、Cellulophaga lytica、Maribacter dokdonensis和 Polaribacter marinaquae聚成一支,都隶属于黄杆菌(Flavobateria)。
2.3 菌株多糖底物分析及浒苔多糖降解菌的筛选
用BIOLOG对Alteromonas confluentis A1-6及3株黄杆菌Polaribacter marinaquae A2-2、Cellulophaga lytica aA-7 和Maribacter dokdonensis aA-9 的碳源利用谱进行了检测,结果见表3。从表3可见,在PM2A板的碳源底物中,4株菌都能利用果胶(Pectin);除Polaribacter marinaquae A2-2外,其他3株菌都能利用糊精(Dextrin);只有Cellulophaga lytica aA-7 可以利用硫酸软骨素C (Chondroitin Sulfate C)。4株菌都不能利用甘露聚糖(Mannan)、明胶(Gelatin)、菊粉(Inulin)、环糊精(α-/β-/γ-Cyclodextrin)、糖原(Glycogen)。
2.4 菌种生长曲线的测定
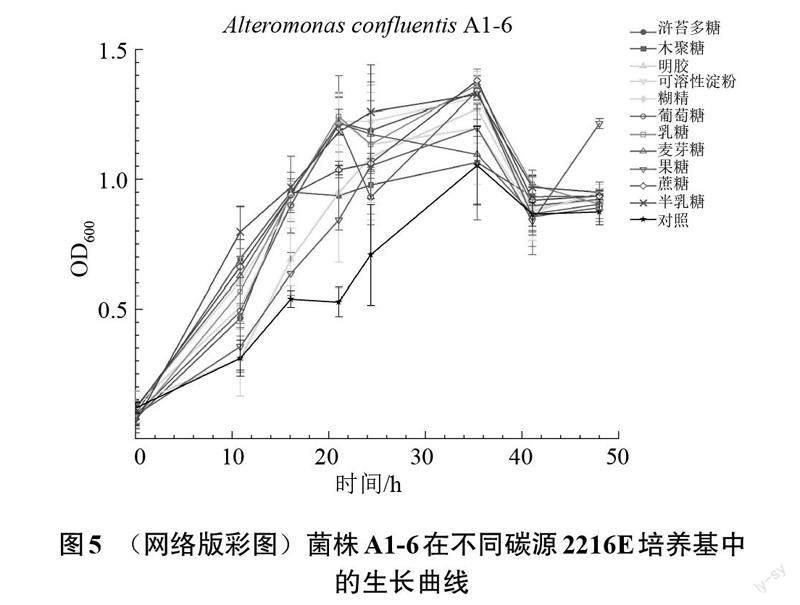
为了进一步检测筛选的菌株对浒苔多糖及其他碳源的利用情况,挑选交替单胞菌Alteromonas confluentis A1-6(图3(a)和黄杆菌Algibacter lectus S7(图3(b))2株菌进行生长监测,并绘制了菌株Algibacter lectus S7(图4)和Alteromonas confluentis A1-6(图5)在添加了不同碳源的2216E液体培养基中的生长曲线。
图3(a)为γ变形菌门的交替单胞菌Alteromonas confluentis A1-6的菌落形态,其菌落呈乳白色,全缘,菌落表面湿润光滑,光泽度好。图3(b)—图3(e)分别为拟杆菌门的黄杆菌Algibacter lectus S7、Polaribacter marinaquae A2-2、Cellulophaga lytica aA1-7和Maribacter dokdonensis aA1-9的菌落形态,可见其菌落均呈橙色或黄色,全缘,表面湿润光滑。其中菌株S7和A2-2菌落形态和颜色相似;菌株aA1-7菌落更为湿润且呈现微弱的绿色荧光;菌株aA1-9菌落颜色为浅黄色。
菌株 S7在不同碳源2216E培养基中的生长曲线如图4所示,黄杆菌Algibacter lectus S7在葡萄糖、半乳糖、浒苔多糖、木聚糖及蔗糖中的生长较对照组明顯增强,说明菌株S7可以利用这些糖作为碳源生长。这些碳源中葡萄糖、半乳糖为单糖,蔗糖为二糖,浒苔多糖和木聚糖为多糖,说明菌株S7能分解利用浒苔多糖和木聚糖。菌株在乳糖、果糖、可溶性淀粉中的生长曲线在对照组之下,可见菌株S7对乳糖、果糖、可溶性淀粉几乎没有利用,同时菌株在糊精、明胶及麦芽糖中的生长与对照差不多,无明显生长,说明菌株S7不能利用这些碳源。重点对比木聚糖和浒苔多糖,可以看出菌株S7对木聚糖的利用曲线在浒苔多糖曲线之下,但相差不大,可以猜想菌株S7对浒苔多糖的降解可能是作用在与木聚糖结构相似的木糖单体上。简而言之,菌株S7能利用浒苔多糖、木聚糖、半乳糖和蔗糖,但不能利用可溶性淀粉、糊精、麦芽糖、明胶、乳糖和果糖。
菌株Alteromonas Confluentis A1-6在不同碳源2216E培养基中的生长曲线如图5所示。与对照组相比,交替单胞菌Alteromonas confluentis A1-6除了在明胶和果糖中无明显生长外,其他碳源中都有生长,说明交替单胞菌A1-6对碳源的利用较黄杆菌S7更具有广谱性。其中对浒苔多糖、半乳糖和糊精的利用最明显,以这些碳源作底物,菌体的生长情况较其他糖类物质作底物时更好。菌株A1-6不能利用明胶和果糖,可以利用葡萄糖、浒苔多糖、半乳糖、乳糖、木聚糖、蔗糖、可溶性淀粉、麦芽糖和糊精。
通过以上分析,可以得出菌株Alteromonas confluentis A1-6和黄杆菌Algibacter lectus S7都可以利用浒苔多糖进行生长,且生长情况较好。同时,生长测试实验中所选取的糖类碳源并不是都能被菌株A1-6和S7利用,这说明不同菌株对于碳源底物的利用是有选择性的。菌株的碳源利用谱越广,则菌株对环境的适应能力越强,能占据更多的生态位。这可能是Alteromonas confluentis(菌株A1-6)可以同时在广西北海和山东青岛2个采样地都分离到的原因之一。
3 讨论
浒苔中含有大量的浒苔多糖,加快多糖物质的降解和转化,是提高浒苔生物质利用效率、实现资源转化的关键,也是浒苔绿潮污染治理中重要的一环。因此,筛选出能高效降解浒苔多糖的微生物,为浒苔多糖降解提供优质菌种资源是非常必要且迫切的。而分析浒苔多糖降解菌的碳源利用谱可了解菌株对不同碳源的利用能力,为菌株的培养提供碳源指导。
本研究成功筛选出2株浒苔多糖降解菌:黄杆菌Algibacter lectus S7和交替单胞菌Alteromonas confluentis A1-6。值得注意的是,之前研究中报道的浒苔绿潮中常大量出现的交替单胞菌属(Alteromonas sp.)在广西北海样品中多次分离到。而青岛样品中,只在海水样品中分离到1株Alteromonas confluentis A1-6。一方面说明不同的地方浒苔多糖降解菌的组分有差异,另一方面可知Alteromonas confluentis是常见且重要的浒苔多糖降解菌。另外,课题组在青岛海水样品中分离到7株弧菌(Vibrio sp.),且属于不同种。而在北海的海水样品中只分离到1株弧菌。弧菌通常擅长降解几丁质[25],有些也是病原菌[26]。青岛浒苔绿潮地大量出现弧菌,可能与绿潮引起虾、蟹等富含几丁质的生物死亡,使得此处几丁质含量较高有关。同时也建议尽量避免在浒苔绿潮爆发海域活动或接触污染海水,避免接触到病原菌。
由于BIOLOG的测试碳源中没有浒苔多糖及与其结构相似的多糖,因此,采用以浒苔多糖为唯一碳源的MMM培养基来测试菌株能否利用浒苔多糖进行生长。分离到的黄杆菌中只有Algibacter lectus S7生长良好,Cellulophaga lytica aA1-7能少量生长;交替单胞菌几乎都能生长。由于MMM培养基营养成分简单,菌株在MMM中的生长受到除碳源外的其他因素限制,因此绘制的生长曲线不明显。从有生长的菌株中挑选Algibacter lectus S7和 Alteromonas confluentis A1-6作代表,用2216E培养基培养并绘制生长曲线。结果发现2株菌能很好地利用浒苔多糖。由于浒苔多糖和木聚糖结构较相似,都富含木聚糖的单体,因此,重点比较菌株对浒苔多糖和木聚糖的利用能力。分析发现菌株A1-6对浒苔多糖的利用能力强于对木聚糖的利用能力,而菌株S7对浒苔多糖和木聚糖的利用能力相差不大。可以推测出交替单胞菌Alteromonas confluentis A1-6和黄杆菌Algibacter lectus S7分解利用浒苔多糖的代谢途径不一样。菌株A1-6对浒苔多糖这类结构的多糖利用较木聚糖有一定的偏向性,而黄杆菌S7对浒苔多糖和木聚糖的降解可能存在一个相似的酶系统,比如作用于木糖苷链的木糖酶,故而对含木糖的多糖降解能力更强。菌株对浒苔多糖的具体代谢途径以及高效的浒苔多糖降解酶类的挖掘尚需进一步研究。
4 結论
本研究以浒苔绿潮为背景,在广西北海及山东青岛的浒苔绿潮爆发地分离、鉴定了海水中及浒苔绿藻上附着的微生物,从北海样品中分离到3种黄杆菌、4种交替单胞菌,从青岛样品中分离到4种黄杆菌、1种交替单胞菌。通过以浒苔多糖为唯一碳源的MMM成功筛选出2株代表性的浒苔多糖降解菌:黄杆菌Algibacter lectus S7及交替单胞菌Alteromonas confluentis A1-6。菌株S7可以利用浒苔多糖、木聚糖、葡萄糖、半乳糖和蔗糖;菌株A1-6可以利用浒苔多糖、葡萄糖、半乳糖、乳糖、木聚糖、蔗糖、可溶性淀粉、麦芽糖和糊精,2株菌均能高效分解利用浒苔多糖。本研究成功筛选出浒苔多糖降解菌株:黄杆菌Algibacter lectus S7及交替单胞菌Alteromonas confluentis A1-6,为海洋微生物及CAZymes对浒苔多糖的分解代谢机理提供了理论基础,为工业上提高浒苔生物量回收利用效率提供新思路。
参考文献
[1] ZHAO J, JIANG P, LIU Z Y, et al. The yellow sea green tides were dominated by one species, Ulva (Enteromorpha) prolifera, from 2007 to 2011[J].Chinese Science Bulletin,2013,58(19):2298-2302.
[2] ZHANG J H,SHI J T,GAO S,et al. Annual patterns of macroalgal blooms in the Yellow Sea during 2007-2017[J].PLoS One,2019,14(1):0210460.
[3] 李震. 青岛近海浒苔的污染与预防治理[J].海洋开发与管理,2010,27(9):41-43.
[4] VAN A K L, NELSON T A, RIDGWAY R L. Environmental chemistry and chemical ecology of "green tide" seaweed blooms[J].Integrative and Comparative Biology,2015,55(3):518-532.
[5] LIU D Y, KEESING J K, HE P, et al. The world's largest macroalgal bloom in the Yellow Sea,China: formation and implications[J]. Estuar Coastal and Shelf Science,2013,129:2-10.
[6] 段元慧. 缘管浒苔(Enteromorpha)的营养成分及安全性分析[D].大连:大连海洋大学,2014.
[7] HELLIO C,BROISE D LD,DUFOSS? L,et al. Inhibition of marine bacteria by extracts of macroalgae:potential use for environmentally friendly antifouling paints[J].Marine Environmental Research,2001,52(3):231-247.
[8] JIAO L L, LI X, LI T B,et al. Characterization and anti-tumor activity of alkali-extracted polysaccharide from Enteromorpha intestinalis [J].International Immunopharmacology,2008,9(3):324-329.
[9] CHO M L,YANG C,KIM S M,et al.Molecular characterization and biological activities of water-soluble sulfated polysaccharides from Enterornorpha prolifera [J].Food Science and Biotechnology,2010,19(2):525-533.
[10] HUDSON J B, KIM J H, LEE M K, et al.Antiviral compounds in extracts of Korean seaweeds:evidence for multiple activities[J]. Journal of Applied Phycology,1998,10(5):427-434.
[11] 李响,周锡红,赵玉蓉.浒苔提取物成分分析及其生理功能研究进展[J].动物营养学报,2019,31(12):5468-5475.
[12] 石学连,张晶晶,王晶,等.浒苔多糖的分级纯化及体外抗氧化活性研究[J].中国海洋药物,2009,28(3):44-49.
[13] 张智芳.浒苔多糖提取工艺及其降血脂和抗肿瘤功能研究[D].福州:福建医科大学,2009.
[14] 孙士红.碱提浒苔多糖降血脂作用研究[J].中国现代药物应用,2010,4(15):118-119.
[15] LI B,LIU S,XING R,et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J].Carbohydr Polym,2013(92):1991-1996.
[16] CUI J F,LI Y P,YU P,et al. A novel low molecular weight Enteromorpha polysaccharide-iron (III)complex and its effect on rats with iron deficiency anemia (IDA)[J]. International Journal of Biological Macromolecules,2018,108:412-418.
[17] CAI C E, FEI L, SHAO F,et al. An improved process for bioethanol production from Ulva prolifera[J]. Journal of Biobased Materials and Bioenergy, 2018,12:109-114.
[18] SU B, GE B D, LI M Z, et al. Extraction, characterization and deoxy-liquefaction of crude polysaccharide from Enteromorpha prolifera to high-quality liquid oil[J]. Fuel,2019, 237:763-768.
[19] 于源,王鵬,李银平,等. 浒苔多糖提取、结构与活性研究进展[J].中国渔业质量与标准,2013,3(3):83-87.
[20] LI Y P, WANG J, YU Y, et al. Production of enzymes by Alteromonas sp. A321 to degrade polysaccharides from Enteromorpha prolifera[J].Carbohydrate Polymers,2013,98(1):988-994.
[21] LIU M,DONG Y,ZHAO Y,et al. Structures of bacterial communities on the surface of Ulva prolifera and in seawaters in an Ulva blooming region in Jiaozhou Bay,China[J]. World Journal of Microbiology and Biotechnology, 2011,27(7):1703-1712.
[22] LIN G,SUN F L,WANG C Z,et al. Assessment of the effect of Enteromorpha prolifera on bacterial community structures in aquaculture environment[J]. PLoS One, 2017, 12(7):0179792.
[23] HEMPEL M, BLUME M, BLINDOW I, et al. Epiphytic bacterial community composition on two common submerged macrophytes in brackish water and freshwater[J]. BMC Microbiology, 2008, 8(1):58.
[24] 曹国珍,缪建顺,张苗苗,等.分光光度法测定酿酒酵母细胞悬液浓度研究[J].中国酿造,2014,33(4):129-133.
[25] HUNT D E, GEVERS D, VAHORA N M, et al. Conservation of the chitin utilization pathway in the Vibrionaceae[J].Applied and Environmental Microbiology, 2008, 74(1):44-51.
[26] NAHAR S, SULTANA M, NASER M N, et al. Role of shrimp chitin in the ecology of toxigenic Vibrio cholerae and cholera transmission[J]. Front Microbiology, 2011, 2:260.
Screening of Ulva prolifera polysaccharide-degrading bacteria and analysis of its carbon source utilization spectrum
LI Xinyi1, WANG Jinghan1, ZHEN Li2,XU Zhan1, DAI Jingcheng1,
YAN Dazhong1, CHEN Jing*1
(1.School of Life Science and Technology, Wuhan Polytechnic University, Wuhan 430023, China;
2. China General Nuclear Power Environmental Protection Industry Co., Ltd., Shenzhen 518038, China)
Abstract: The Ulva prolifera produces a large deal of Ulva prolifera polysaccharide, the decomposition, utilization and transformation of which are of great significance to the utilization of algal resources and the marine carbon cycle. In order to screen the Ulva prolifera polysaccharide-decomposing microbes and improve the recycling efficiency of the Ulva prolifera biomass, planktonic and Ulva prolifera attaching microorganisms were isolated and identified from the green tide of Ulva prolifera by microbial isolation, identification and substrate testing techniques. We successfully screened out the strains that can degrade the polysaccharide of Ulva prolifera from these isolated microbes. And we selected the representative Flavobacterium Algibacter lectus S7 and Alteromonas confluentis A1-6 for further carbon source utilization analysis. The results showed that Algibacter lectus S7 could use Ulva prolifera polysaccharide, xylan, glucose, galactose and sucrose, while Alteromonas confluentis A1-6 could use Ulva prolifera polysaccharide, glucose, galactose, lactose, xylan, sucrose, soluble starch, maltose, dextrin. The growth curves showed that both strains could decompose and utilize Ulva prolifera polysaccharide, and the carbon source utilization spectrum of the two strains was revealed respectively. This study provides references both for the research of the catabolism of Ulva prolifera polysaccharides by marine microorganisms and for strain and carbon resources for the recycle of Ulva prolifera biomass in industry.
Key words: Ulva prolifera; Ulva prolifera polysaccharide; Ulva prolifera polysaccharide degrading bacteria; carbon source utilization spectrum
(责任编辑:罗小芬)

