一个大麦黄化突变体的突变机理及其遗传机制研究
白道宽, 郭宝健, 洪益, 张萌娜, 朱娟, 吕超, 王菲菲, 许如根
(扬州大学农学院,江苏省作物基因组学和分子育种重点实验室,植物功能基因组学教育部重点实验室,江苏省作物遗传生理重点实验室,江苏省粮食作物现代产业技术协同创新中心,江苏 扬州,225009)
叶绿体是植物光合作用的场所,可将太阳能转化成化学能供植株生长和发育,最终形成作物产量[1]。叶绿素含量直接影响光合效率,最终决定农艺性状和作物产量[2]。叶绿素分为叶绿素a和叶绿素b,叶绿素a是主要光合色素,直接从太阳光获取能量;叶绿素b是辅助光合色素,将光能传递给叶绿素a。叶色与叶绿素组分和含量有关,易于识别。叶色突变体是最常见的叶色变异材料,突变往往造成相关基因的缺陷,使叶绿素合成受到影响,造成植株叶片黄化,是研究叶绿素形成机理的重要材料[3-4]。
近年来,利用叶色突变体对叶绿素合成、叶绿体结构发育、光合作用以及色素合成相关酶的生物学功能等进行了大量研究,水稻中已有百余个叶色突变体被报道(http://www.gramene.org)[5],部分表现出条纹、斑点、叶脉黄化等特殊表型[6-8]。玉米中分离克隆的与叶色相关的数量性状座位(quantitative trait locus,QTLs)或基因已达200余个(http://www.maizegdb.org)[9]。目前,已报道的大麦黄化相关基因主要与叶绿素代谢途径和叶绿体发育相关,其中包含多个叶绿素合成关键酶基因,如PORA、PORB、CAO、Xantha-h、Xantha-g、Xantha-f等[10-13],PORA与PORB突变使蛋白复合物合成缺失,导致植株体内单线态氧积累,造成植株黄化;Xantha-h、Xantha-g、Xantha-f分别编码大小为40、70和140 kD的3个大小不同的多肽亚基,组成镁螯合酶,任一基因突变均会影响Mg2+插入原卟啉IX(Proto IX);CAO突变导致叶绿素b合成途径受阻,形成独特的缺叶绿素b型黄化。此外,叶绿体与核糖体发育途径及光系统中的基因发生突变同样会导致叶色变化,如HvCMF7[14]、HvCMF3[15]、HvLST[16]等。Landau等[17]发现,YCF3基因突变致使PSI组件发生缺陷,导致PSII严重的光抑制和降解。Lencina等[18]利用cpm突变体进行研究发现,MSH1基因突变会造成细胞质体发育不稳定,从而影响叶绿体发育。Bosco等[19]利用大麦叶色缺陷突变体阐述了叶绿体发育缺陷对COR(cold-regulated)基因表达的影响,从一定程度上解释了叶绿体发育与抗逆性之间的关联。相比较于水稻、拟南芥等模式植物,大麦由于基因组较大,已定位的与叶绿素合成、叶绿体分化及光形态建成相关基因较少,随着大麦全基因组测序完成,越来越多调控大麦叶色的基因逐渐被发掘出来,但是涉及响应冷胁迫的大麦叶色突变体偏少,开展有关温度对大麦叶色突变体的发育及光合特性影响的研究,可用于探究大麦的叶绿素合成、叶绿体发育及光合对温度的响应机制。
本课题组以二棱啤用大麦品种‘扬农啤5号’为材料,利用甲磺酸乙酯(ethyl methanesulfonate,EMS)诱变的方法,筛选得到1个温敏黄化突变体G039。该突变体在扬州秋播,自出苗即呈现出黄化表型,春季随气温升高,叶片逐渐转绿。本文通过表型观察、生理指标、组织结构及相关基因分析,探究突变体G039的基因突变机理及遗传特点,以期为大麦叶绿素合成及光合能力相关研究提供理论依据。
1 材料与方法
1.1 试验材料
以野生型‘扬农啤5号’(Yangnongpi 5,YNP 5)、‘扬农啤5号’种子EMS诱变后连续6代自交的温敏黄化突变体G039及突变体分别与野生型和江苏主推大麦品种‘扬农啤7号’配置的杂种F1与F2群体为材料。供试材料均来自扬州大学农学院大麦研究所。
1.2 材料种植
1.2.1 田间种植 2020—2021连续2年秋季将供试材料点播于扬州大学大麦试验田,行长1.2 m,行距0.2 m,株距0.06 m,每个材料3个重复,每个重复2行。
1.2.2 气候箱培养 将野生型‘扬农啤5号’及突变体G039种子置于25 ℃下催芽1 d,选取萌发程度一致的种子种植于装有营养土的盆钵,每盆均种2粒,各种植50盆,置于光照培养箱(合肥达斯卡特生物科技有限公司,RGLC-P1200-D3)中培养7 d,培养条件:12000 lx、光16 h/暗8 h、70%湿度、25 ℃。之后将‘扬农啤5号’和G039幼苗同时分别置于不同温度(10、15、20、25 ℃)光照培养箱中生长2周,光照和湿度同上。2周后进行叶色观察、SPAD值、叶绿素含量及光合特性参数的测定。
1.3 指标测定
1.3.1 主要农艺性状调查 在大田成熟期,随机取20株‘扬农啤5号’与G039调查株高(cm)、穗长(cm)、穗下节间长(cm)、分蘖数与每穗粒数5项农艺性状,取平均数作为各材料的性状值;收获后随机取‘扬农啤5号’与G039的种子,利用自动考种分析仪(万深SC-G)考察粒长(mm)、粒宽(mm)和千粒重(g),重复3次。利用SPSS 22.0软件进行t测验,比较二者主要农艺性状及产量构成因素差异性。
1.3.2 SPAD值测定 不同温度下分别取3株‘扬农啤5号’与G039,利用柯尼卡美能达SPAD仪(SPAD-502PLUS)测量第2叶最宽处的叶绿素SPAD值,重复3次。
1.3.3 光合色素含量测定 不同温度下分别取3株‘扬农啤5号’与G039,取第2叶中间部位,将叶片两端剪去并分离主叶脉,称取叶片重量并记录。将叶片剪成0.2 cm×0.2 cm的小块,放置于10 mL离心管中,加入8 mL 95%的乙醇,避光浸提48 h。参考Qin等[20]的方法利用紫外分光光度计测量上清液吸光度值,计算叶绿素a (chlorophyll a, Chl a)、叶绿素b (chlorophyll b, Chl b)及总叶绿素含量,重复3次。用同样方法测定田间条件下苗期与灌浆期‘扬农啤5号’和G039的叶绿素含量。
1.3.4 光合速率测定 使用CIRAS-3型光合仪(汉莎科学仪器有限公司)在植株第2叶叶片中下部进行测定,不同温度处理下‘扬农啤5号’与G039各选择3株,取平均值。测定的主要指标包括:净光合速率(net photosynthate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、水分利用率(water utilization rate,WUE)、胞间CO2浓度(intercellular CO2concentration,Ci)。
1.3.5 叶绿体超微结构观察 取样方法同1.3.3,取样后将叶片剪成面积约1 mm2的正方形,置于2.0 mL离心管中,立即放入2.5%的戊二醛固定液(25%戊二醛∶0.2 mol·L-1磷酸缓冲液∶无菌水体积比为1∶4∶5),于4 ℃下保存,固定好后进行清洗,然后再固定、洗涤、脱水与硬化,再经置换、浸渍、包埋、聚合、修块、切片、染色等一系列过程处理后,用透射电镜(Hitachi 7800型)进行观察、拍照[7]。
1.3.6 遗传分析方法 观察F1表型,统计2个F2群体中突变表型和野生表型株数及性状分离比;利用卡方检验,分析G039突变性状的遗传方式。
1.3.7 光合相关基因定量分析方法 选取不同温度下野生型和突变体G039叶片相同位置提取植物总RNA,采用诺威赞生物科技(南京)有限公司的Fast Pure Universal Plant Total RNA Isolation Kit 试剂盒提取总RNA;采用该公司的HiScript III RT SuperMix for qPCR (+gDNA wiper) 试剂盒进行反转录;使用Ensembleplants (https://plants.ensembl.org/Hordeum_vulgare/Info/Index)下载叶绿素合成相关基因PORA、PORB、CAO、Xantha-h、Xantha-g、Xantha-f,与光合作用相关的基因ycf(光系统I组装蛋白),叶绿体发育相关基因CMF7、CMF3、PTOX、LST和LFN1,编码错配修复蛋白的基因MSH1,与冷胁迫相关的基因COR的编码区序列;利用primer 5.0软件设计实时荧光定量PCR引物,交由擎科生物科技有限公司合成(表1)。以大麦GAPDH(HORVU.MOREX.r3.7HG0703580)基因和α-tublin(HORVU.MOREX.r3.1HG0082050)基因为内参,参照95 ℃ 30 s、95 ℃ 3 s、60 ℃ 20 s,40个循环的程序在7500 Real-time PCR 仪(Applied Biosystems 公司)上扩增, 利用自带软件分析 CT值,计算目的基因的相对表达量。利用G039与‘扬农啤5号’的比值代表各温度下基因的相对表达量,试验重复3次,取平均值。

表1 叶绿素合成、光合作用相关基因的定量引物Table 1 Primer of chlorophyll synthesis, photosynthesis related genes used fou quantitative real-time PCR
2 结果与分析
2.1 ‘扬农啤5号’与G039的大田表现分析
2.1.1 叶色分析 通过2020—2021与2021—2022年度连续2年的田间观察发现,在大田生长条件下,相比较于野生型‘扬农啤5号’,突变体G039出苗即表现出明显叶色黄化,并随温度降低二者差异愈发明显(图1A、1B);至次年3月份,随着气温逐渐回升,叶色逐渐转绿,灌浆期G039与‘扬农啤5号’之间叶色差异消失(图1C)。为进一步探索突变体G039出现黄叶表型原因,测定2个不同时期叶绿素含量。结果表明,与野生型相比,突变体G039苗期的总叶绿素、叶绿素a和叶绿素b含量极显著降低(图2A);在灌浆期,突变体G039的叶绿素a含量与野生型‘扬农啤5号’无显著差异,而叶绿素b和总叶绿素含量仍显著低于‘扬农啤5号’(图2B)。以上结果表明,G039叶色黄化原因是叶片叶绿素含量降低。

图1 自然条件下野生型‘扬农啤5号’和突变体G039的表型Fig. 1 Phenotypes of ‘YNP5’ and G039 under natural condition

图2 野生型‘扬农啤5号’和突变体G039叶绿素含量Fig. 2 Contents of chlorophyll pigments in ‘YNP5’ and G039
2.1.2 农艺性状分析 通过对野生型与突变体成熟期相关农艺性状的考察(表2)发现,突变体G039的株高、穗长、穗下节间长、分蘖数与每穗粒数均显著低于野生型‘扬农啤5号’;而突变体G039的粒长、粒宽与千粒重均高于‘扬农啤5号’,并达到极显著水平(图1D、1E)。

表2 野生型‘扬农啤5号’与突变体G039的主要农艺性状Table 2 Agronomic traits of the wild type ‘YNP5’ and mutant G039
2.2 不同温度下叶片SPAD值分析
为了系统观察突变体G039叶色受温度的影响,对植株进行不同温度处理。由图3可知,‘扬农啤5号’与G039在不同温度下培养2周后,叶片的SPAD值在各个温度下均存在显著差异,但随着温度的升高,‘扬农啤5号’与G039的SPAD值差异幅度不断缩小,叶色差异也变小(图4),说明G039叶色变化与生长环境温度有关。
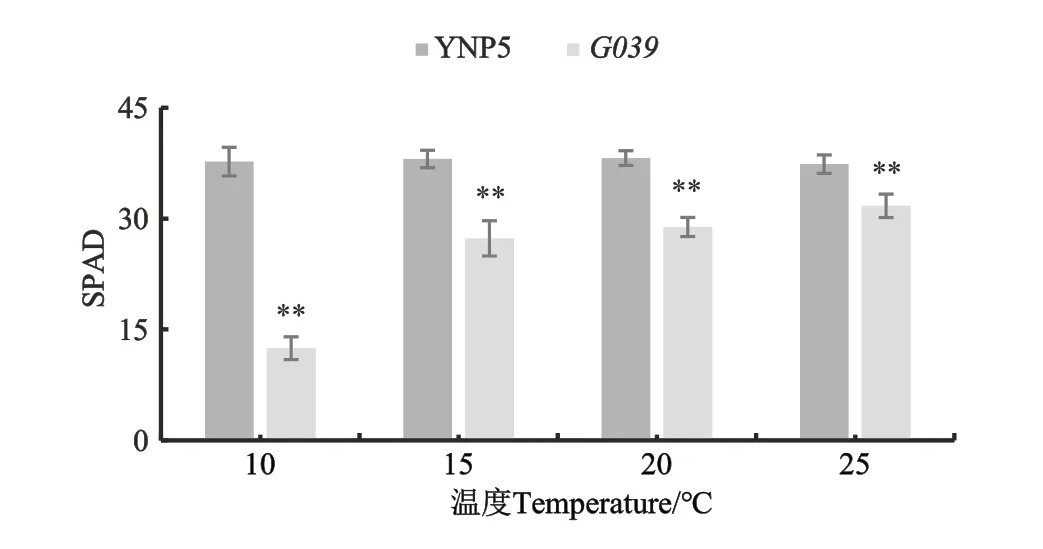
图3 不同温度下野生型‘扬农啤5号’与突变体G039的SPAD值Fig. 3 SPAD values of the ‘YNP5’ and G039 under different temperature conditions

图4 不同温度下野生型‘扬农啤5号’和突变体G039表型Fig. 4 Phenotypes of ‘YNP5’ and G039 under different temperature conditions
2.3 不同温度叶片叶绿素含量分析
由图5可知,4种温度(10、15、20、25 ℃)下‘扬农啤5号’叶绿素含量与G039均存在显著差异。在10 ℃条件下,G039的叶绿素含量最低,叶绿素a含量仅为‘扬农啤5号’的27.35%,叶绿素b含量为‘扬农啤5号’的20.83%,总叶绿素含量为‘扬农啤5号’的25.83%;随着温度的不断上升,突变体G039的叶绿素a、叶绿素b含量呈现不断增加的趋势。G039叶绿素a与叶绿素b含量在不同温度间变化明显,说明G039叶片叶绿素含量变化与环境温度相关,温度越低,黄化越严重,叶绿素含量越低。

图5 不同温度下野生型‘扬农啤5号’与突变体G039的叶绿素含量Fig. 5 Chlorophyll content of the ‘YNP5’ and G039 under different temperature conditions
2.4 不同温度叶片光合特性指标分析
不同温度(10、15、20、25 ℃)下‘扬农啤5号’与G039的5种光合特性参数如图6所示,‘扬农啤5号’的净光合速率在不同温度下无显著变化,G039净光合速率随着温度升高先升后降,在10 ℃时显著低于‘扬农啤5号’,至20 ℃时与‘扬农啤5号’无显著差异,之后出现转折,25 ℃时与‘扬农啤5号’出现显著差异(图6A)。‘扬农啤5号’与G039的蒸腾速率与气孔导度在4种温度下均无显著差异,且随温度变化趋势相同,蒸腾速率均随温度升高持续上升,气孔导度在10~20 ℃内大幅上升,在25 ℃时有所下降(图6B、6C)。‘扬农啤5号’和G039的水分利用率与胞间CO2浓度在10 ℃时具有极显著差异,在25 ℃时差异不显著,并且二者随温度表现出了迥然不同的变化趋势,‘扬农啤5号’的水分利用率随温度升高持续下降,G039的水分利用率在10~20 ℃时稳定上升,在25 ℃时有所下降;‘扬农啤5号’的胞间CO2浓度在10~20 ℃时表现出上升,在25 ℃时下降;G039则在10~25 ℃范围内呈现稳定下降趋势(图6D、6E)。值得注意的是,‘扬农啤5号’与G039的多个光合指标在25 ℃时出现转折。
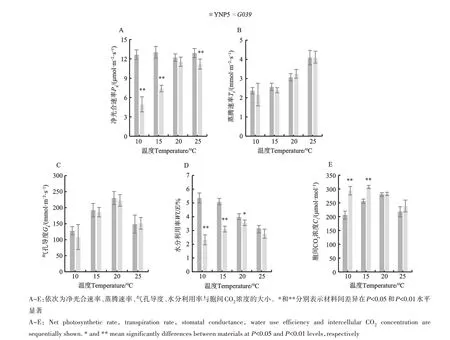
图6 不同温度下‘扬农啤5号’与G039的光合指标Fig. 6 Photosynthetic indices of ‘YNP 5’ and G039 under different temperature conditions
2.5 不同温度下叶绿体超微结构的差异分析
对10 和20 ℃下生长的突变体G039叶肉细胞中的叶绿体超微结构进行观察,结果(图7)显示,相比于20 ℃,10 ℃下生长的突变体G039叶绿体数目明显减少(图7A、7D);叶绿体内部结构也存在差异,10 ℃下的突变体G039类囊体发育紊乱,基粒片层堆叠更少,排列更疏松(图7B、7C、7E、7F)。以上表明,低温条件下突变体G039叶绿体发育受到严重影响,光合色素合成受阻,进而产生黄化叶表型。
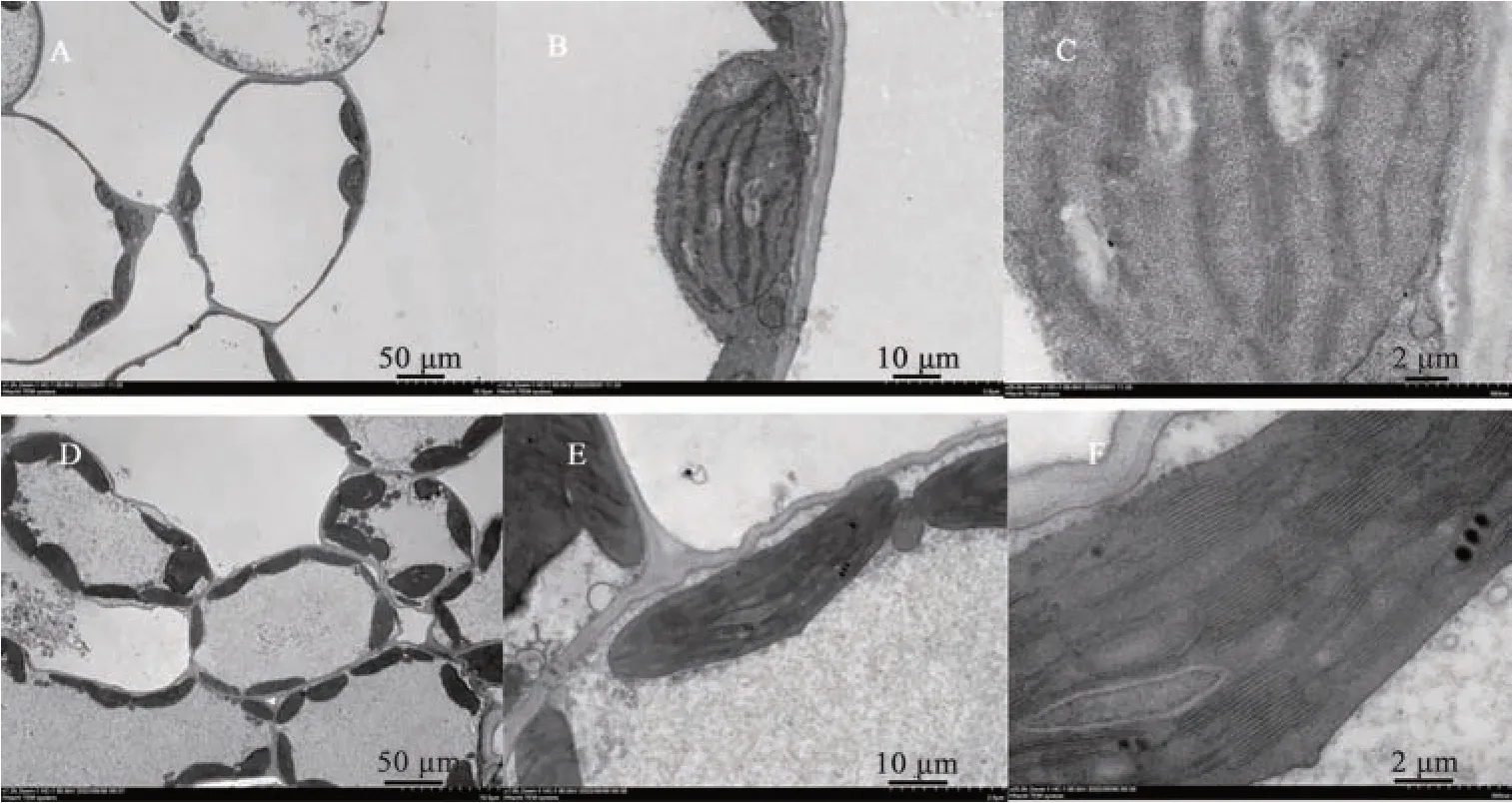
图7 不同温度下突变体G039叶肉细胞的叶绿体超微结构Fig. 7 Ultrastructure of chloroplasts in cells of G039 mutant under different temperatures conditions
2.6 突变基因的遗传分析
利用突变体G039分别与正常叶色的大麦品种‘扬农啤5号’和‘扬农啤7号’进行杂交,2个F1组合都表现为正常叶色,对2个F2分离群体的正常叶色与黄化类型单株进行统计与分析。由表3可知,2个F2分离群体野生型单株和突变型单株分离比均符合3∶1的分离比例(χ2=0.49,χ2=0.14,χ20.05=3.84),表明该突变性状受1对隐性核基因独立控制。

表3 突变性状的遗传分析Table 3 Genetic analysis of the mutant trait
2.7 光合相关基因表达分析
为研究G039叶色突变和低温响应的分子调控机制,分析了G039及其野生型中与叶绿素合成、叶绿体发育及光系统建成等相关基因的表达水平。由图8可知,与光系统组装相关的YCF3在10、20和25 ℃时在G039中表达量显著下调;与叶绿素合成相关的HvCAO和与叶绿体发育相关的HvPTOX在突变体G039中的表达量显著下调,且不受温度变化的影响;PORA与PORB编码形成复合蛋白,在叶绿素合成途径中有关键作用,10 ℃下G039中2个基因的表达量显著低于‘扬农啤5号’,随着温度升高到20 ℃,G039与‘扬农啤5号’之间2个基因的表达不存在显著差异;冷胁迫响应基因COR在20~25 ℃的G039与‘扬农啤5号’中均不表达,在10~15 ℃下G039中的表达量显著低于‘扬农啤5号’。在4种温度下,叶绿体发育相关的HvCMF3基因及编码错配修复蛋白的MSH1基因在G039中的表达量均显著高于‘扬农啤5号’。因此,部分叶绿素合成途径和叶绿体分化发育相关基因及冷胁迫响应基因表达异常可能是导致突变体G039叶绿素含量降低的重要因素。

图8 不同温度下叶绿素合成相关基因的相对表达量Fig. 8 Expression levels in genes involved in chlorophyll synthesis of YNP 5 and G039 under different temperature conditions
3 讨论
叶色突变具有突变频率高、表型易识别的特点,在大麦遗传育种中有多方面的应用价值,是研究叶绿体发育与光合作用机制的重要材料;此外,也可作为标记性状应用于杂交种筛选[21-22]。本研究中的黄化突变体G039苗期叶色黄化,叶绿素a与叶绿素b含量较野生型‘扬农啤5号’显著下降。随着温度升高,突变体G039逐渐返绿,叶片SPAD值上升,对各项光合色素单独测定,显示叶绿素a与叶绿素b含量均显著升高,叶绿体透射电镜观察显示,10 ℃下G039较20 ℃下叶绿体数目显著减少,形态异常,类囊体发育紊乱,基粒片层堆叠减少,认为突变体G039黄叶的表型是由于叶绿体发育异常和光合色素下降引起的,且表现出低温敏感性。相比于SPAD仪法,乙醇浸提法测量色素含量具有稳定性高、精确性强的特点,能够反映出特定种类叶绿素的含量,有利于判断叶绿素合成途径如何受到影响。
闫伟平等[23]研究发现,26~28 ℃条件下最利于玉米光合作用的进行;江华等[24]、杨淑巧等[25]研究认为,小麦光合作用的最适温度在20 ℃左右。本研究中,突变体G039净光合速率随温度上升而升高,20 ℃时与‘扬农啤5号’无差异;至25 ℃时再次产生差异,可能是由于温度偏高导致净光合速率产生微小降低,G039的净光合速率在20与25 ℃时无显著差异,因此大麦光合作用的最适温度在20 ℃左右。
本研究中,‘扬农啤5号’与G039的蒸腾速率均随温度上升而升高,这与闫蓉等[26]的结论相同;‘扬农啤5号’与G039的气孔导度在10~20 ℃随着蒸腾速率的上升而升高,这与董树亭等[27]的结论一致,但在25 ℃时气孔导度下降,可能是由于温度高于大麦光合作用的最适温度,造成‘扬农啤5号’与G039的气孔导度下降。此外,‘扬农啤5号’的胞间CO2浓度与G039的水分利用率在25 ℃时也发生转折,可能与气孔导度下降有一定关系。在10~20 ℃范围,‘扬农啤5号’的水分利用率随着温度升高而降低,胞间CO2浓度随着气孔导度变大而升高,与刘亮等[28]的研究结论一致;但G039在2项上的变化却与‘扬农啤5号’相反,认为G039净光合速率大幅上升,抵消了气孔导度对胞间CO2浓度的影响,造成胞间CO2浓度持续下降,而在光合学中水分利用率为净光合速率与蒸腾速率的比值,因此,G039的水分利用率随之上升。本试验中,突变体G039的蒸腾速率与气孔导度与野生型无差异,而净光合速率、水分利用率显著低于‘扬农啤5号’,胞间CO2浓度显著高于‘扬农啤5号’,表明黄化会导致植株净光合速率显著下降,但蒸腾速率、气孔导度、胞间CO2浓度等其他指标的变化取决于突变对细胞结构及叶绿体发育造成的不同影响。值得注意的是,G039在株高、穗长、穗下节间长、分蘖数、每穗粒数上显著低于野生型‘扬农啤5号’,但粒长、粒宽与千粒重均显著高于‘扬农啤5号’,表明叶色基因可能参与调控粒型。千粒重作为决定产量的关键因素,进一步研究有利于探究叶色基因调控大麦产量的机理,对增加大麦产量具有重要的理论意义。
迄今为止,不同物种中已有数个叶色基因被克隆,如直接编码叶绿素合成与降解的基因HvCAO、Xantha-f、PORB等,参与调节叶绿体发育的基因virescent-1(v1)[29]、virescent-2(v2)[30]、OsPPR16[31]等,参与光合作用及光系统发育的基因OspsaA[32]与YCF3等。CAO基因控制叶绿素a转化为叶绿素b,由3个结构域构成:A域感知叶绿素b含量并调控CAO蛋白水平,B域链接器控制域间的联系,C域催化叶绿素a转化为叶绿素b;域与域之间相互协作,任一结构域受损均会影响叶绿素b合成。本研究中,在低温条件下突变体G039的叶绿素合成及叶绿体分化相关基因表达量下调,其中编码叶绿素a加氧酶基因HvCAO在不同温度下的表达量均显著低于野生型‘扬农啤5号’,该酶将叶绿素a一条支链的甲基转化为甲酰基,形成叶绿素b,在叶绿素代谢途径中发挥不可替代的作用[12]。HvPTOX是光合作用及叶绿体分化相关基因簇成员,该基因下调表达导致G039光合速率的下降,可能与叶绿体发育缺陷有关[33]。PORA与PORB编码原叶绿素酸酯氧化还原酶,低温下在G039中二者均显著下调表达,随着温度升高,其在G039与‘扬农啤5号’中的表达量差异逐渐缩小,20 ℃以上PORB在G039与‘扬农啤5号’之间不存在显著差异,说明突变体植株的叶绿素合成在低温下受阻,使叶绿素含量大幅下降。HvCMF3作用于光系统Ⅱ及叶绿体分化[15],不同温度下,突变体G039的HvCMF3均较野生型‘扬农啤5号’上调表达,G039基因突变可能反馈上调HvCMF3的表达。此外,突变体中光系统编码基因YCF3的转录水平显著下调,G039基因突变可能阻碍了光系统的正常组装,对其结构和功能造成影响,抑制光反应的正常进行;而编码错配修复蛋白的MSH1基因在不同温度G039中的表达量均明显高于‘扬农啤5号’,G039基因突变可能通过反馈调节改变该基因的表达水平;COR编码1个低温响应蛋白,20~25 ℃时不表达,10~15 ℃时突变体G039中表达量显著低于野生型‘扬农啤5号’,表明COR基因受低温胁迫诱导,且表达受叶绿体发育影响。

