基于核心素养的高中无机化学“教—学—评”一体化实践

摘 要:文章介绍了基于核心素养的“教—学—评”一体化教学模式,以创设真实生活情境的教学,引导学生在主动思考、自主实验、小组讨论、实验设计创新、小组互评、教师追问等互动中不断发现问题、解决问题,提升认识水平,全面发展化学学科核心素养,为“教—学—评”一体化模式的化学课堂教学提供实践参考。
关键词:高中无机化学;核心素养;“教—学—评”一体化;钠的几种化合物
中图分类号:G427 文獻标识码:A 文章编号:2097-1737(2023)18-0083-05
引 言
立德树人是教育的根本任务,落实到化学学科上就是培养学生的化学学科核心素养[1]。教师应基于一体化的视角设计教学内容、教学方式以及效果测评,增强课堂教学的有效性。本文分析了基于核心素养的“教—学—评”一体化教学模式在无机化学中的应用,以期提高学生课堂学习效率。
一、基于核心素养的“教—学—评”一体化教学模式
《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课程标准》)提到,依据化学学业质量标准,评价学生在不同学习阶段化学学科核心素养的达成情况,积极倡导“教—学—评”一体化,使每个学生的化学学科核心素养得到应有的发展[2]。“教”以目标为导向,指向学科核心素养的培养;“学”是为了发展核心素养,与教的内容保持一致;“评”则是为了促教和促学。三者共同指向发展学生的学科核心素养,是课堂教学的指导思想,教师要基于《课程标准》和学科核心素养目标来确定教学目标和课堂教学评价目标[3]。
二、教学设计思想与依据
为了全面发展学生的化学学科核心素养,教师要积极倡导并实施“教—学—评”一体化,探索开展化学日常学习评价的策略和有效途径,注重评价目标与教学目标的一致性、评价任务与学习任务的一致性[4]。本文以2019年人教版高中化学必修一“钠及其化合物”
为例,呈现该教学模式在高中无机化学教学中的重要
作用。
三、教学背景分析
在教学内容方面,学生已经学习了钠及其相关反应,了解了钠的相关性质。在前一节内容的基础上来学习本节的内容,学生可以对钠的化合物有更加全面的认识。另外,这部分内容实验较多,与生活联系紧密,容易激发学生的学习兴趣。
同时,钠的重要化合物是本章教材的重点之一,是钠单质性质的延伸和发展,钠易失电子转变为钠的化合物,所以钠单质和钠的化合物之间存在着必然的因果关系[5]。通过钠及其化合物的学习,学生既复习巩固了氧化还原反应和离子反应,又为学习其他金属化合物奠定了基础,提供了理论模式。教师可以引导学生通过建立基于物质类别、元素价态和检验物质性质的认识模型,发展物质性质和物质用途关联、化学物质及其变化的社会价值的认识水平,提高解决实际问题的水平[6]。
在学情方面,高一学生已经有一定的比较总结、分析归纳的能力,所以学生学好该部分内容可以锻炼自学能力以及合作探究学习的能力,逐步掌握学习化学的一些基本方法,真正认识化学在促进社会发展、改善人类生活条件等方面所起到的重要作用[7]。结合以上分析,笔者设计以下目标。
(一)教学目标
第一,以“灭火操作”为问题情境,通过氧化物分类以及氧化钠相关方程式的书写,掌握其作用,并进行分组实验探究过氧化钠的化学性质,掌握钠的两种氧化物性质的异同,初步形成基于物质类别、元素价态和检验物质性质的认识模型。
第二,以“发酵粉成分”为问题情境,通过小组合作比较碳酸钠和碳酸氢钠在水中的溶解性、热稳定性以及与酸反应的差异,并进行实验创新,建立物质性质与物质用途的关联,培养观察能力以及运用对比的方法认识事物和全面分析事物的逻辑思维能力,培养初步的科学探究能力与创新能力。
第三,通过侯氏制碱法,认识化学与人类生产、生活的密切关系,感受化学物质及其变化的价值,培养科学态度与社会责任,激发探索欲,形成科学精神。
(二)评价目标
第一,通过对过氧化钠的化学性质的检验,诊断并发展学生实验探究物质性质的水平和认识物质的水平。
第二,通过碳酸钠与碳酸氢钠对比实验的交流与点评,诊断并发展学生实验操作能力、观察能力、合作学习的水平和实事求是的科学态度。
第三,通过书写钠的化合物反应的化学方程式与离子方程式,诊断并发展学生的宏观辨析与微观探究能力,提高化学思维和符号表征能力。
第四,通过侯氏制碱法的讨论和点评,诊断并发展学生对化学学科社会价值的认知水平。
四、教学与评价思路
第一,提出问题→证据推理与模型认知→提出问题选择研究方向→诊断并发展学生认知物质的水平。
第二,明确方法和任务→科学探究与创新意识→选择研究方法确定探究任务→诊断并发展学生的实验探究水平。
第三,实验探究→科学探究与创新意识、宏观辨识与微观探析→实验探究设计实验装置→诊断并发展学生的实验探究水平。
第四,知识应用→科学态度与社会责任→建立性质与用途的关联→诊断并发展学生对化学价值的认识水平。
五、教学课堂实录
(一)情景引入,选择Na2O和Na2O2的性质探究方向
教师通过展示消防员灭火情景,引导学生思考钠的氧化物可能具有什么性质,并从元素化合物的一般认知模型出发,结合课堂实际选定Na2O和Na2O2的性质探究方向。
物理性质:颜色、气味、状态、熔沸点、溶解度……
化学性质:氧化物→碱性氧化物→通性(与酸、酸性氧化物、水反应……)
之后,教师让学生回忆前面做过的实验,填写Na2O和Na2O2的颜色、状态、氧元素价态与物质生成条件,完成学案上的表格,继而引导学生从氧化物的分类分析碱性氧化物的通性。
设计意图:从生活中的例子出发,引出本节教学内容;借助元素化合物的一般认知模型提出探究方向;完善学生对元素化合物认知模型的认知。
(二)选择研究Na2O和Na2O2性质的方法并确定探究任务
教师引导学生写出Na2O与H2O、CO2、HCl反应的化学方程式,强调书写方程式检查配平细节。学生思考后,通过类比氧化纳的相关反应,分析Na2O2与H2O、CO2、HCl反应的实质。之后,教师将分组实验探究作为主要研究方法,明确该环节的两个探究任务:实验探究1,Na2O2和H2O反应;实验探究2,Na2O2和CO2反应。然后,让学生完成课本实验2-3(即实验探究1)的操作。
实验前:强调Na2O2具有强氧化性,提醒学生注意使用安全。注意pH试纸的操作。注意观察带火星的木条是否复燃。
实验中:关注学生实验操作的规范性等问题。
實验后:点评学生实验记录(实验报告)、产物分析、方程式的书写、双线桥与单线桥的标注,并对存在的问题进行解释。
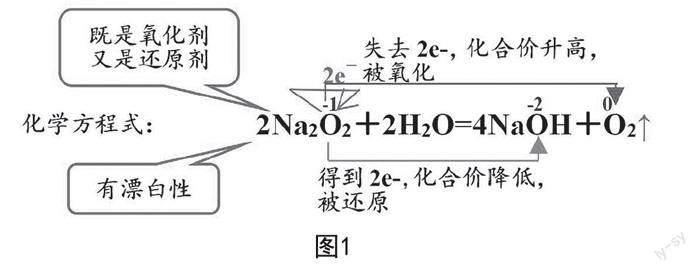
(1)pH试纸最终褪色,该现象学生可能忽略或无法解释原因。解释:主要是因为Na2O2本身具有强氧化性,它能够将指示剂氧化,使它褪色,称为漂白性。
(2)学生可能会错认为H2O作为还原剂。解释:Na2O2中O的化合价为-1价,为中间价态,可以发生歧化反应,在这里既是氧化剂,又是还原剂。
(3)双线桥、单线桥画错。解释:先标明化合价,双线桥均是从左到右指向同一元素,并标明得失电子数,化合价变化。单线桥则是从失电子的原子指向得电子的原子,歧化反应则在同一原子上转一圈(如图1)。
在完成实验探究1后,教师引导学生进行实验探究2,过程同实验探究1。
之后,教师引导学生类比Na2O2与H2O或CO2反应放出氧气,思考Na2O2与HCl反应产物和所属类别。在学生思考交流后,教师引导学生书写化学方程式。通过书写方程式,学生了解到Na2O2不是碱性氧化物,因为Na2O2与H2O反应除了生成盐和水之外,还有氧气。
在此基础上,教师归纳Na2O2用途,展示图片,引导学生回答情境导入的火灾处理问题。然后引导学生小结Na2O与Na2O2的性质,包括颜色状态、物质类别、生成条件、与H2O反应、与CO2反应、与HCl反应、应用与相互转化等。
最后让学生思考并交流,完成学案表格。
设计意图:通过Na2O2性质的探究和与Na2O性质的比较,培养学生宏观辨析和微观探究能力,使学生建立通过实验得到性质结论的认知模型。
(三)以生活中发酵粉成分设问导入,选择Na2CO3和NaHCO3的性质的探究方向
教师从蛋糕切面上的小孔切入,发酵粉可以使面团变得膨胀且松软。提出问题:为何发酵粉中使用的是碳酸氢钠而不是碳酸钠?联系元素化合物的认知模型,结合课堂实际选定碳酸钠和碳酸氢钠的性质探究方向。
物理性质:颜色、气味、状态、熔沸点、溶解度……
化学性质:盐类→通性(酸碱性、热稳定性、与酸反应……)
设计意图:从熟悉生活细节出发,引出本节教学内容;借助元素化合物的一般认知模型提出探究方向;完善学生对元素化合物认知模型的认知。
(四)选择研究Na2CO3和NaHCO3性质的方法并确定探究任务
Na2CO3和NaHCO3在类别和组成上有相似性,选择对比实验作为主要研究方法。结合选定的探究方向,明确本节课的三个探究任务:实验探究1,Na2CO3和NaHCO3溶解性及溶液酸碱性的差异;实验探究2:
Na2CO3和NaHCO3热稳定性的差异;实验探究3,
Na2CO3和NaHCO3与HCl反应的差异。
设计意图:根据具体对象和情景选择研究方法和任务,为有针对性地展开探究活动做准备。
(五)Na2CO3和NaHCO3的性质实验探究和装置设计
实验探究1:Na2CO3和NaHCO3溶解性及溶液酸碱性的差异
教师让学生分组实验,完成教材上探究实验2-4的操作,并汇报实验结果。
实验前:强调因为要对比溶解性,所以必须取等质量的固体并加入等质量的水。教师要引导学生关注实验操作每个步骤的递进性:观察外观→加少量水→观察→加较多的水→观察→加几点酚酞→观察。
实验中:关注学生实验操作的规范性问题。
实验后:点评学生实验记录(实验报告),指出存在的问题并进行解释。
(1)外观上学生可能只能看出两者均为白色。解释:观察细致,碳酸钠是白色粉末,碳酸氢钠是白色细小晶体。
(2)对于碳酸氢钠,学生可能会说“放热不明显”。解释:温度无明显变化,不一定是放热不明显,也可能是吸热不明显,所以应说“热效应不明显”。
(3)对于碳酸氢钠,学生可能会说“剩余较多固体”。解释:按照溶解度21.5 g、9.6 g计算,振荡足够的时间,碳酸钠全部溶解,碳酸氢钠剩下少量固体。
(4)对于碳酸氢钠:学生可能会说“未变红”。解释:如果试管里的碳酸氢钠溶得再多点,是可以明显看出浅红色的。
初步结论(学生可能说得比较具体):结合探究目的来描述结论,碳酸钠的溶解度较大,同浓度时碳酸钠溶液的碱性较强。
设计意图:以实验探究增强学生实验操作水平,通过实验结果汇报和点评,提升学生观察实验现象和描述实验现象的能力。
实验探究2:Na2CO3和NaHCO3热稳定性的差异
教师引导学生依据要求设计新的实验装置,观看用新实验装置的实验视频,总结两者热稳定性差异,让学生形成设计对比实验装置的思路,解释装置的构成和作用。
情境创设:点评课本提供的方案和装置,装置简单,但是无法知道分解温度,需要两次拆装、两次加热。
提出问题:请你设计一套实验装置,要求能通过一次实验比较得出Na2CO3和NaHCO3的热稳定性差异并测得物质的分解温度。
仪器:烧杯、试管、酒精灯、温度计、导管、橡胶管、石棉网等。(铁架台等固定装置略)
药品:碳酸钠、碳酸氢钠、澄清石灰水、水、甘油(沸点:290℃)。
引导思考:围绕实验目的——比较两者热稳定性来展开设计,关键是控制条件相同,再通过以下问题链帮助学生完成装置的构造:
(1)如何使两者受热温度相同?
(2)水浴加热能提供的温度上限是多少?
(3)温度计水银球应该置于哪里?
展示成果:演示装置,播放该装置进行实验的微视频。
知识小结:通过表格小结热稳定性差异,并书写相关化学方程式。
设计意图:通过对比实验装置活动,发展学生评价和设计实验装置能力,让学生初步掌握对比实验装置的设计思路和方法。
实验探究3:Na2CO3和NaHCO3与HCl反应的差异
教师让学生分组实验:向同体积同浓度的碳酸钠或碳酸氢钠溶液中逐滴滴加稀盐酸,并进行实验结果汇报,即描述现象,写出离子方程式,完成学案。
实验前:说明为对比碳酸钠和碳酸氢钠与盐酸反应的差异,将稀盐酸逐滴滴入相同體积和相同浓度的碳酸钠和碳酸氢钠溶液中;强调逐滴滴加的规范,讲授实验操作要领及原因;引导学生观察试管中现象:有无气泡产生、产生快慢、滴入相同滴数盐酸后气泡的多少等。
实验中:关注学生操作规范和实验结果,引导思考得出反应离子方程式。
实验后:点评,理清碳酸钠与盐酸反应在宏观现象上的阶段性及与微观本质的联系。
盐酸滴入碳酸钠溶液无气泡,并不是没有反应,而是CO32-与H+的反应分两步进行。刚开始氢离子不足只发生了第一步,生成HCO3-,没有气泡;随着滴入盐酸的增多,氢离子足够了才发生第二步反应,生成H2CO3并分解产生气泡。
(1)宏观现象上有两个阶段,是因为微观本质上CO32-与H+反应是分两步进行。
(2)碳酸钠与盐酸反应放出气体的速率相比碳酸氢钠相对慢些。
(3)有的学生向碳酸钠滴盐酸,一下就产生了气泡,原因是滴得太快了,局部H+浓度较大,瞬间两步反应都发生了。
(4)如果向盐酸中加入碳酸钠,会有什么现象?一开始就会产生气泡。因为盐酸是过量的,两步反应同时发生。
设计意图:以实验探究以及结果点评,增强学生实验实操水平,发展学生将宏观现象与微观本质相联系的能力,让学生理解并掌握碳酸钠和碳酸氢钠与盐酸反应的简要原理。
最后,教师引导学生思考碳酸钠与盐酸的反应实质,通过手持技术演示,用pH传感器生成滴定图像让分步反应的过程更加直观呈现出来,直接印证刚才的实验分析和结论。
设计意图:通过投影,教师课下采用手持技术实验方法探究碳酸钠与盐酸反应过程的pH变化,将分步反应清晰、直观地呈现在学生面前,轻松突破认知难点,让学生对化学实验的探究方法有更深刻的理解。
(六)分析NaHCO3的应用和借Na2CO3进行爱国教育
教师让学生总结碳酸钠和碳酸氢钠的性质及差异(如水溶性、酸碱性、热稳定性、与少量HCl反应等),讨论并汇报为什么发酵法中选择的是碳酸氢钠。学生讨论总结发酵粉中选择碳酸氢钠的原因:碱性较弱口感较好,受热也能分解放出气体,碳酸氢钠与少量酸反应就能较快放出气体,膨松效果好。
之后,教师通过表格帮助学生对比总结碳酸钠和碳酸氢钠的性质,引入侯德榜的爱国事迹以达到立德树人目的;同时,简略介绍碳酸氢钠的性质在氨碱法制纯碱工艺中的应用,进一步提升学生对化学价值的认识。
设计意图:巩固所学知识,体现从生活到化学再从化学回归生活的思想,提升学生对化学价值的认识;通过爱国科学家侯德榜的事迹对学生进行社会主义核心价值观的教育,落实立德树人根本任务。
六、教学总结与反思
本节课的主要内容是研究氧化钠与过氧化钠、碳酸钠与碳酸氢钠几个性质的差异,但其实总体难度不大,所以实验探究更多的只是作为教学情景,而教学更侧重于对学生的思辨水平、规范与创新意识的提升。
分组实验和结果点评对学生提高动手能力和操作规范性有实质帮助,也提升了学生对对比实验的认知[8]。
碳酸钠与碳酸氢钠实验装置设计体现了较强的创新意识。手持技术实验因为时间有限,无法在课堂上开展,但这种先用传统实验手段探究,再用手持技术实验方法直观印证的方式,也有效开拓了学生的实验探究思路,培养了学生的实验创新精神。
此外,本节课利用生活中的例子作为引入,引导学生从生活走向化学,最后再用所学知识解决生活中的化学问题,提高学生对化学价值的认识。本课还引入化学史和化学工艺知识,在宣传爱国科学家侯德榜的爱国事迹、进行爱国主义教育的同时,进一步提升学生对化学价值的认知。
结 语
基于核心素养的“教—学—评”一体化能让学生在解决真实情景中完成学习任务,增强课堂教学的有效性[9]。教师只有主动更新教育理念,发展专业化知识,增进对化学学科理解,主动探索与实践基于“教—学—评”一体化适切情景的开发、多元化评价方式的综合利用以及教学辅助技术的深度融合等,才能真正提升学生的核心素养[10]。
[参考文献]
杨军峰.以真实问题情境发展学生核心素养:以“乙酸”教学为例[J].现代中小学教育,2021(5):30-33.
中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[M].北京:人民教育出版社,2020.
唐琛.基于核心素养的“教、学、评”一体化教学实践:以“饮食中的有机化合物:乙酸”教学为
例[J].化学教学,2022(7):48-52.
鲁衍旭.“教、学、评”一体化视角下的高中化学教学实践:以人教版高中化学必修第一册“氧化还原反应”为例[J].中学化学,2022(5):5-8.
刘淼.教学评一体化模式在高中化学教学中的应
用[J].数理化解题研究,2022(15):116-118.
臧丽娟.“教、学、评”一体化教学模式在高中化学教学中的应用[J].学园,2022,15(33):27-29.
张蕙淋.素养为本的“教、学、评”一体化在高中化学教学中的应用研究[D].石河子:石河子大学,2022.
石雪梅.“教、学、评”一体化模式在高中化学教学中的应用[J].中学化学教学参考,2021(14):1-2.
秦甜甜.“教、学、评”一体化在高中化学教学中的应用研究[D].开封:河南大学,2021.
秦爱东.教学评一体化在高中化学教学中的应用探究[J].启迪与智慧(下),2020(6):33.
作者简介:詹益仕(1989.8-),男,广东汕头人,
任教于广东省汕头市金山中学,年级组长,一级教师,本科学历。

