基于肠道菌群和短链脂肪酸代谢探讨甘草制远志降低肠道炎症的作用机制
王梓宇,张智慧,吴 鹏,李浩然,赵 梦,何梦娇,张学兰,赵 鑫
基于肠道菌群和短链脂肪酸代谢探讨甘草制远志降低肠道炎症的作用机制
王梓宇,张智慧,吴 鹏,李浩然,赵 梦,何梦娇,张学兰*,赵 鑫*
山东中医药大学药学院,山东 济南 250355
研究远志甘草制前后对正常大鼠肠道菌群和短链脂肪酸(short-chain fatty acids,SCFAs)代谢的影响,探讨甘草制远志降低肠道炎症的机制。SD大鼠连续15 d ig远志或制远志后,ELISA法检测十二指肠组织中炎症因子白细胞介素-6(interleukin-6,IL-6)、IL-8和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;苏木素-伊红(HE)染色观察肠组织病理变化;采用16S rDNA测序技术检测大鼠肠道菌群结构变化;运用气相色谱法测定大鼠粪便中乙酸、丙酸、丁酸、戊酸含量。甘草制远志可显著降低远志引起的大鼠十二指肠组织中IL-6、IL-8、TNF-α水平升高和肠道炎症损伤(<0.05、0.01)。16S rDNA测序结果显示,甘草制远志后可改善远志引起的大鼠肠道菌群结构改变和物种多样性减少,在门水平上主要表现为厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)相对丰度回升(<0.05、0.01),拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)相对丰度下调(<0.05、0.01);在属水平上,远志甘草制后可上调有益菌乳酸杆菌属、毛螺菌属、颤螺旋菌属等菌属的丰度(<0.05、0.01),下调潜在的致病菌拟杆菌属、梭状芽孢杆菌属等菌属的丰度。甘草制远志可一定程度逆转远志引起的大鼠粪便中乙酸、丙酸、丁酸、戊酸含量降低(<0.05、0.01)。远志引起的肠道炎症可能与其引起肠道菌群和SCFAs紊乱有关,甘草制远志可通过改善肠道菌群和SCFAs代谢来降低肠道炎症反应。
远志;甘草制;肠道炎症;肠道菌群;短链脂肪酸;远志𠮿酮III;3,6′-二芥子酰基蔗糖
远志为临床常用中药,具有安神益智、交通心肾、祛痰、消肿的功效[1]。远志生用具有刺激咽喉、令人呕吐的不良反应,大剂量服用会产生胃肠毒性,抑制实验动物的胃肠运动,造成胃肠黏膜损伤[2]。甘草制远志可缓和燥性,消除麻味,免刺咽喉,并可增强远志安神益智作用,故远志临床应用时一般需要炮制后入药[3]。研究表明,远志经甘草制后皂苷、糖酯和有机酸类成分含量发生明显变化,并可缓解远志引起的肠道炎症和肠黏膜损伤[4-6]。但甘草制远志减轻肠道炎症的机制尚未阐明。
肠道菌群为在肠道中定植的细菌组成的生态系统,具有促进免疫系统发育、拮抗外来致病菌定植的作用[7]。肠道微生物群改变会使黏膜免疫反应失调,导致宿主发生肠道炎症。调节肠道菌群平衡可以恢复免疫系统的稳态,从而改善肠道炎症[8]。短链脂肪酸(short-chain fatty acids,SCFAs)是肠道菌群主要代谢产物,包括乙酸、丙酸、丁酸、戊酸等,其在大鼠粪便中含量高低可间接反映肠道内微生物变化,并对人体健康起着重要作用[9]。SCFAs可调节宿主能量代谢和能量供应,具有抑制病原菌、维持肠屏障功能及抗炎作用[10]。目前远志炮制前后对正常大鼠肠道菌群及SCFAs代谢的影响未见报道。本研究从甘草制远志调节肠道菌群和粪便中SCFAs代谢角度探讨远志甘草制减轻肠道炎症的机制,进一步丰富远志炮制减毒的科学内涵,为远志的临床应用提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量(200±20)g,购自济南朋悦实验动物繁育有限公司,动物合格证号SCXK(鲁)20190003。动物于温度(23±1)℃、相对湿度(60±5)%、自然昼夜节律光照环境,适应性饲养7 d。动物实验经山东中医药大学实验动物伦理委员会批准(批准号SDUTCM20220525002)。
1.2 药材
远志购自山东百味堂中药饮片有限公司,经山东中医药大学药学院徐凌川教授鉴定为远志科植物远志Willd.的干燥根。
制远志按《中国药典》2020年版一部炮制方法制备[1]:取净远志段1 kg,置锅内,加甘草汁和适量水,煮至汤液吸尽,口尝无刺喉感,取出,干燥。每1千克远志用甘草60 g。
1.3 药品与试剂
白细胞介素-6(interleukin-6,IL-6)、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为190729KE1、190729KE2、190729KE3)均购自江苏晶美生物科技有限公司;Qiagen凝胶提取试剂盒购自德国Qiagen公司;Phusion®型高保真PCR预混液购自美国New England Biolabs公司;Universal DNA纯化回收试剂盒购自中国天根生化科技有限公司;NEBNext®Ul tra™Ⅱ DNA Library PrepKit建库试剂盒购自美国Illumina公司;对照品乙酸、丙酸、丁酸、戊酸(批号分别为CHB180927、CHB180603、CHB180606、CHB180126,质量分数均≥98%)购自成都克洛玛生物科技有限公司。
1.4 仪器
352型酶标仪(长沙平凡仪器仪表有限公司);Qubit 2.0荧光计、Ec250-90型电泳仪(美国Thermo Fisher Scientific公司);Gene-Amp®9700型PCR扩增仪(美国ABI公司);NEBNext®Ultra™ II DNA Library PrepKit型Illumina NovaSeq平台、Illumina Novaseq型测序仪(美国Illumina公司);Tanon 1600型凝胶成像系统(上海天能科技有限公司);H3-18KR型台式高速冷冻离心机(湖南可成仪器设备有限公司);FA1604N型电子天平(上海精密科学仪器有限公司);Agilent 6890型气相色谱仪(美国Agilent公司)。
2 方法
2.1 远志与制远志提取物的制备及其主要成分定量分析
取远志和制远志粉末(过2号筛)各1 kg,分别加10、8、8倍量的70%乙醇超声提取3次,每次超声1 h,抽滤,滤液合并,减压浓缩至一定体积,冷冻干燥。按照课题组前期建立的方法[6],采用HPLC法对远志与制远志提取物中主要成分进行定量分析。
2.2 分组与给药
SD大鼠适应性喂养7 d后随机分为空白组及远志低、高剂量(4、8 g/kg)组和制远志低、高剂量(4、8 g/kg,以生药量计)组,每组6只。取冻干粉适量,临用前用蒸馏水配成折合生药量1.00 g/mL的药液。各给药组ig相应药物,1次/d,连续15 d,空白组ig等体积的生理盐水。
2.3 大鼠十二指肠组织中炎症因子IL-6、IL-8和TNF-α水平的测定
给药结束后,取大鼠十二指肠组织,剪碎,称定,加磷酸缓冲盐溶液匀浆(组织∶溶液=1 g∶9 mL),将匀浆器下端插入冰水中上下研磨6~8 min,4 ℃、3000 r/min离心15 min,取上清液,按照试剂盒说明书检测IL-6、IL-8和TNF-α水平。
2.4 大鼠小肠组织病理学检查
将各组大鼠相同部位小肠组织用4%多聚甲醛固定48 h,进行石蜡包埋、切片,苏木素-伊红(HE)染色后置于显微镜下进行组织病理学观察并拍照。
2.5 大鼠肠道菌群16S rDNA基因测序与分析
末次给药后,按摩大鼠腹部促其排便,将粪便装入无菌冻存管中,液氮速冻后放置−80 ℃冰箱保存。采用十六烷基三甲基溴化铵法提取各组大鼠粪便样品总DNA,2%琼脂糖凝胶电泳检测DNA的提取纯度和浓度。采用特异性引物515F(5’-ACTCCTACGGGAG-3’)、806R(5’-GCAGCAGT- CTAAT-3’)通过PCR扩增样品的V3~V4区域。根据PCR产物浓度进行等量混样,充分混匀后使用2%琼脂糖凝胶电泳验证,Universal DNA纯化试剂盒对目的条带进行回收。使用 NEBNext®Ultra™ II DNA Library PrepKit制备文库,Qubit进行文库定量,使用Illumina Novaseq高通量测序平台测定肠道微生物群。对所有样本有效Tags以97%的一致性进行操作分类单元(operational taxonomic units,OTU)聚类。对以上得到的有效数据使用QIIME2软件中的DADA2模块进行降噪,并过滤丰度小于5的序列,从而获得最终的ASVs(扩增子序列变异)以及特征表(序列在样本中的丰度表)。使用QIIME2软件中的classify-sklearn模块将得到的ASVs与数据库比对从而得到每个ASV的物种信息。根据OTU分类对肠道微生物的物种多样性及物种差异进行分析。
2.6 大鼠粪便中SCFAs含量测定
参照蒋恺憧等[11]建立的检测方法,分别精密称取乙酸、丙酸、丁酸和戊酸对照品适量,以乙醚配制成质量浓度均为1 mg/mL的对照品溶液,再稀释成不同质量浓度的混合对照品溶液,绘制标准曲线。取大鼠粪便约0.2 g,加2 mL超纯水混匀,4 ℃、10 000 r/min离心10 min,取上清液1 mL,加入50%硫酸200 μL、无水乙醚2 mL,混匀,4 ℃、10 000 r/min离心30 min,取醚层进气相色谱检测。
2.7 统计学分析
3 结果
3.1 远志甘草制前后主要成分定量分析
如表1所示,远志经过甘草制后,球腺糖A和3,4,5-三甲氧基肉桂酸含量增加,而西伯利亚远志糖A5、西伯利亚远志糖A6、远志𠮿酮III、远志蔗糖酯B、3,6′-二芥子酰基蔗糖、黄花远志素A、远志蔗糖酯A、远志蔗糖酯C、远志寡精H、远志寡精A、远志皂苷B含量降低。
3.2 远志甘草制前后对大鼠十二指肠组织中炎症因子IL-6、IL-8和TNF-α水平的影响
如图1所示,与空白组比较,远志低、高剂量组和制远志高剂量组大鼠十二指肠组织中炎症因子IL-6、IL-8和TNF-α水平均显著增加(<0.05、0.01),而制远志低剂量组大鼠十二指肠组织中各炎症因子水平无明显变化。与等剂量远志组比较,制远志组大鼠十二指肠组织中炎症因子水平均显著降低(<0.05、0.01)。表明远志经甘草制后可减轻大鼠肠道炎症反应。
表1 远志甘草制前后主要成分含量
Table 1 Contents of main components in Polygalae Radix before and after licorice processing
成分质量分数/% 远志制远志 西伯利亚远志糖A50.432 0.393 西伯利亚远志糖A60.307 0.278 远志𠮿酮III0.782 0.718 球腺糖A0.253 0.332 远志蔗糖酯B0.276 0.239 3,6′-二芥子酰基蔗糖1.7041.426 黄花远志素A0.1100.094 远志蔗糖酯A0.8900.731 远志蔗糖酯C0.4120.370 3,4,5-三甲氧基肉桂酸0.1760.313 远志寡精H0.2930.214 远志寡精A0.5670.534 远志皂苷B4.9293.943
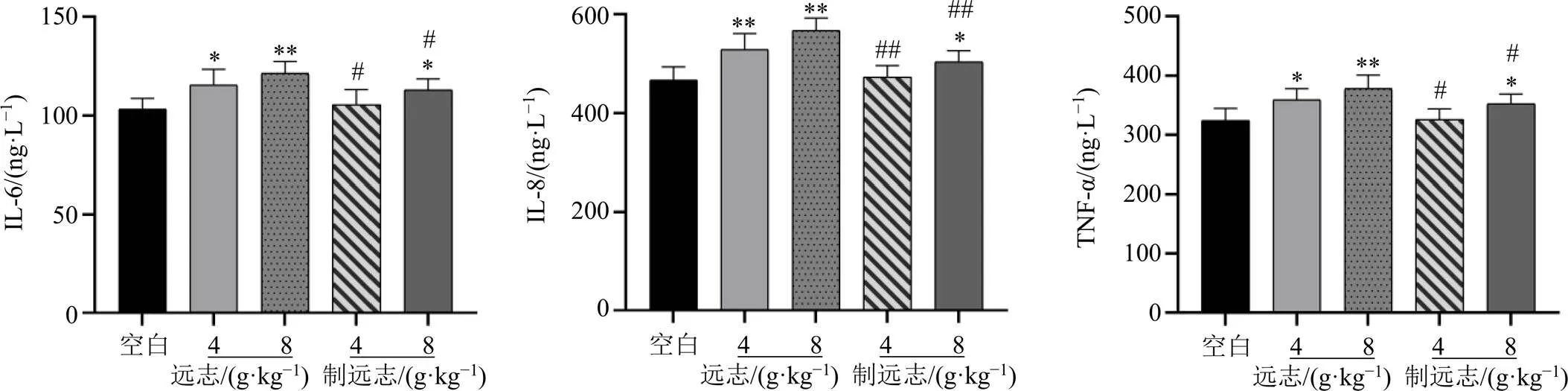
与空白组比较:*P<0.05 **P<0.01;与等剂量远志组比较:#P<0.05 ##P<0.01,图5、6同
3.3 远志甘草制前后对大鼠小肠组织病理特征的影响
如图2所示,空白组大鼠小肠肠壁完整且平坦,各层结构比较清晰,小肠黏膜绒毛内未见糜烂及溃疡,炎细胞较少,绒毛内血管略有充血,黏膜下及肌层未见明显异常;远志低、高剂量组未见完整绒毛结构,部分切片有淋巴组织增生现象,小肠黏膜绒毛内可见大量炎细胞浸润,绒毛黏膜上皮脱落、坏死,黏膜下及肌层未见炎细胞浸润,并见血管扩张充血;制远志低剂量组可见完整绒毛结构,小肠黏膜绒毛内仅有微量炎细胞浸润,血管扩张不明显,黏膜下及肌层未见炎细胞浸润;制远志高剂量组可见完整绒毛结构,小肠黏膜绒毛内有少量炎细胞浸润,血管扩张不明显,黏膜下及肌层未见炎细胞浸润。表明远志经甘草制后可减轻大鼠小肠组织的黏膜损伤和炎症反应。
3.4 远志甘草制前后对大鼠肠道菌群的影响
3.4.1 对大鼠肠道菌群α多样性的影响 如表2所示,各组Coverage值均大于0.9,表明序列测序覆盖良好。与空白组比较,各给药组的Chao1、Ace、Shannon、Simpson指数均显著降低(<0.05、0.01);与等剂量远志组比较,制远志组Chao1、Ace、Shannon、Simpson指数均显著升高(<0.05、0.01)。表明远志经甘草制后能有效改善远志所致大鼠肠道菌群物种多样性减少现象。
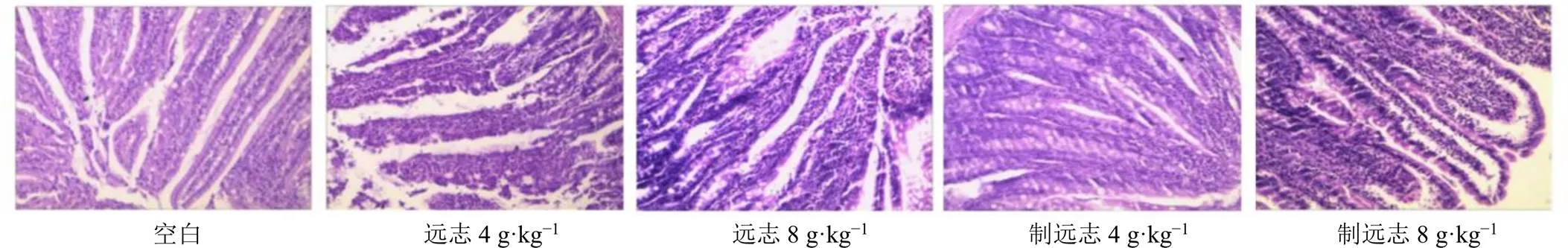
图2 远志甘草制前后对大鼠小肠组织病理特征的影响(HE, ×100)

表2 远志甘草制前后对大鼠肠道菌群α多样性的影响(, n = 6)
与空白组比较:P<0.05P<0.01;与等剂量远志组比较:P<0.05P<0.01
P< 0.05P< 0.01blank group;P< 0.05P< 0.01group with same dose
3.4.2 对大鼠肠道菌群β多样性的影响 采用主成分分析(principal component analysis,PCA)比较不同样本间的群落组成差异。提取各样品的16S rDNA序列的主成分因子,绘制PCA图(图3)。结果显示,与空白组的距离,制远志低剂量组最近,其次是制远志高剂量组,远志低、高剂量组与空白组的距离较远。说明远志显著改变了大鼠肠道微生物群落结构,远志经甘草制后可改善这一变化。
3.4.3 基于门水平的菌群结构差异分析 如图4-A所示,在门水平上,各组大鼠肠道菌群主要包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroides)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteriota),其中,以厚壁菌门丰度最高,其次是拟杆菌门。如图5-A所示,与空白组比较,远志低、高剂量组厚壁菌门和疣微菌门丰度显著降低(<0.05、0.01),拟杆菌门、变形菌门、放线菌门的丰度显著增加(<0.050.01);与等剂量远志组比较,制远志组厚壁菌门和疣微菌门丰度显著增加(<0.05、0.01),拟杆菌门、变形菌门和放线菌门丰度显著降低(<0.05、0.01),制远志低剂量组肠道菌群组成与空白组更相似。说明远志在门水平上可导致大鼠肠道菌群紊乱,而甘草制可一定程度地调节这一紊乱。
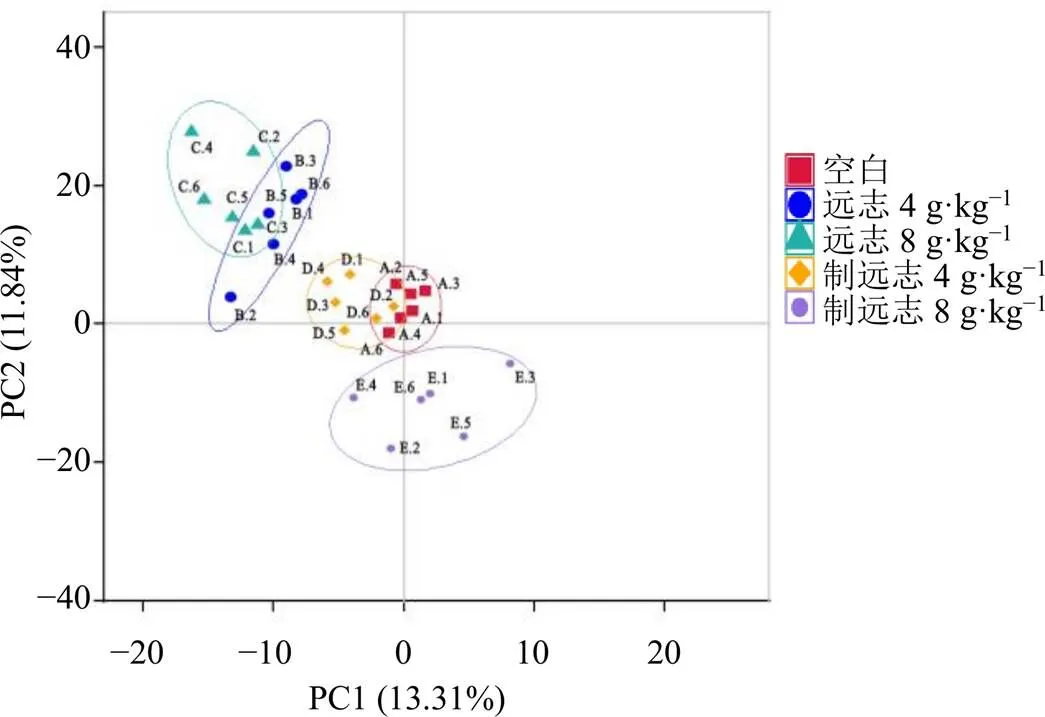
图3 远志甘草制前后对大鼠肠道菌群β多样性的影响
3.4.4 基于属水平的菌群结构差异分析 如图4-B所示,各样品组中相对丰度较高的菌属为拟杆菌属、乳酸杆菌属、毛螺菌属、毛螺菌属-NK4A136、梭状芽孢杆菌属、普雷沃氏菌属-UCG-001、雷尔氏菌属和颤螺旋菌属。如图5-B所示,与空白组比较,远志低、高剂量组拟杆菌属、-NK4A136和梭状芽孢杆菌属显著增加(<0.05、0.01),乳酸杆菌属显著减少(<0.05、0.01),远志高剂量组毛螺菌属、-UCG-001和颤螺旋菌属显著减少(<0.01)。与等剂量远志组相比,制远志组乳酸杆菌属、毛螺菌属、颤螺旋菌属的丰度显著增加(<0.05、0.01),拟杆菌属、梭状芽孢杆菌属呈降低趋势。说明远志甘草制后可上调有益菌乳酸杆菌属、毛螺菌属、颤螺旋菌属的丰度,下调潜在的致病菌拟杆菌属、梭状芽孢杆菌属的丰度。
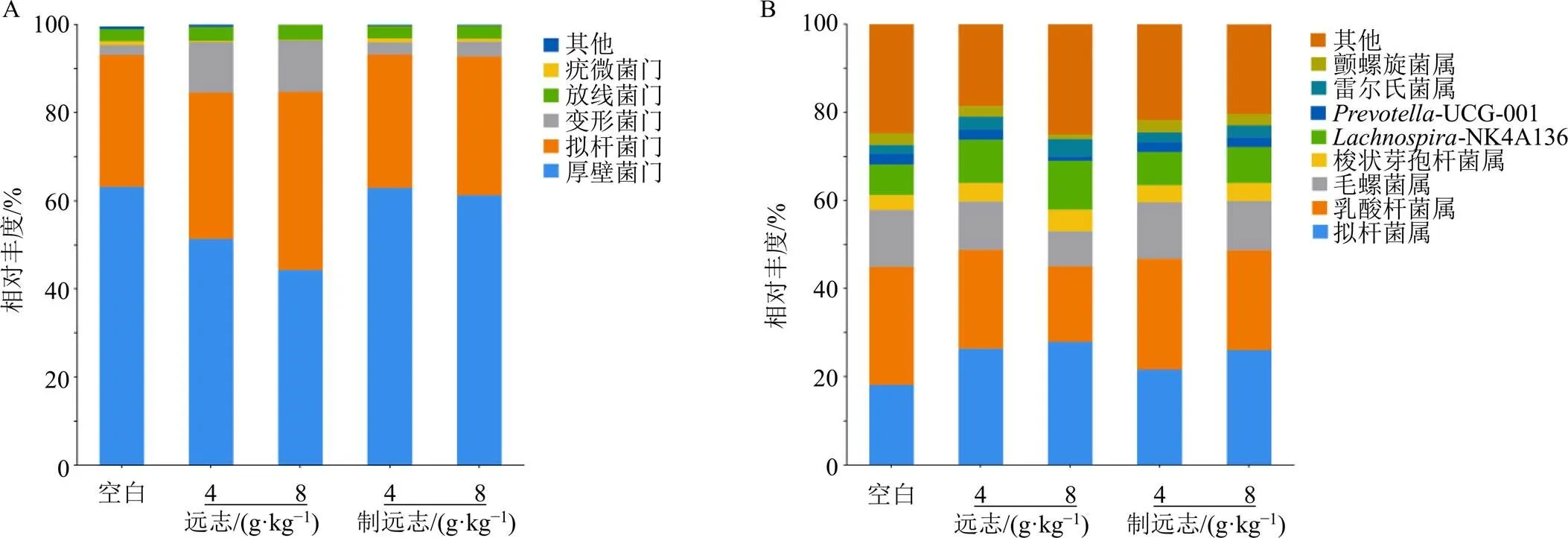
图4 肠道菌群分类门水平 (A)和属水平 (B)的物种组成分析
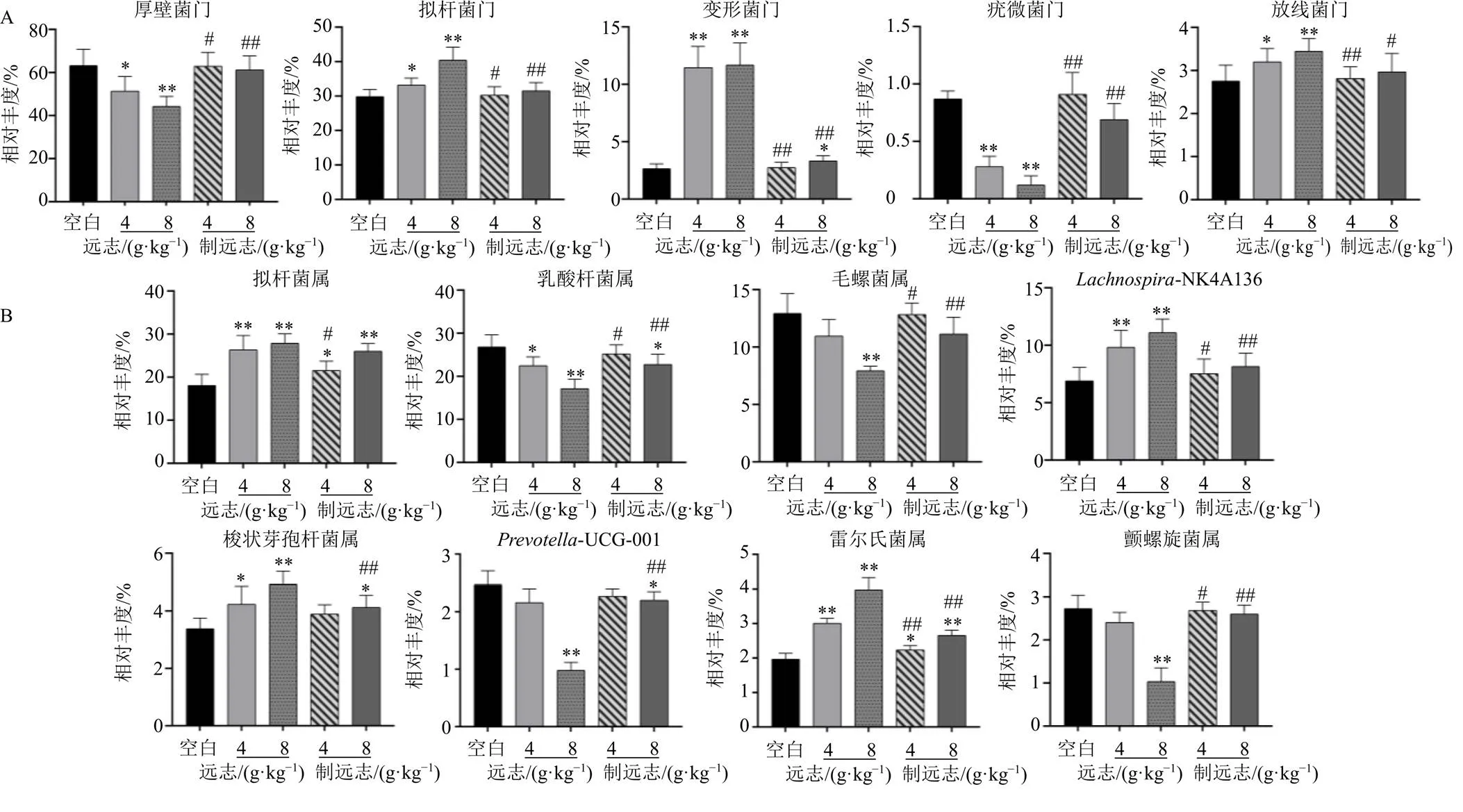
图5 肠道菌群分类门水平 (A)和属水平 (B)的物种组成差异分析(, n = 6)
3.5 远志甘草制前后对大鼠粪便中SCFAs水平的影响
如图6所示,与空白组比较,远志低、高剂量组大鼠粪便中乙酸、丙酸、丁酸和戊酸含量均显著降低(<0.05、0.01);与等剂量远志组比较,远志经甘草制后,乙酸、丙酸、丁酸和戊酸含量明显回升(<0.05、0.01)。说明远志可引起大鼠粪便中SCFAs水平紊乱,而甘草制可改善这一紊乱。
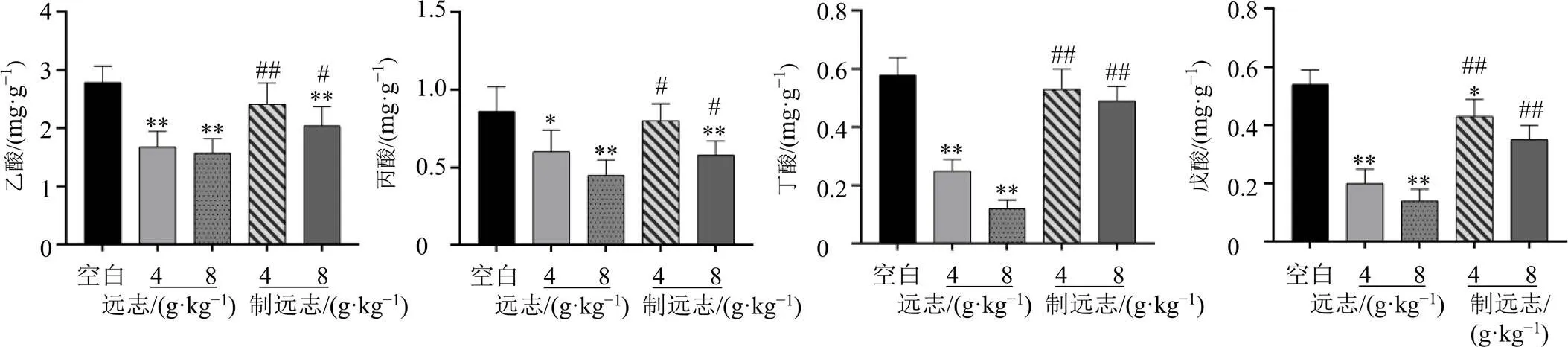
图6 远志甘草制前后对大鼠粪便中SCFAs水平的影响(, n = 6)
4 讨论
以往对远志炮制减毒研究主要聚焦在远志炮制前后成分、急性毒性和胃肠毒性变化方面,忽略了其对肠道菌群和SCFAs的影响。研究表明,肠道菌群失调,可诱导肠道免疫反应,损伤肠道黏膜屏障能力,进而导致肠道炎症[12]。SCFAs可抑制肠道内致病菌定植,维持肠上皮细胞形态、功能及肠道黏膜的完整性,并可调节机体的免疫炎症反应[13]。本研究表明,远志能够导致大鼠肠道黏膜损伤和肠道炎症,显著升高大鼠十二指肠组织中炎症因子水平,甘草制远志可改善远志导致的肠道炎症和肠道黏膜损伤。
肠道菌群紊乱常表现为菌群多样性的降低和结构组成的变化[14]。本研究结果表明,远志可导致大鼠肠道菌群丰富度和多样性减少,并可引起肠道菌群结构发生明显变化,而甘草制远志可不同程度改善远志导致的上述变化。远志可降低大鼠肠道中厚壁菌门和疣微菌门丰度,增加拟杆菌门、放线菌门、变形菌门丰度,可使正常大鼠肠道中有益菌乳酸杆菌属、毛螺菌属、颤螺旋菌属丰度显著降低,而潜在的致病菌拟杆菌属、梭状芽孢杆菌属丰度显著增加;远志经甘草制后可在一定程度上调节远志引起的上述肠道菌群门、属丰度变化,其调控结果与空白组更为接近。研究发现,厚壁菌门有众多有益菌,其中,乳酸杆菌有助于维护肠道微生态稳定,但当发生病毒感染和炎症反应时,肠道乳酸杆菌易受影响导致丰度下降[15]。变形菌门丰度提高会破坏肠道菌群稳态,加剧肠道疾病进展[16]。梭状芽孢杆菌属与肠道炎症疾病的发生密切相关[17]。而乳酸杆菌属作为肠道中重要的益生菌,在调节肠道菌群平衡方面发挥着重要的作用[18]。远志导致肠道内有益菌与致病菌比例失调,打破肠道内环境的平衡,引起肠道菌群紊乱。而远志经甘草汁煮制后可通过上调有益菌丰度并减少致病菌数量,改善菌群结构,从而维持肠道菌群平衡。远志甘草制后缓解肠道炎症分析与甘草制可调节肠道菌群紊乱有关。
厚壁菌门是肠道菌群中产生SCFAs的优势菌种,其下的梭菌科是产生丁酸的主要菌种[19]。SCFAs可调节肠道内环境平衡,减少炎症反应的发生[20]。SCFAs可缓解结肠炎症和氧化应激反应,为结肠上皮细胞提供充足的能量,加快细胞增殖,从而增强肠道的免疫屏障[21]。丙酸能够减少促炎因子的表达,有利于修复黏膜炎症,还可提高肠上皮细胞闭锁连接蛋白-1表达水平,从而提高肠道黏膜的屏障功能[22]。本研究结果表明,正常大鼠ig远志提取物后,其粪便中乙酸、丙酸、丁酸和戊酸水平显著降低,而制远志提取物大鼠粪便中乙酸、丙酸、丁酸和戊酸水平较远志明显回升,其原因分析与甘草制远志可调节肠道菌群有关。远志甘草制后降低肠道炎症与甘草制可调节肠道SCFAs代谢紊乱有关。
课题组前期研究表明,远志经甘草炆制后远志皂苷B含量显著降低,并增加新成分甘草苷、甘草酸[23]。甘草中主要成分甘草苷和甘草酸具有抗炎作用[24]。另有研究报道,皂苷类成分为远志的主要毒性成分,远志总皂苷、远志皂苷B均可显著增加兔离体肠管的收缩幅度,远志皂苷B对大鼠胃肠道刺激和损伤作用明显大于细叶远志皂苷[25]。本研究结果表明,远志引起的肠道炎症可能与其引起肠道菌群和SCFAs紊乱有关,甘草制远志可通过改善肠道菌群和SCFAs代谢来降低肠道炎症反应。据本研究结果结合文献报道,推测远志甘草制后肠毒性降低可能与皂苷含量降低和辅料甘草的添加有关,有待深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 163.
[2] 王瑞, 吴桐, 刘悦, 等. 远志和蜜远志对小鼠胃肠的急性毒性作用 [J]. 中国中医药现代远程教育, 2018, 16(8): 88-90.
[3] 李振岚, 吴红旗. 远志炮制减毒增效作用的研究进展 [J]. 实用临床医药杂志, 2023, 27(8): 135-138.
[4] 高慧, 熊晓莉, 张青, 等. 基于UPLC-LTQ-Orbitrap MS技术分析远志炮制前后成分变化 [J]. 中药新药与临床药理, 2021, 32(12): 1845-1854.
[5] 栾茹乔, 张学兰, 吴鹏, 等. HPLC法测定远志及其3种炮制品中3种寡糖酯 [J]. 中成药, 2017, 39(8): 1666-1669.
[6] Cui Y L, Zhao X, Tang Y Q,. Comparative study on the chemical components and gastrointestinal function on rats of the raw product and licorice-simmered product of[J]., 2021, 2021: 8855536.
[7] Zhou B L, Yuan Y T, Zhang S S,. Intestinal flora and disease mutually shape the regional immune system in the intestinal tract [J]., 2020, 11: 575.
[8] Amoroso C, Perillo F, Strati F,. The role of gut microbiota biomodulators on mucosal immunity and intestinal inflammation [J]., 2020, 9(5): 1234.
[9] Liu P Y, Wang Y B, Yang G,. The role of short-chain fatty acids in intestinal barrier function, inflammation, oxidative stress, and colonic carcinogenesis [J]., 2021, 165: 105420.
[10] Parada Venegas D, De la Fuente M K, Landskron G,. Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases [J]., 2019, 10: 277.
[11] 蒋恺憧, 程悦, 焦圣寅, 等. 粪便中6种短链脂肪酸的气相色谱快速检测法 [J]. 现代预防医学, 2020, 47(4): 686-689.
[12] 金博. 肠道菌群移植与溃疡性结肠炎 [J]. 世界华人消化杂志, 2017, 25(1): 23-30.
[13] 王程瑶, 张政, 吴静. 肠道短链脂肪酸在炎症性肠病中的研究进展 [J]. 中国医刊, 2022, 57(12): 1302-1307.
[14] 陈启军, 于岚, 赵文文, 等. 远志提取物对抑郁大鼠肠道菌群的作用研究[J]. 中草药, 2021, 52(8): 2313-2323.
[15] Wang Y, Wu Y P, Wang Y Y,. Antioxidant properties of probiotic bacteria [J]., 2017, 9(5): 521.
[16] Litvak Y, Byndloss M X, Tsolis R M,. Dysbiotic proteobacteria expansion: A microbial signature of epithelial dysfunction [J]., 2017, 39: 1-6.
[17] 郑东宇, 周翌婧, 晏路标, 等. 梭状芽孢杆菌属致新生儿坏死性小肠结肠炎关联性分析 [J]. 公共卫生与预防医学, 2021, 32(2): 7-11.
[18] 黄小娟. 乳酸杆菌联合甲硝唑治疗妊娠合并滴虫性阴道炎的临床疗效 [J]. 中国医药指南, 2022, 20(19): 43-46.
[19] Louis P, Hold G L, Flint H J. The gut microbiota, bacterial metabolites and colorectal cancer [J]., 2014, 12(10): 661-672.
[20] Thorburn A N, Macia L, MacKay C R. Diet, metabolites, and “western-lifestyle” inflammatory diseases [J]., 2014, 40(6): 833-842.
[21] Furusawa Y, Obata Y, Fukuda S,. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells [J]., 2013, 504(7480): 446-450.
[22] Tong L C, Wang Y, Wang Z B,. Propionate ameliorates dextran sodium sulfate-induced colitis by improving intestinal barrier function and reducing inflammation and oxidative stress [J]., 2016, 7: 253.
[23] 崔月莉, 吴鹏, 张丹捷, 等. 远志与炆远志HPLC指纹图谱比较 [J]. 中药材, 2020, 43(3): 575-581.
[24] Zheng Z, Xu Y, Liu F,. Screening bioactive components ofFisch. with isolated perfused lung extraction and HPLC-ESI-MSnanalysis [J]., 2019, 169: 127-132.
[25] Wen L, Xia N, Tang P P,. The gastrointestinal irritation of polygala saponins and its potential mechanismand[J]., 2015, 2015: 918048.
Mechanism of licorice-boiledon reducing intestinal inflammation based on intestinal flora and short-chain fatty acid metabolism
WANG Zi-yu, ZHANG Zhi-hui, WU Peng, LI Hao-ran, ZHAO Meng, HE Meng-jiao, ZHANG Xue-lan, ZHAO Xin
College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China
To study the effects of Yuanzhi () on intestinal flora and metabolism of short chain fatty acids (SCFAs) in normal rats before and after licorice processing, and explore the mechanism of licorice-boiledon reducing intestinal inflammation.SD rats were igor licorice-boiledfor 15 d, levels of inflammatory factors such as interleukin-6 (IL-6), IL-8 and tumor necrosis factor-α (TNF-α) in duodenal tissue were detected by ELISA; Pathological changes of intestinal tissue were observed by hematoxylin-eosin staining; 16S rDNA sequencing technique was used to detect the structural changes of intestinal flora in rats; Contents of acetic acid, propionic acid, butyric acid and valeric acid in feces of rats were determined by gas chromatography (GC).Licorice-boiledsignificantly reduced the levels of IL-6, IL-8 and TNF-α in duodenal tissue and intestinal inflammatory damage caused by(< 0.05, 0.01).The results of 16S rDNA sequencing showed that licorice-boiledcould improve the structural changes of intestinal flora and decrease the species diversity caused byin rats. At the phylum level, the relative abundance of Firmicutes and Verrucomicrobia were increased (< 0.05, 0.01), while the relative abundance of Bacteroidetes, Proteobacteria and Actinobacteriota were decreased (< 0.05, 0.01). At the genus level, the abundance of beneficial bacteria such as,andwere increased (< 0.05, 0.01), and the abundance of potential pathogenic bacteria such asandwere decreased after licorice-boiling. Licorice-boiledcould reverse the decrease of acetic acid, propionate, butyric acid and valerate in rat feces caused byto a certain extent (< 0.05, 0.01).The intestinal inflammation caused bymay be related to the disorder of intestinal flora and SCFAs. Licorice-boiledcan reduce the intestinal inflammatory reaction by improving the metabolism of intestinal flora and SCFAs.
; licorice-boiled; intestinal inflammation; intestinal flora; short chain fatty acids; polygalaxanthone III; 3,6′-disinapoyl sucrose
R285.5
A
0253 - 2670(2023)14 - 4556 - 08
10.7501/j.issn.0253-2670.2023.14.016
2023-02-27
国家自然科学基金面上项目(82173974);国家中医药管理局中药炮制技术传承地项目(国中医药科技中药[2022]59号);国家重点研发计划课题(2018YFC1707204)
王梓宇(1997—),女,硕士研究生,研究方向为中药炮制原理与饮片质量控制。E-mail: wangziyu5899@163.com
张学兰(1963—),女,博士生导师,教授,主要从事中药炮制原理与饮片质量控制研究。E-mail: zhang8832440@sina.com
赵 鑫(1991—),女,讲师,主要从事中药饮片制备技术与质量控制研究。E-mail: 137462537@qq.com
[责任编辑 李亚楠]

